基于生物信息数据库分析含DEP结构域的蛋白质1在子宫内膜癌中的表达和预后意义
赵车冬,王敏娟,周 萍,陈 葳
(西安交通大学第一附属医院 检验科,陕西 西安 710061)
最新的癌症统计数据显示,子宫内膜癌(Endometrial cancer,EC)在美国女性常见肿瘤发病率中排名第4,也是女性生殖系统最常见的一种上皮性恶性肿瘤,2021年预计新发病例达66 570例,死亡病例达12 940例[1]。子宫内膜癌的发病机制复杂,微卫星不稳定增加,p53基因突变以及多种信号通路的异常均可影响子宫内膜癌的进展和预后。但是目前缺乏对其早期诊断和预后判断的有效生物标志物。因此筛选生物标志物对预测EC的转移和复发,有效监测EC患者的预后至关重要。
在前期的工作中,我们通过生物信息学方法筛选了子宫内膜癌相关的生物标志物,结果提示含DEP 结构域的蛋白质1 (DEP domain containing 1,DEPDC1) 可能是子宫内膜癌的发生发展过程中一个关键基因,可以作为子宫内膜癌新的生物标志物和潜在治疗靶点[2]。DEPDC1是一个新的肿瘤相关基因。Kanehira等首先发现DEPDC1在膀胱癌组织中高表达,利用siRNA敲低DEPDC1基因表达,可以抑制膀胱癌细胞的生长[3]。DEPDC1基因编码的蛋白含有DEP结构域,可能作为转录辅助抑制因子参与转录调控。近年来的研究表明,DEPDC1在包括肝癌[4]、乳腺癌[5]等多种肿瘤中呈现过表达状态,可能成为这些恶性肿瘤分子靶向治疗的新靶点。但是DEPDC1在子宫内膜癌中的作用尚未明确。本研究基于多个生物信息数据库探讨DEPDC1基因在子宫内膜癌中的表达和预后意义。
1 材料与方法
1.1 阿拉巴马癌症数据库(University of alabama cancer,UALCAN)分析 UALCAN(http://ualcan.path.uab.edu)[6]是一个综合的交互式的在线网络资源,用于分析癌症组学数据。输入基因名称“DEPDC1”,选择“子宫内膜癌”,UALCAN分析工具基于TCGA数据库的数据,分析DEPDC1 mRNA在正常子宫内膜组织和子宫内膜癌中的差异表达,以及DEPDC1 mRNA表达与子宫内膜癌临床病理特征的相关性。同时,UALCAN分析工具还可以提供基于TP53突变状态的基因和miRNA表达。TP53突变状态是通过TCGA全外显子组测序数据获得的。
1.2 人类蛋白质表达图谱数据库(The human protein atlas,HPA) HPA是基于RNA测序分析和免疫组化分析的大型转录组和蛋白组数据库(https://www.proteinatlas.org)[7],可用于正常组织和肿瘤组织蛋白差异表达分析。本研究利用HPA提供的免疫组化信息,在蛋白水平比较DEPDC1在子宫内膜癌组织及正常子宫内膜组织中的表达差异,分别从染色(Stain)、强度(Intensity)和数量(Quantity)3方面来比较。数据采用SPSS19.0进行处理,组间比较采用Mann-WhitneyU检验。P<0.05表示差异具有统计学意义。
1.3 Kaplan-Meier Plotter生存分析 利用Kaplan-Meier Plotter(http://kmplot.com/analysis/)[8]分析DEPDC1基因表达与子宫内膜癌患者的总体生存率(OS)和无进展生存率(PFS)的相关性。选择Kaplan Meier-plotter中的子宫内膜癌数据集,该数据集来自TCGA数据库,包含543例子宫内膜癌患者的RNA测序数据和生存数据。P<0.05表示生存差异具有统计学意义。
1.4 蛋白质相互作用网络分析 STRING数据库汇集了已证实的和预测的蛋白-蛋白相互作用(Protein-Protein Interaction,PPI),DEPDC1蛋白相关的PPI网络分析利用STRING(v 11.0)在线工具(https://string-db.org/)[9]进行分析,蛋白名称输入“DEPDC1”,物种选择“Homo sapiens”,默认设置参数minimum required interaction score为中等(≥0.4)。
1.5 基因本体(Gene ontology,GO)和信号通路富集分析 利用Metascape在线分析工具(https://metascape.org/)[10],对与DEPDC1相互作用蛋白的基因进行功能注释,包括生物过程(BP)、细胞组分(CC)和分子功能(MF)的GO分析以及KEGG信号通路富集分析,定义为P<0.05。

2 结果
2.1 DEPDC1 mRNA在正常子宫内膜组织和子宫内膜癌组织中的表达 我们首先在UALCAN数据库中利用TCGA数据库子宫内膜癌组织的RNA测序数据来分析DEPDC1 mRNA在正常子宫内膜组织(n=35)和子宫内膜癌组织(n=546)中的表达,结果显示,与正常子宫内膜组织相比,DEPDC1 mRNA在EC中表达明显升高,差异具有统计学意义(见图1)。

图1 DEPDC1 mRNA在子宫内膜癌组织和正常子宫内膜组织中的表达
2.2 DEPDC1 mRNA表达与子宫内膜癌临床病理特征的相关性 利用UALCAN数据库检测DEPDC1 mRNA表达与EC临床病理特征的相关性,结果显示,DEPDC1的表达与种族相关(见图2A),相对高加索人群,黑人的DEPDC1 mRNA表达水平较高(P=1.73E-02)。DEPDC1 mRNA在各期别EC组织中的表达明显高于正常组织(P<0.01),但是不同分期EC组织的DEPDC1 mRNA表达无显著差别(P>0.05,见图2B)。DEPDC1 mRNA的表达与EC组织类型相关,在浆液性腺癌中的表达高于子宫内膜样腺癌,差异具有统计学意义(P<0.05,见图2C)。此外,根据UALCAN数据库提供的基于TP53突变状态的基因表达,DEPDC1 mRNA在TP53基因突变的子宫内膜癌组织中的表达高于TP53基因未发生突变的子宫内膜癌组织(P<0.01,见图2D)。
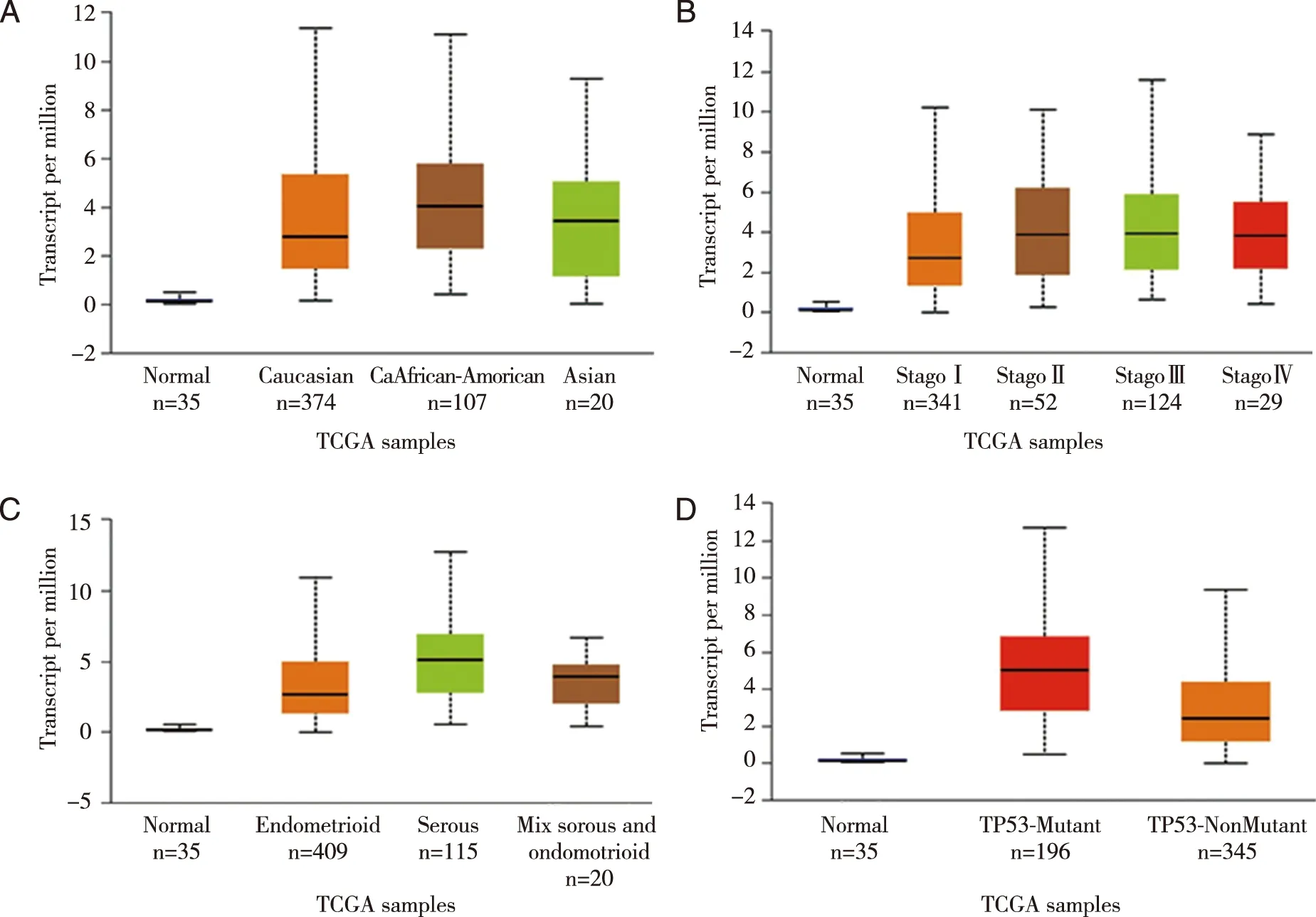
A:DEPDC1的表达与人种的关系;B:DEPDC1的表达与临床分期的关系;C:DEPDC1的表达与组织类型的关系;D:DEPDC1的表达与TP53突变状态的关系。图2 DEPDC1与子宫内膜癌临床病理特征的相关性
2.3 DEPDC1蛋白在正常子宫内膜组织和子宫内膜癌组织中的表达 进一步利用HPA数据库分析DEPDC1蛋白在子宫内膜癌组织及正常子宫内膜组织中的表达差异。在6例正常子宫内膜组织中,DEPDC1蛋白的表达均为阴性,在11例子宫内膜癌组织中,DEPDC1蛋白呈低-中表达(见表1,图3)。进一步证实,DEPDC1蛋白在子宫内膜癌组织中的表达较正常子宫内膜组织升高。
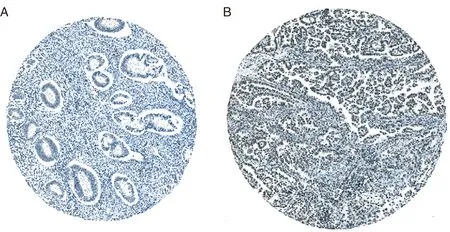
免疫组织化学染色图片下载于the Human Protein Atlas数据库(https://www.proteinatlas.org);A:Normal;B:EC。图3 DEPDC1蛋白在正常子宫内膜组织和EC中的表达
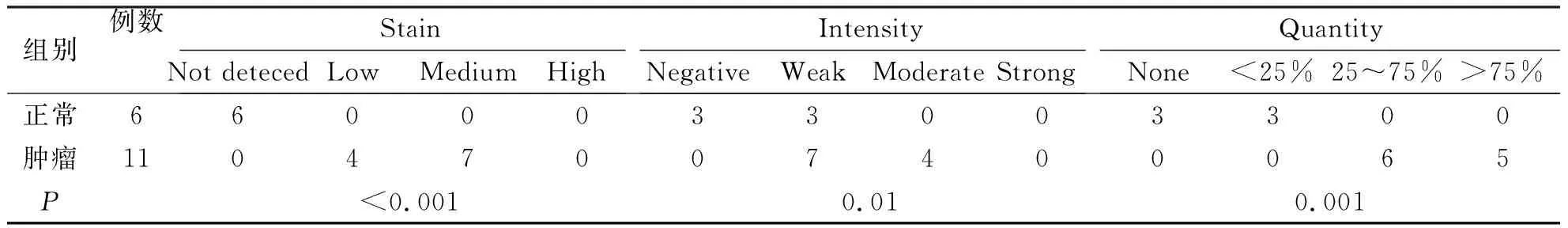
表1 HPA数据库中DEPDC1蛋白在正常子宫内膜组织和EC组织中的免疫组化染色统计
2.4 DEPDC1 mRNA表达与子宫内膜癌患者生存率的关系 根据DEPDC1表达水平高低,利用Kaplan-Meier Plotter数据库在线分析子宫内膜癌患者生存率与DEPDC1表达水平的相关性,结果显示,高表达DEPDC1的EC患者的总体生存率和无进展生存率明显降低(见图4A、B),提示DEPDC1高表达与EC患者不良预后有关。
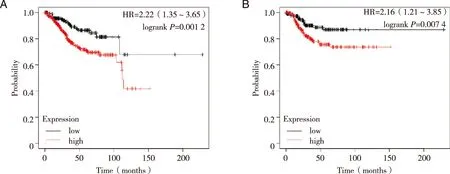
A:总体生存率;B:无进展生存率。图4 DEPDC1表达与EC预后的关系
2.5 DEPDC1相互作用蛋白网络及GO分析 将DEPDC1按前述条件输人STRING数据库,PPI结果如图5A所示。PPI富集节点为11个,P< 1.0 e-16。与DEPDC1相互作用的蛋白分子包括DLGAP5、TOP2A、KIF11、CENPF、BUB1B、ASPM、ARHGAP11A、KIF20A、CEP55(Score>0.4),主要参与的生物过程有有丝分裂核分裂、姐妹染色单体分离、染色体定位、减数分裂核分裂、基于微管的运动等(见表2,图5B)。

表2 与DEPDC1相互作用的蛋白分子的GO分析

A:DEPDC1相互作用蛋白网络;B:DEPDC1相互作用蛋白的GO分析。图5 DEPDC1相互作用蛋白网络及GO分析
3 讨论
尽管治疗手段不断进步,晚期子宫内膜癌的预后仍然较差,在全球,2018年预计有38万新发病例,而有8.9万人死于子宫内膜癌[11]。DEP 结构域是以Dishevelld、EGL-10 和Pleckstrin 3种蛋白的首字母命名的,因为它首先在这3种蛋白中被发现。含DEP结构域的蛋白质与包括细胞信号转导、极性确定和细胞膜锚定等多种生理功能有关[12]。DEPDC1 是一个含有DEP 结构域的癌蛋白,正常情况下,在除了睾丸以外的组织中低表达或不表达[13]。为了探究DEPDC1与子宫内膜癌的关系,本研究通过全面的生物信息学数据挖掘对DEPDC1在子宫内膜癌中的表达、临床意义及潜在功能进行分析。
TCGA数据库包含了30多种癌症的基因组、转录组测序数据以及临床病理信息。HPA数据库提供人类蛋白质在组织和细胞的分布。利用这两个数据库,本研究首先分析了DEPDC1 mRNA和蛋白在正常子宫内膜组织和子宫内膜癌中的表达。结果表明,DEPDC1 mRNA和蛋白在子宫内膜癌组织中均表达升高。随后,利用TCGA中子宫内膜癌相关数据分析DEPDC1与EC临床病理参数及预后的关系,结果表明DEPDC1的表达与人种、EC组织类型相关,并且在TP53突变型EC中的表达高于TP53野生型EC。根据Kaplan-Meier Plotter数据库的分析结果,DEPDC1在子宫内膜癌中的高表达与患者不良预后相关,提示DEPDC1可能参与了子宫内膜癌的恶性表型和进展,但仍需要临床资料和实验验证。
随着分子诊断技术的发展,也逐渐认识到传统病理分型对于EC的局限性。根据全基因组、转录组的测序数据、DNA甲基化分析及微卫星不稳定性(MSI)分析,TCGA[14]将EC分为POLE 超突变型、MSI高突变型、低拷贝数(Copy number low,CN-L) 型和高拷贝数(Copy number high,CN-H) 型四个亚型。其中CN-H型是异质性最高,预后最差的一种亚型,主要特征为广泛的体细胞拷贝数变异和TP53 (高达92%)、PPP2R1A(22%)、PIK3CA(47%)的突变[15]。在本研究中,利用UALCAN数据库的TP53突变数据,将子宫内膜癌分为TP53突变型和TP53野生型,分析结果显示,DEPDC1在TP53突变型EC中的表达高于TP53野生型EC,提示TP53突变可能参与DEPDC1基因的表达调控,DEPDC1可能与EC的组织分子亚型有关,可能成为EC分子靶向治疗的新靶点。
目前对DEPDC1基因在肿瘤中的作用机制研究尚未完全明确。研究表明DEPDC1A-ZNF224复合物可能通过抑制A20基因的转录,导致NF-KB蛋白转运至细胞核,从而抑制膀胱癌细胞的凋亡,在膀胱癌中发挥重要作用[16]。另有学者发现,在子宫内膜癌中,DEPDC1基因可能作为原钙粘蛋白10的下游分子参与子宫内膜癌的发生发展[17]。但是DEPDC1基因在子宫内膜癌中的功能及作用机制仍不明确。本研究利用STRING数据库对DEPDC1相互作用蛋白进行分析,并进行功能富集分析,分析结果提示富集于有丝分裂的核分裂、染色体分离以及微管相关运动,为DEPDC1后续的功能研究可以提供分析的方向,但后续研究仍需要在细胞、动物模型和组织中进行验证。
DEPDC1是否可作为诊断标志物和预后预测指标以广泛应用于其他癌症仍有待研究,而且其临床应用价值尚有待检验。总之,关于DEPDC1 在癌症中的作用还需广泛深入的研究,将可能为相关癌症的诊断和治疗提供一种新的选择,进而提高相关癌症患者的生存质量。

