Collagen III和Smad2在犬裁剪去粘膜回肠输尿管中的表达
谢辉辉,杨登浩,付荣波,赵泽驹
(遵义医科大学附属医院 泌尿外科, 贵州 遵义 563099)
输尿管长段或全段缺损的替代治疗主要采用回肠,术后并发症多而呈现多种改良,但始终未能显著降低并发症发生率[1]。裁剪去粘膜回肠输尿管短期实验研究显示效果较好,并发症显著降低,但其管壁损伤、感染和尿液刺激势必诱发炎症反应,术后管壁纤维化可能性较大,远期效果如何尚且不知[2]。Collagen III和Smad2是公认的组织损伤、炎症至纤维化的关键因子,检测其在1年期模型犬回肠输尿管中的表达,结合形态结构变化,可以评估裁剪去粘膜回肠输尿管稳定性和远期效果。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 实验用比格犬5只,1~2岁龄,12~13 kg/只,购买于陆军医科大学实验动物中心(伦理审查编号:KLLY(A)-2019-033),饲养于遵义医科大学动物实验中心(SP级),饲养2周后实施手术。
1.1.2 主要试剂 RNA Trizol Reagent(批号vs18061730),购自合肥博美生物科技有限公司生产; TBGreen TM Premix Ex TaqTM Ⅱ(货号RR820A),RT-PCR:PrimeScript RT reagent Kit(货号RR047A),购自宝日医生物技术有限公司;抗体 Collagen III抗体,兔克隆抗体(货号:22734-1-ap),购自Proteintech公司;Smad2抗体,兔克隆抗体(货号:a7699),购自ABClone公司;β-actin抗体,鼠克隆抗体,(货号:T0022),购自Affinity公司;生物素化山羊抗鼠抗兔IgG(H+L),(货号:ab6789、货号:ab6721),购自英国Abcam--艾博抗(上海)贸易有限公司;目的基因一抗: Collagen Ⅲ,兔多克隆抗体(货号:bs-0549),购自北京博奥森生物技术有限公司;Smad2,兔多克隆抗体,(货号BA0412),购自BOSTER公司;生物素二抗:山羊抗兔工作液,(货号SP-9001),购自北京中杉金桥生物有限公司。
1.2 实验方法
1.2.1 模型建立与取样 实验用5只比格犬,雌雄比为2∶3,参照前期实验方法建立动物模型[3],术前禁食 12 h,采用戊巴比妥钠腹腔注射麻醉后、取仰卧位、备皮,消毒铺巾后、取腹正中线开腹、探查,分离、显露、切除左肾及输尿管,结扎并缝扎肾蒂及输尿管远端;显露膀胱、找到右侧输尿管,充分游离至右肾门,于肾盂输尿管连接部及膀胱输尿管连接部切除整段右侧输尿管,并缝扎膀胱输尿管连接部断端;距回盲部约10 cm处取带蒂回肠段约13~15 cm,原回肠于系膜前端端吻合,恢复连续性,间断缝合关闭系膜裂口。带蒂回肠段用0.05%碘伏冲洗致无渣,钳夹固定对系膜侧1/2肠壁,纵向裁剪切除;系膜侧肠片粘膜剥脱,包裹F10号橡胶导尿管,3-0可吸收线连续锁边缝合成管状,用F5号双“J”管替换导尿管,近端与右肾盂、远端与膀胱吻合; 检查代输尿管无尿瘘及缺血,腹腔无出血及肠扭转,术区喷洒甲硝唑,关腹,术后观察犬存活状态,常规使用头孢3~5 d,做好饲养记录,观察进食、排便和排尿、活动情况,期间因肠梗阻死亡一只(雄性),存活4只。术后4周拔出双“J”管,1年后取样,取样前于麻醉下实施静脉肾盂造影(IVU)后,解剖观察腹腔、回肠输尿管在体状态,切取回肠代输尿管4条,同时切取回肠远段约3.0 cm肠段做对照;样本组织各取1份储存于﹣80℃冰箱,另1份用10%福尔马林固定。
1.2.2 HE与Masson染色 固定24 h样本,按常规HE和Masson制作方法,制备石蜡切片并染色,封片后采集图像及分析。
1.2.3 免疫组化 参照试剂盒说明,用SP法检测Collagen III和Smad2的表达。切片脱蜡、水化、抗原修复、封闭后,滴加一抗后4 ℃孵育过夜,次日,滴加生物素化二抗室温孵育30 min,后进行DAB显色,镜下控制反映时间、蒸馏水洗涤、苏木素染色、脱水透明后,中性树胶封片,镜下观察Collagen III和Smad2的表达,阳性结果呈黄色或棕黄色,并用Image-Pro Plus 6.0分析计算平均光密度。
1.2.4 Western blot 分别取各组织样本,加RIPA裂解液,冰上裂解、离心取上清液;提取蛋白后,用BCA蛋白定量法测定浓度,制备标准蛋白样品。根据试剂盒说明配胶,加样,电泳1.5 h,半干法转膜1~2 h,再用脱脂牛奶2 h封闭,洗膜;将PVDF膜放入一抗中,(一抗浓度:Collagen III1:1 000;Smad2 1∶1 000;β-actin 1∶5 000),摇床上轻摇,4 ℃孵育过夜;洗膜;再将PVDF膜放入相应二抗中(生物素化山羊抗兔抗鼠IgG(H+L)1∶5 000),摇床轻摇,室温孵育2~3 h;洗膜。用ECL显影,应用凝胶成像系统获取曝光图像并测定分析目的蛋白相对光密度积分值。
1.2.5 Real-time PCR检测 按照动物组织RNA提取试剂盒说明书采用Trizol法提取总RNA、检测浓度并配置标准RNA样品。引物设计Collagen III:上游GACCTGGTTGCTTCTCGCTCTG,下游ATTTGGCACGGTTCTGGCTTCc;Smad-2:上游TGCTGCTCTCCTGGCTCAGTC,下游GTGCTCGTTACCGTCTGCCTTC;按照试剂盒说明,进行逆转录反应,扩增(条件:先95 ℃预变性30 s,后95 ℃变性5 s,然后55 ℃退火30 s,再72 ℃充分延伸30 s,循环45次);以β-actin为对照,根据检测结果,采用2- △△CT值方法对目的基因表达量进行相对定量分析。

2 结果
2.1 形态结构与组织病理 模型犬术后1年时存活4只,1只肠梗阻死亡。IVU:肾、输尿管显影,输尿管蠕动存在、排尿通畅,管腔无明显狭窄(见图1A);在体观察腹腔无明显积液、积脓,回肠输尿管周围轻度粘连,未触及疤痕疙瘩,分离后见其外形完整,蠕动存在;剖开见管壁厚薄均匀,无局部增厚与变薄,管腔光滑,无明显狭窄,管壁柔软(见图1B、C)。实验与对照组回肠壁结构完整,HE和Masson染色由内向外可见粘膜层、粘膜下层、肌肉及浆膜层,各层界限清楚、无明显炎细胞浸润,胶原层无显著增厚(见图2、3)。
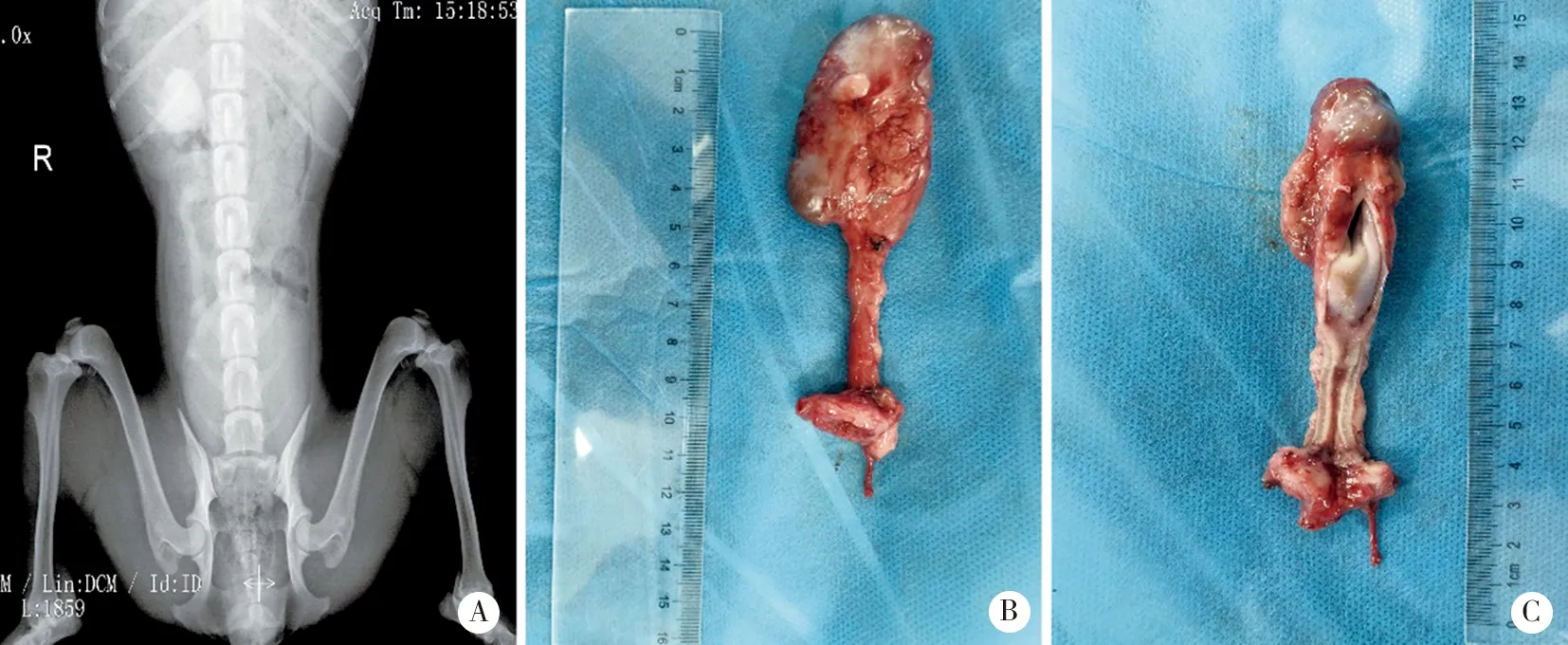
A:IVU肾输尿管显影;B和C:CMSPI无扩张、管腔通畅、管壁均匀、腔面光滑。图1 裁剪去粘膜回肠输尿管(CMSPI)造影及肉眼观
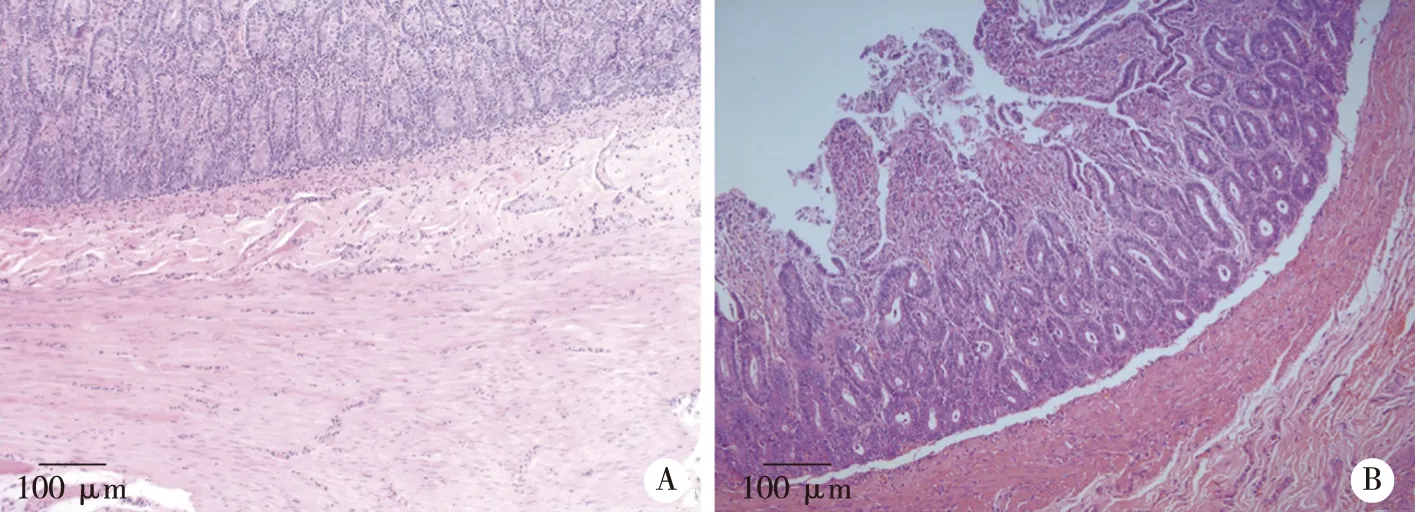
A:正常回肠;B: CMSPI四层结构;HE×40。图2 正常回肠与裁剪去粘膜回肠输尿管CMSPI粘膜结构HE染色对比
2.2 免疫组化 Collagen III在细胞质及细胞间质、Smad2在细胞核、细胞质及细胞间质中见棕黄色颗粒,即阳性表达,未见棕黄色颗粒,即阴性表达(见图4)。对照组组织中未见棕黄色颗粒,实验组偶见淡黄色颗粒,Collagen III两组IOD值比较无显著性差异(P>0.05),Smad2实验组较对照组明显降低(P<0.05)。
2.3 Western blot 正常回肠及正常输尿管与CMSPI中Collagen III和Smad2表达量比较无统计学差异(P>0.05);不具有统计学意义(见图5)。

A:正常回肠;B :CMSPI四层结构;Masson×40。图3 正常回肠与裁剪去粘膜回肠输尿管(CMSPI)粘膜结构Masson染色对比
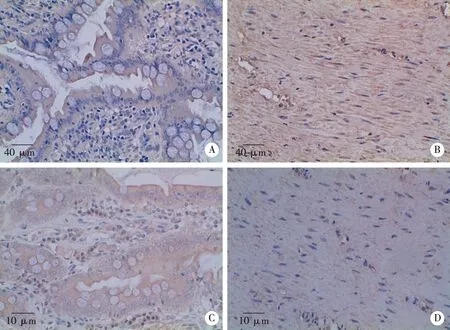
A、B:正常回肠与CMSPI中Collagen III表达检测(SP×400),仅CMSPI有少量表达;C、D:正常回肠与CMSPI中Smad2表达检测(SP×400),两组均少量表达;黄色箭头为阳性表达。图4 正常回肠与裁剪去粘膜回肠输尿管(CMSPI)免疫组化结果对比
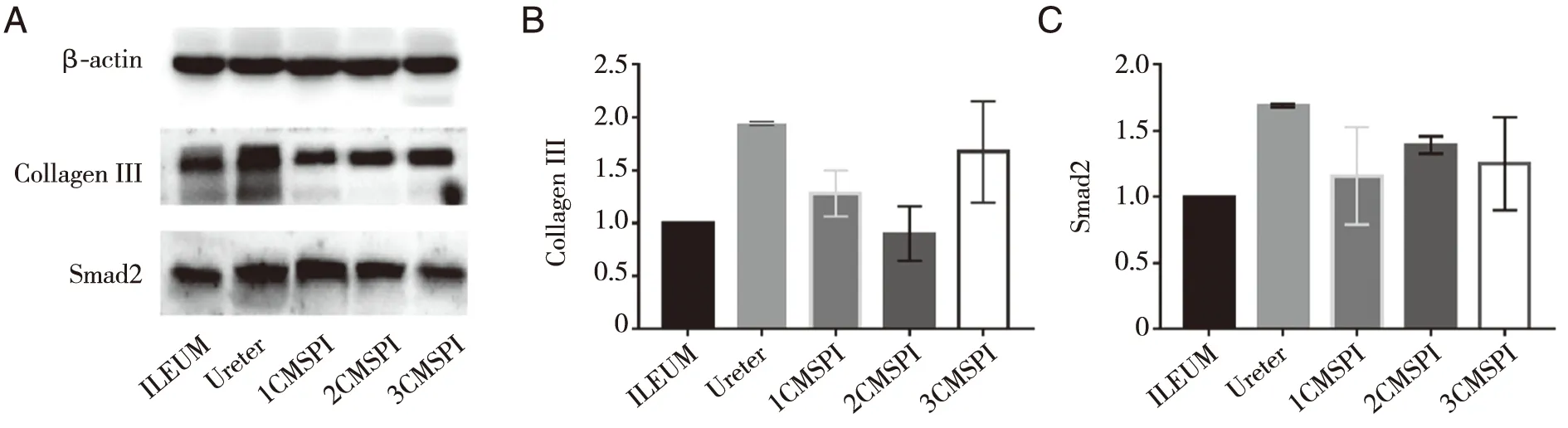
A:Western blotting检测Collagen III和Smad2表达量条带;B:Collagen III表达水平的统计分析;C :Smad2表达水平的统计分析;采用单因素方差分析检验统计学差异性,结果正常回肠与CMSPI两者P>0.05;(ILEUM:正常回肠;Ureter:正常输尿管;1CMSPI:裁剪去粘膜回肠输尿管上段、2CMSPI:裁剪去粘膜回肠输尿管中段、3CMSPI:裁剪去粘膜回肠输尿管下段)。图5 Western blotting检测正常回肠、正常输尿管、裁剪去粘膜回肠输尿管(CMSPI)中Collagen III,Smad2表达水平
2.4 Real-time PCR CMSPI与正常回肠Collagen III及Smad2表达量比较无显著差异(P>0.05,见图6)。
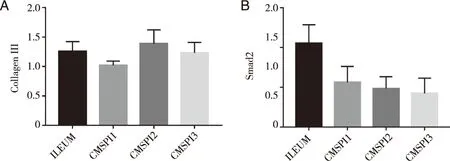
A: Collagen III相对表达量统计; B: Smad2相对表达量统计;*:与ILEUM相比P<0.05;(ILEUM:正常回肠;1CMSPI:裁剪去粘膜回肠输尿管上段、2CMSPI:裁剪去粘膜回肠输尿管中段、3CMSPI:裁剪去粘膜回肠输尿管下段)。图6 RT-PCR检测正常回肠、裁剪去粘膜回肠(CMSPI)Collagen III和Smad2基因表达水平
3 讨论
临床上超过15cm以上输尿管缺损较为少见,主要是医源性因素所致,多采用回肠代输尿管治疗[4]。该方法术后感染、梗阻、返流和尿中废物重吸收等并发症较为常见,其它方法虽多,皆因代输尿管形态结构与功能、并发症发生率缺乏显著优势而应用较少[4]。裁剪去粘膜回肠代输尿管实验研究表明其优势明显[3,5]。但回肠裁剪、粘膜剥脱、尿液刺激和粘膜下层暴露等均可诱导肠壁炎症纤维化,代输尿管随时间延长是否纤维化存在诸多不确定性。需要延长模型犬饲养时间,动态监测其组织形态结构与功能变化,监测与组织纤维化密切相关的指标予以论证,方能评价其稳定性和长期效果。
本实验采用的回肠裁剪及粘膜剥脱法主要损伤位点在肠上皮细胞粘膜层与粘膜下层之间,而肠壁严重挫伤、慢性炎症性肠病、溃疡性结肠炎和肠结核常至肠壁纤维增生、僵硬、管腔狭窄和功能丧失,其因是激活了以TGF-β/Smad为主的组织炎症纤维化通路,形成大量肌成纤维细胞,分泌胶原致细胞外过度沉积、纤维增生疤痕形成[6-9]。Collagen III和Smad2在其中发挥了重要作用[10]。Collagen III是内皮细胞间质化为肌成纤维细胞细胞的主要产物之一,主要由肌成纤维细胞产生,当炎症和损伤发生时、在炎性肠病肠组织纤维化以及肝纤维中是主要增生纤维成分之一。Smad2是促进TGF-β1介导的组织纤维化的主要下游调控因子,与Smad3耦合磷酸化后TGF-β1介导的纤维化通路信号才能得以下传,而后促进组织纤维化[11]。因此Collagen III和 Smad2过度或强阳性表达标志着组织纤维化,检测其在对照与实验组中的表达差异可以论证炎症纤维化通路是否激活,是否存在纤维化。本实验组中裁剪去粘膜回肠输尿管1年期造影显示形态结构与功能较好,与术后短期间无明显差异,动力存在,排尿通畅;粘膜下层及肌层未见大量胶原沉积和管壁增厚;回肠代膀胱和回肠代输尿管术后未见肠壁纤维化报道,裁剪去粘膜回肠代输尿管实验中亦未见肠纤维化现象,回肠经历的这些损伤与刺激视乎不足以诱导或激活组织纤维化通路[12-13]。实验与对照组回肠壁组织细胞中Collagen III和Smad2在蛋白与分子水平的变化也无显著差异,且免疫组化结果显示Smad2实验组比对照组反而下降,其中机理目前尚不清楚,推测主要原因为回肠即使经历裁剪、粘膜剥脱、输尿管重建与尿液长期刺激,在缺乏细胞环境与微循环支撑的条件下不能激活TGF-β/Smad通路亦或是通路下传受阻,完整的粘膜下层发挥了阻滞炎症纤维化的重要作用,具体机制还有待于进一步研究。裁剪去粘膜回肠代输尿管短期与1年期出现相同形态结构与功能的基础是肠壁未发生纤维化、功能相对稳定。
原因可能与粘膜剥脱、粘膜下层完整有关。去粘膜虽然损伤肠壁,局部渗出增加,早期呈现炎症水肿和细胞浸润,但该层为细胞外基质,缺乏微循环和细胞条件支撑,致炎因素刺激不能启动细胞炎症纤维化连锁反应;粘膜下层完整阻断了炎细胞向深层浸润,防止了细胞性炎症反应;粘膜下层大量活性细胞因子及纤维蛋白溶解酶激活了纤溶过程,对抗了早期分泌增加的纤维,维持了组织增生与降解平衡[14]。
综上所述,裁剪去粘膜回肠代输尿管未因时间延长管壁形态结构和功能发生改变,Collagen III和Smad2未因肠壁结构改造和尿液刺激出现过度表达,说明其管壁不存在纤维化问题,有助于长期稳定。

