基于TLR2/MyD88/NF-κB信号通路探讨不可分型流感嗜血杆菌诱导支气管上皮细胞炎症的机制
周欣欣,张晓宇,周 辉,王小妹
(1.湖南中医药大学第一附属医院,湖南 长沙 410000; 2.湖南省第二人民医院 手足外科,湖南 长沙 410000)
不可分型流感嗜血杆菌(Nontypeable haemophilus influenzae,NTHi)为革兰阴性杆菌,无荚膜,常寄居于人类上呼吸道,是重要的机会致病菌,能引起肺炎等炎症反应[1]。研究表明[2],NTHi 在感染呼吸道过程中主要通过释放内毒素、以及蛋白水解酶等毒性产物,促进呼吸道粘膜炎症因子释放进而导致组织炎症反应。而过度的呼吸道炎症反应将进一步诱导慢性阻塞性肺疾病的发生[3],因此有效预防NTHi感染所致的炎症反应在临床COPD的防治应用中具有重要意义。
多种调控机制参与NTHi在感染呼吸道上皮细胞诱导炎症反应的过程。已有研究证实,NTHi感染肺泡上皮细胞株,能够激活p38 MAPK信号通路进而诱导炎症反应的发生[4]。此外,NTHi同样也可以通过ERK MAPK信号通路来上调肺泡上皮细胞株A549炎症因子IL-8的分泌[5]。尽管如此,但到目前为止我们仍不清楚NTHi具体的致炎机制。因此,本研究将以NF-κB信号通路为切入点,明确NTHi诱导人正常支气管上皮细胞BEAS-2B产生炎症因子的分子机制,进而为预防及治疗NTHi感染相关疾病提供理论依据。
1 材料与方法
1.1 实验材料 不可分型流感嗜血杆菌菌株(ATCC-49247)采购自美国ATCC公司;人正常支气管上皮细胞(BEAS-2B)采购于中科院细胞库;Human IL-1β、IL-6 ELISA检测试剂盒购自Invitrogen公司;TLR2干扰RNA购自InvivoGen公司;MyD88抑制剂NBP2-29328购自Sigma公司;NF-κB抑制剂(BAY11-7082)购自Santa Cruz生物技术有限公司;IκB、β-actin抗体采购于Cell Signaling Technology公司; PCR引物由上海生物工程有限公司合成。
1.2 细胞处理 将新配置的DMEM培养基(含10%胎牛血清)加入BEAS-2B细胞中,并将细胞至于37 ℃、5 % CO2的细胞培养箱中培养。待细胞生长至对数期时,重新处理细胞并放至6孔板中培养,进行如下处理:以MOI=1、5、10的NTHi感染细胞24 h,并收集细胞及细胞上清液于-20 ℃保存待用。
1.3 ELISA检测 按照IL-6、IL-1βELISA检测试剂盒说明书的要求,对上述处理后的细胞上清中细胞因子的水平进行检测。检测完成后,用酶标仪对各组细胞样本的OD值进行测定(450 nm),每种实验重复3次。采用试剂盒中标准品的检测结果绘制标准曲线,进而对各细胞上清液中IL-6、IL-1β的表达水平进行计算。
1.4 定量PCR检测 按照Trizol试剂盒说明书步骤,提取上述收集细胞的总RNA,进行纯化后将其逆转录为cDNA(参照逆转录试剂盒说明书),随后按照RT-PCR反应体系进行引物扩增。反应条件为:预变性95 ℃ 30 s;PCR反应95 ℃ 5 s,60 ℃ 30 s,共计40个循环。引物设计如下:IL-1βF:TGGCAATGAGGATGACTTGT;R: TGGTGGTCGGAG-ATTCGTA。IL-6 F:TACATCCTCGACGGCATCTC;R: TTTCAGCCATCTTTGGAAGG。TLR2 F:GCTCCTGCGAACTCCTATCC;R: CAAAGAGACTCCAGACACCAG。MyD88 F:CCGCCTGTCTCTGTTCTTG;R: GTCGCTTGTGTCTCCAGTT。扩增完毕后,使用2-△Ct法计算IL-1β、IL-6、以MyD88及TLR2 mRNA相对的表达量。
1.5 RNA干扰 RNA干扰实验采用非特异性特异性TLR2靶向siRNA(InvivoGen)和siRNA(siRNA control,NWG Biotech)。参照Nucleofector试剂盒说明书操作:取2 μg(约25 nmol/L)siRNA转染到106个BEAS-2B细胞中,培养48 h后,再继续用NTHi处理24 h,随后收集细胞及上清用于后续实验。
1.6 Western blot检测 收集处理后的细胞,在细胞中加入150 μL细胞裂解液,反复吹打均匀,1 500 rpm离心10 min后收集上清。随后取10 μL蛋白进行SDS-PAGE凝胶电泳,并于转膜仪中进行转膜。转膜完成后4℃封闭过夜,随后分别用稀释好的一抗和二抗进行孵育并进行ECL发光显影(显影仪中)。

2 结果
2.1 NTHi诱导BEAS-2B细胞分泌IL-1β和IL-6 为了明确NTHi对BEAS-2B细胞分泌促炎因子的影响,NTHi刺激后ELISA检测细胞上清炎症因子水平。结果显示用MOI=1、5、10的NTHi感染BEAS-2B细胞24h后,细胞上清中IL-1β和IL-6显著增高,且呈浓度依赖性(见图1)。

*:与MOI=0相比, P<0.05。图1 NTHi刺激BEAS-2B细胞分泌IL-1β以及IL-6
2.2 NTHi诱导BEAS-2B细胞表达IL-1β和IL-6 mRNA 进一步采用qRT-PCR对BEAS-2B细胞中IL-1β和IL-6 mRNA的转录水平进行检测。结果与ELISA检测结果一致,MOI=1、5、10的NTHi感染BEAS-2B细胞24 h时,随着NTHi浓度的增高,IL-1β和IL-6 mRNA的表达量显著增高(见图2)。
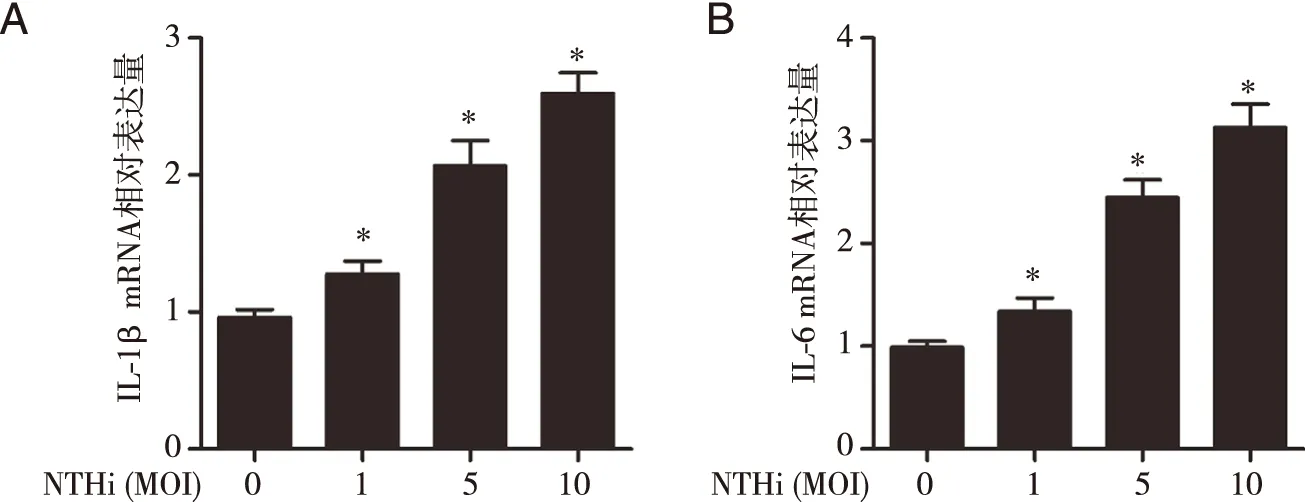
*:与MOI=0相比, P<0.05。图2 NTHi诱导BEAS-2B细胞IL-1β以及IL-6 mRNA表达
2.3 抑制NF-κB信号通路下调NTHi诱导IL-1β和IL-6分泌 Western blot结果显示,NTHi感染BEAS-2B细胞后,细胞内IκB的磷酸化水平(p-IκB)较未感染组显著上升(见图3A)。而进一步采用10μMNF-κB抑制剂BAY11-7082预处理后NTHi感染细胞,结果显示细胞内IL-1β和IL-6水平显著减少(见图3B)。

*:与MOI=0相比, P<0.05;#:与MOI=10,BAY11-7082(—)相比,P<0.05。图3 NTHi激活NF-κB信号通路诱导BEAS-2B细胞分泌IL-1β以及IL-6
2.4 NTHi感染BEAS-2B细胞激活TLR2以及MyD88 为了明确TLR2以及MyD88在NTHi诱导IL-1β和IL-6分泌中的作用。NTHi感染BEAS-2B细胞后,我们采用RT-PCR检测细胞内TLR2以及MyD88的活化情况。结果显示,NTHi刺激后细胞内TLR2以及MyD88的表达水平均要显著高于未感染对照组(见图4)。

*:与MOI=0相比, P<0.05。图4 NTHi感染BEAS-2B细胞活化TLR2以及MyD88
2.5 沉默TLR2/ MyD88下调IL-1β和IL-6分泌 进一步采用siRNA以及MyD88抑制剂处理细胞,并检测细胞上清IL-1β和IL-6的分泌水平。结果显示,siRNA沉默TLR2后,BEAS-2B细胞中IL-1β和IL-6分泌水平较未沉默的对照组显著降低(见图5)。此外,采用MyD88抑制剂处理后细胞中IL-1β和IL-6的分泌水平也显著降低(见图6)。
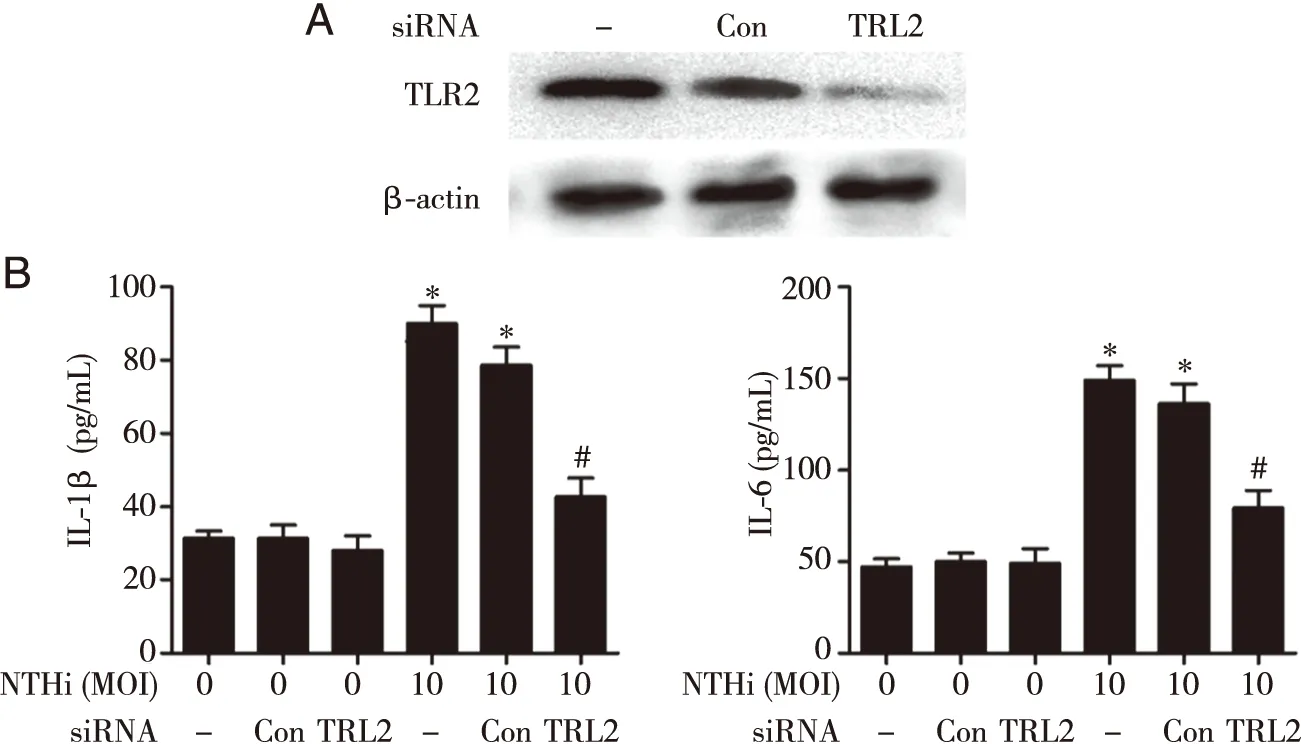
*:与MOI=0,siRNA(—)相比, P<0.05;#:与MOI=10,siRNA(—)相比, P<0.05。图5 抑制TLR2下调IL-1β和IL-6表达

*:与MOI=0,inhibitor(—)相比,P<0.05;#:与MOI=10,inhibitor(—)相比,P<0.05。图6 抑制MyD88下调IL-1β和IL-6表达
3 讨论
NTHi是常寄生于上呼吸道的条件致病菌,是引起COPD加重的主要因素[3]。目前体内外实验已经证实[6],NTHi可诱导呼吸道上皮细胞分泌IL-1β、IL-8、TNF-α、ICAM-1等多种促炎细胞因子以及趋化因子,进而介导NTHi感染后的炎症反应。然而到目前为止,关于NTHi诱导呼吸道炎症反应的具体分子机制仍未明了[7]。所以,探究NTHi的致炎机制对于开发设计相关的治疗药物至关重要。
炎症反应是NTHi致病的重要环节,NTHi感染呼吸道上皮细胞后分泌趋化因子以及炎症因子是导致呼吸道以及肺组织病理损伤的一个关键因素[8]。过度的炎症反应还可以导致细胞产生明显的毒性作用,进而诱发组织病理损伤。已有研究发现[9],NTHi或能够诱导呼吸道细胞分泌炎症因子IL-8。而本研究中,NTHi感染支气管上皮BEAS-2B细胞后,能够明显诱导炎症因子IL-1β和IL-6的分泌。由于IL-1β是机体调节炎症反应的重要介质,能促进其它促炎细胞因子的产生及分泌[8]。而IL-6是一种促炎细胞因子,则能够直接参与机体的炎症反应,与组织炎性损伤密切相关[10]。因此,我们的结论与之前的研究相符。
NF-κB是一种重要的转录调控因子,其能够将外界的刺激信号有效传导至细胞内,在免疫反应、炎症反应、细胞分化以及正常细胞和恶性细胞的存活中发挥重要作用[11]。此外,NF-κB活化后还可通过调节固有免疫应答参与机体组织的炎症反应。已有研究证实[12],NTHi可通过活化宿主细胞NF-κB信号通路,诱导产生IL-8。而本研究结果显示,NTHi感染BEAS-2B细胞后可明显诱导细胞内IκB的磷酸化水平,提示NF-κB信号通路被激活。而进一步采用NF-κB抑制剂BAY11-7082预处理细胞,细胞内IL-1β和IL-6的表达水平均显著降低,证实NF-κB也参与了NTHi诱导的IL-1β和IL-6分泌。
Toll样受体(Toll-like receptors,TLR)是一种非常重要的天然免疫(非特异性免疫)识别受体,它能够有效连接非特异性免疫和特异性免疫,参与多种细胞、组织、疾病的发生发展[13-16]。TLR2可以有效识别革兰阴性菌的脂多糖,通过活化细胞内的多条信号通路,进而诱导炎症反应的发生[17]。有研究表明[18-19],TLR2能够参与多种呼吸道病原体诱导的炎症反应,其中就包括衣原体,肺炎支原体等;在本次研究中,siRNA沉默TLR2后能够明显抑制 IL-1β和IL-6的产生,说明TLR2通路可能参与了NTHi对炎症反应的诱导作用。MyD88是TLRs信号通路中的一个关键接头分子,在传递上游信息和相关疾病的发生发展中具有重要的作用。课题组进一步采用MyD88抑制剂对细胞进行处理,发现NTHi诱导IL-1β和IL-6分泌也同样受到抑制。
综上所述,本研究证实NTHi能够诱导支气管上皮BEAS-2B细胞分泌IL-1β和IL-6,且该机制或与TLR2/ MyD88及NF-κB信号通路的活化相关联。但TLR2/ MyD88以及NF-κB信号通路活化后的作用机制目前尚未明了,有待进一步探讨。本研究为阐明NTHi的致炎机制及临床防治、治疗NTHi感染提供了实验基础。

