NaV1.5钠通道C末端IQ基序的重组质粒构建及蛋白制备
张峰慧,薛迎春,许兴荣,邵冬雪,张晨阳,刘岩,苏敬阳,胡慧媛,郝丽英
(中国医科大学药学院药物毒理学教研室,沈阳 110122)
NaV1.5是主要心肌钠通道,高表达于心房、心室肌细胞和浦肯野纤维。NaV1.5通道由28个外显子组成,其C末端包含243个氨基酸(1773-1940a.a.),近端部分由6个α螺旋(αⅠ~αⅥ)构成,αⅥ包含能与钙调蛋白(calmodulin,CAM)结合的IQ基序[1-5]。IQ基序是细胞内Ca2+调节NaV1.5的关键元件,是耦合EFhand结构域和CAM与Ca2+相互作用的分子开关[6]。钙离子作为细胞生长中的第二信使,参与多种生理过程,如钙稳态调节、心脏传导和基因表达等[7]。同时,编码基因SCN5A突变导致NaV1.5通道结构或功能异常,引起心肌细胞动作电位除极期间通道表达水平降低,进而引发多种心血管系统疾病,如长QT综合征(long QT syndrome,LQTS)、Brugada综合征和心房颤动等。有研究[8]显示,LQTS已被证明与IQ基序中Ser1904leu突变干扰通道失活并促进通道重新开放有关,Ala1924Thr突变导致BrS,但具体机制尚未阐明。本研究制备了NaV1.5钠通道C末端IQ基序的重组蛋白,为进一步探讨NaV1.5钠通道的分子调控机制及相关心血管疾病的研究提供了重要的物质基础。
1 材料与方法
1.1 材料
pGEX-6P-3/IQ重组质粒、TOP10穿刺菌、BL21化学感受态细菌委托武汉金开瑞生物工程有限公司合成;AxyPrep质粒DNA抽提试剂盒购自江苏康宁生命科学(吴江)有限公司;限制性内切酶BamHⅠ和XhoⅠ购自美国New England Biolabs公司;胰蛋白胨、酵母提取物均购自英国Oxoid公司;异丙基硫代-β-D-半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、氨苄西林、溶菌酶、N-lauroylsarcosine、二硫苏糖醇(DL-dithiothreitol,DTT)购自美国Sigma公司;Precission Protease、Glutathione-Sepharos 4B 购自美国GE Healthcare公司;其他试剂均购自中国Biosharp公司。
1.2 重组质粒的提取
将武汉金开瑞生物工程有限公司提供的表达有pGEX-6P-3/IQ重组质粒的TOP10菌种(20 μL)置于20 mL含0.14 mmol/L氨苄西林的LB液体培养基中,37 ℃、120 r/min摇床振摇培养12 h。当其吸光度值(λ=600)在0.8~0.9时,于12 000g离心1 min,收集菌液。按照AxyPrep质粒DNA小量抽提试剂盒说明书抽提质粒,测定质粒DNA浓度。
1.3 重组质粒的鉴定
1.3.1 酶切鉴定:重组质粒有BamHⅠ和XhoⅠ2个限制性酶切位点,故采用双酶切法处理纯化后的重组质粒DNA。根据限制酶使用说明书,取4 μg质粒DNA加入到50 μL酶切体系中,单酶切组加入4 μL的BamHⅠ限制酶,双酶切组分别加入4 μL的BamHⅠ和XhoⅠ限制酶,用灭菌ddH2O补足体积。单酶切条件为37 ℃,10 min,双酶切条件为初始37 ℃,10 min,后65 ℃,20 min。酶切处理后的质粒DNA样品进行琼脂糖电泳鉴定。
1.3.2 测序鉴定:取4 μg经上述方法提取的质粒DNA送至武汉金开瑞生物工程有限公司进行测序,测序结果经PubMed网站的BLAST软件比对同源性。
1.4 IQ基序与CSL蛋白结合的预测
利用I-TASSER同源建模服务器对NaV1.5钠通道C末端IQ基序和钙蛋白酶抑素N末端结构域(CSL蛋白)进行同源建模,加州大学蛋白质结构在线检测服务器对建模结果进行评估,利用分子模拟及药物设计综合软件(molecular operating environment,MOE)软件对IQ基序和CSL蛋白进行去氧加氢等预处理,使用DOCK分子对接程序模拟IQ基序与CSL蛋白结合,对结合模型进行评分。
1.5 重组蛋白的表达
根据课题组前期对CaV1.2不同蛋白片段提取方法的总结,本研究采用超声破碎法提取IQ蛋白[9]。取60 μL转化有IQ基序重组质粒并扩增后的BL21菌液,加入到400 mL含有氨苄西林的LB液体培养基中,37 ℃、85 r/min振摇培养12~16 h,待测定菌液吸光度至0.6~1.0时,加入400 μL 的1 mmol/L IPTG于37℃、120 r/min摇床振摇4 h,诱导重组蛋白表达。离心收集细菌,加入200 μL 1 mol/L溶菌酶、200 μL 1 mol/L DTT、2 mL 15% N-lauroylsarcosine,冰上处理30 min,超声粉碎细菌,加入667 μL 30% TritonX-100,冰上处理30 min,收集上清,分装备用。
1.6 重组蛋白的纯化、鉴定与活性检测
将蛋白上清液与GS-4B beads 于旋转培养仪4 ℃孵育过夜,800 r/min离心3 min 后弃上清,Tris Buffer洗涤3次后,收集蛋白。用上述同样方法提取纯化CSL蛋白[15],CSL蛋白与GS-4B beads孵育后用5 μL Precission蛋白酶切去GST标签。用Bradford试剂盒测定蛋白浓度。
采用pull down方法检测GST-IQ蛋白与CSL蛋白的结合活性。取40 μL连接有GST-IQ蛋白GS-4B beads置于2 mL EP管中,分别加入3 μL 1 mmol/L的CaCl2(Ca2+终浓度为10 μmol/L)溶液和不同浓度的CSL蛋白,使其终浓度分别为0、0.1、0.3、1、3、5、10、30 mmol/L,用Tris Buffer(pH 8.0)补充至总体系300 μL,旋转培养仪4 ℃孵育4 h。将经15% SDA-PAFE电泳分离后的蛋白凝胶进行考马斯亮蓝染色,脱色后扫描凝胶图片。
1.7 统计学分析
采用CS Analyzer软件对电泳条带进行灰度值数字化,Prism软件进行统计分析。采用t检验进行差异比较,P< 0.05为差异有统计学意义。
2 结果
2.1 NaV1.5钠通道IQ基序重组质粒的酶切鉴定
将预先设计好的人源IQ基序(135 bp)于 pGEX-6P-3质粒载体(4 983 bp)的BamHⅠ/XhoⅠ处插入,其中,BamHⅠ酶切位点位于质粒载体的945 bp处,XhoⅠ酶切位点位于质粒载体的968 bp处,故重组质粒全长5 095 bp,经BamHⅠ/XhoⅠ双酶切后产生2个基因片段,分别是IQ基序片段135 bp和载体片段4 960 bp。琼脂糖凝胶电泳的3条泳道内分别为完整的IQ重组质粒,经BamHⅠ单酶切和经BamHⅠ/XhoⅠ双酶切后的质粒片段,结果显示,双酶切组4 960 bp和135 bp处出现明显条带,其分子量与计算所得理论值相符,见图1。

图1 重组IQ质粒酶切鉴定琼脂糖凝胶电泳图Fig.1 Validation of recombinant IQ plasmid construction by agarose gel electrophoresis of restriction enzyme digests
2.2 重组质粒测序结果(图2)
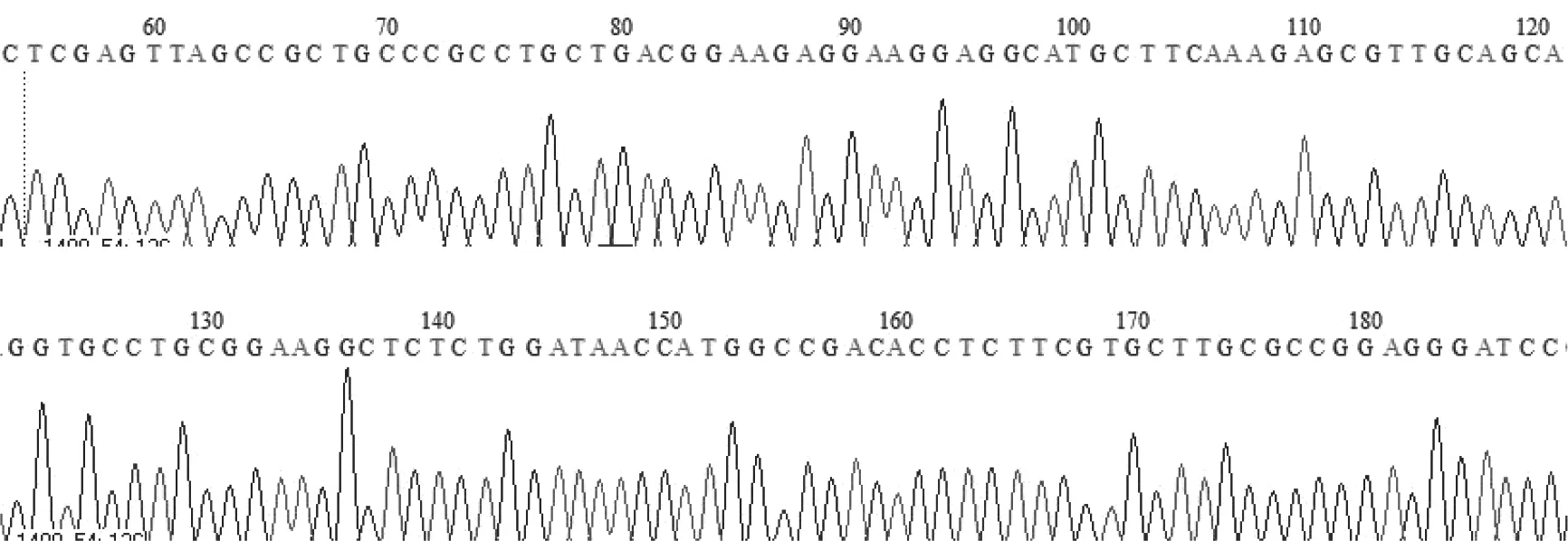
图2 重组质粒测序结果Fig.2 Verification of recombinant plasmid by DNA sequencing
经PubMed网站的BLAST程序比对,重组质粒与人类基因同源性为100 %,插入方向正确,读码方向正确,无移码突变,进一步证明本研究重组质粒构建成功。
2.3 分子对接结果分析
采用MOE分子对接程序模拟IQ基序与CSL蛋白结合,结果显示,2种蛋白分子对接评分为47.67,E值为12.63 Kcal/mol。IQ基序与CSL蛋白有2个结合位点,分别是IQ基序的Arg1910与CSL蛋白模型的Glu14结合、IQ基序的Arg1913与CSL蛋白模型的His13结合。Arg1910、Arg1913与CSL蛋白之间的非键作用力是氢键,结合能分别是-1.0、-1.0 kcal/mol。由此可见,CSL蛋白可以与NaV1.5钠通道C末端IQ基序结合,见表1。

表1 IQ基序与CSL蛋白的分子对接结果Tab.1 Results of docking of CSL with the IQ motif
2.4 GST-IQ融合蛋白纯度和活性鉴定
经SMS在线DNA和蛋白序列处理工具预测得的GST-IQ融合蛋白的表观分子量为30 000。以GST蛋白作为对照,GST-IQ融合蛋白在30 000左右处可见特异性条带,且杂带较少,表明提取纯化后获得纯度较高的IQ蛋白,与预期结果一致,见图3。
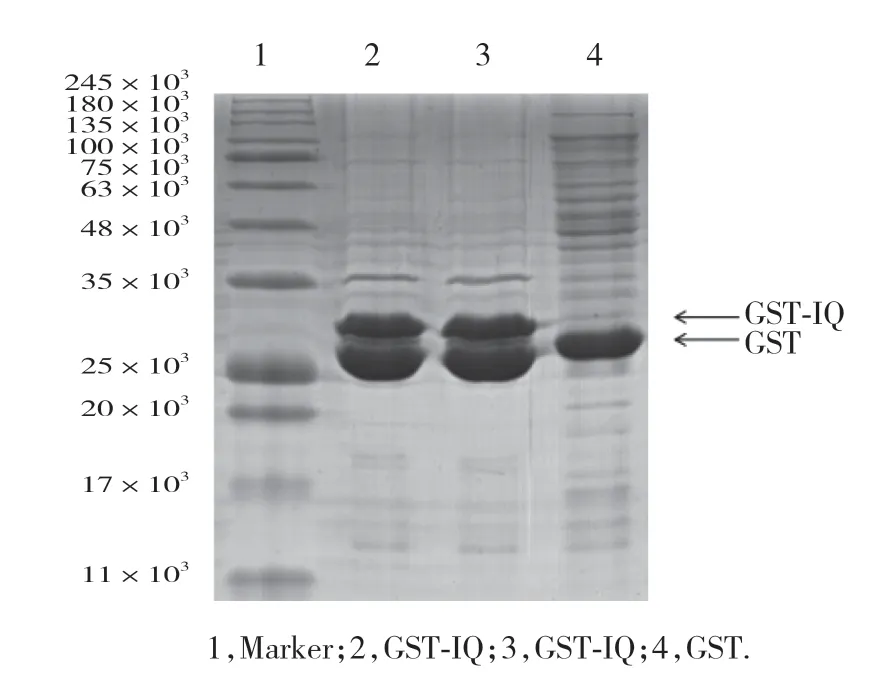
图3 纯化后IQ蛋白的SDS-PAGE电泳图Fig.3 SDS-PAGE of purified IQ protein
为了考察经超声破碎法提取的GST-IQ蛋白的生物学活性,并验证MOE预测结果,将纯化后的GST-IQ蛋白与不同浓度的CSL蛋白在1 mmol/L Ca2+条件下共同孵育,经pull down实验检测发现,GST-IQ蛋白能够与CSL蛋白结合,且随着CSL蛋白浓度的增加,两者的结合量也呈递增趋势(图4),提示经本研究方法提取纯化的GST-IQ蛋白具有较好的生物学活性,适合后续NaV1.5钠通道的相关研究中。
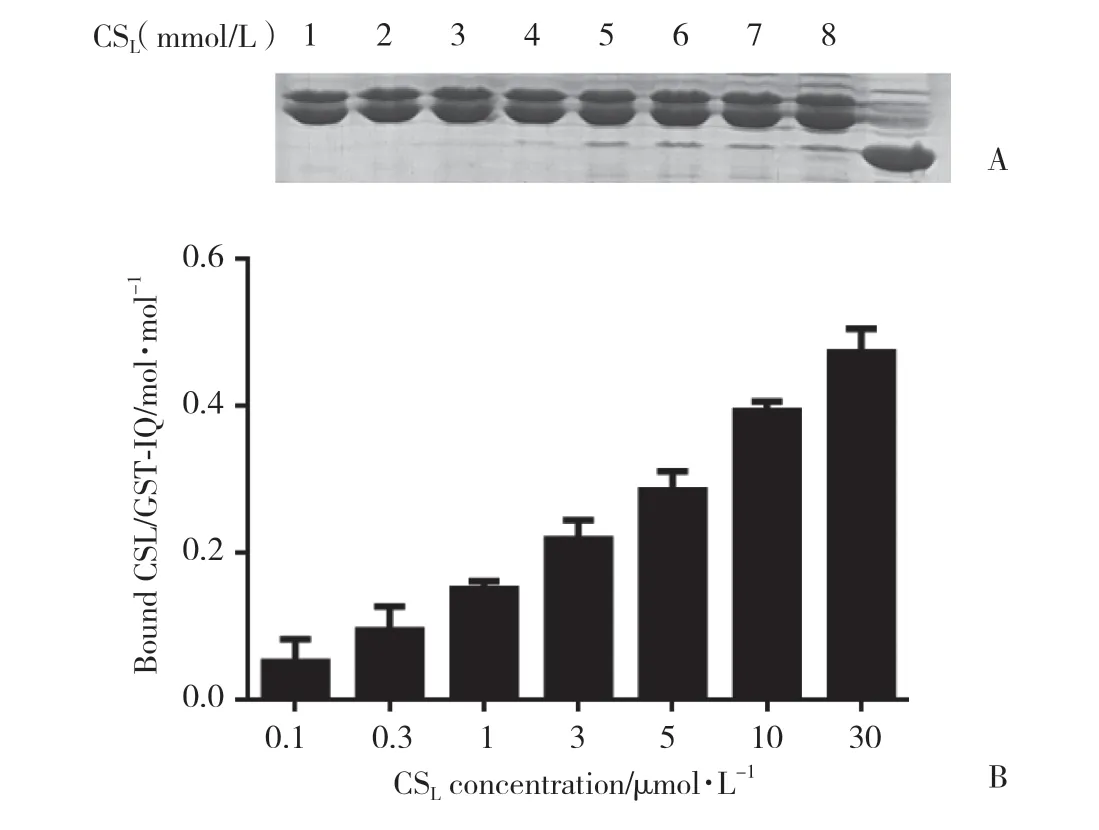
图4 IQ蛋白和CSL蛋白的pull down分析结果Fig.4 Pull down assay to assess binding of IQ protein to CSL protein
3 讨论
在哺乳动物中,电压门控钠通道可以快速开放和关闭,产生的动作电位在快速电信号传导中起重要作用[10]。有研究[4]表明,存在于心肌细胞的蛋白可作用于NaV1.5的不同结构域而参与NaV1.5的生物合成、运输、活性调节,如CAM等。其中,CAM可以在无Ca2+(apo)或Ca2+饱和条件下与NaV1.5的IQ基序结合,使钠通道缓慢失活曲线右移,进而引起动作电位时程延长[11]。
IQ基序广泛分布于肌球蛋白和非肌球蛋白中,包括神经元生长蛋白、电压门控通道、磷酸酶等,其生物功能广泛,如参与神经元生长、有丝分裂、电压门控通道的信号传导等[12]。而位于心肌NaV1.5钠通道C末端的IQ基序,不仅参与许多蛋白的Ca2+依赖性调节,还可能包含一些心脏疾病的突变位点。已知IQ基序在所有钠通道亚型中是高度保守的,而在CaV1.2中,C末端的IQ基序R1902C突变与家族性自闭症有关,这种突变被证明可以诱导Ca2+稳态失活时的左移,同时影响IQ基序的构象。NaV1.5是一些遗传性心律失常相关疾病的突变位点,在IQ基序中已经发现了与LQTS3有关的4个突变位点,分别是E1901Q、S1904L、Q1909R和R1913H[13]。
IQ基序具有广泛的生理功能,但目前对于IQ基序与各种心脏疾病致病机制之间关系的研究尚不完善。本研究成功构建了IQ基序的重组质粒,该质粒能够在大肠杆菌BL21中表达高浓度蛋白,经GS-4B beads纯化后,具有较好的纯度和生物学活性。IQ基序是CaM发挥钙依赖性失活和钙依赖性激活功能的主要结合区域,而CSL同CaM竞争结合于CaV1.2的C末端的IQ区域,进而达到调控通道活性的目的。基于IQ基序在CaV和NaV通道亚型中高度保守,通过成功构建NaV1.5钠通道的GST-IQ重组蛋白,并经pull down 实验检测纯化后的GST-IQ蛋白是否具有生物学活性,同时检测该结合作用的CSL蛋白浓度依赖性,结果表明,本研究成功制备出具有生物学活性的重组IQ蛋白,为心肌NaV1.5钠通道的相关调节机制奠定了分子基础,也为后续钠离子通道病的研究和相关药物研发提供了新方向。
——一道江苏高考题的奥秘解读和拓展

