前列腺癌组织中雄激素受体剪接变异体7的表达及临床意义
王艳龙,张洪麟,杜浩,任宇,于广海,刘志宇
(大连医科大学1.附属大连市中心医院泌尿外科,辽宁 大连 116033;2.附属大连妇产医院生殖健康中心,辽宁 大连 116033;3.附属第二医院泌尿外科,辽宁 大连 116023)
前列腺癌是男性泌尿生殖系统常见的恶性肿瘤之一,晚期前列腺癌患者主要治疗方法是雄激素剥夺治疗(androgen deprivation therapy,ADT)。ADT治疗后多数患者会产生耐药并发展为转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)[1]。mCRPC是临床治疗的难点和患者死亡的主要原因。雄激素受体剪接变异体(androgen receptor splice variants,AR-Vs)在前列腺癌的治疗耐药和进展中起着重要作用。其中雄激素受体剪接变异体7(androgen receptor splicing variant 7,AR-V7)通过激活雄激素受体信号通路、促进下游旁分泌等多种机制来促进前列腺癌的进展[2]。目前,AR-V7是公认的指导mCRPC患者选择化疗或者新型内分泌治疗的标志物[3],此外,AR-V7对治疗结果的预测能力因不同的检测方法而不同。本研究检测不同分期前列腺癌中AR-V7的表达,同时与良性前列腺增生组织进行比较,探讨AR-V7在前列腺癌临床进展和骨转移中的临床意义。
1 材料与方法
1.1 标本来源及分组
收集2017年3月至2019年3月大连医科大学附属大连市中心医院泌尿外科48例患者组织标本。其中前列腺增生患者(经尿道前列腺电切术后病理确诊)18例(良性增生组),无转移局限性前列腺癌患者(CT/MRI/ECT骨扫描未见远处转移,根治术后病理确诊)18例(局限癌组),骨转移前列腺癌患者(CT/MRI/ECT见远处骨寡转移或内脏少量转移,根治术后病理确诊)12例(骨转移癌组)。收集MRI报告前列腺癌病灶的最大径线值。局限癌组前列腺肿瘤大小为(1.42±0.06)cm,肿瘤分期T1期3例、T2期6例、T3期6例、T4期3例。骨转移癌组前列腺肿瘤大小为(2.12±0.14)cm,肿瘤分期T2期2例、T3期5例、T4期5例。纳入标准:患者未接受任何抗雄或去势等内分泌治疗;未接受放射治疗或化疗。标本组织离体取出清洗后标记,尽快放入液氮转运至-80 ℃冰箱保存。本研究经大连市中心医院伦理委员会审批通过(2017-010-11)。
1.2 方法
1.2.1 免疫组化及阳性结果评定:组织切片经过脱蜡、水化、抗原修复、血清封闭,室温下孵育一抗AR-V7(英国Abcam公司,1 ∶200)60 min,用已证实ARV7表达阳性的前列腺癌组织切片作阳性对照,加入PBS作阴性对照,然后孵育二抗15 min,经DAB显色,苏木素复染、脱水封片后显微镜下观察。高倍镜下对每张切片随机取5个视野,根据染色阳性细胞比例和阳性程度进行评分。A,按照阳性细胞占总上皮细胞比例评分:0%,0分;>0%~25%,1分;>25%~50%,2分;>50%~75%,3分;>75%,4分。B,按照染色的阳性程度评分:不着色、少许浅黄色,0分;浅黄色,1分;棕黄色或棕色,2分;深棕色、棕褐色,3分。A与B分数之和来判断切片染色的阳性等级:0分,阴性(-);1~3分,弱阳性(+);4~5分,阳性(++);6~7分,强阳性(+++)。
1.2.2 实时荧光定量PCR(real time quantitative PCR,qRT-PCR)检测AR-V7mRNA表达:将组织样品加入预冷的 TRIzol(日本TaKaRa公司)中,充分裂解细胞,提取总RNA,应用反转录试剂盒逆转录cDNA。使用实时定量荧光PCR仪(美国ABI公司),TransStart®Green qPCR Supermix 试剂盒进行检测。生工生物工程有限公司合成引物,AR-V7上游引物5’-GGAAATGTTATGAAGCAGGG-3’,下游引物5’-GGTCATTTTGAGATGCTTGC-3’。GAPDH上游引物5’-GGAGCGAGATCCCTCCAAAAT-3’,下游引物5’-GGCTGTTGTCATACTTCTCATGG-3’。
1.3 统计学分析
采用SPSS 26.0软件进行统计分析,计量资料采用表示,组间比较采用t检验,计数资料用率(%)表示,组间比较采用χ2检验,P< 0.05为差异有统计学意义。
2 结果
2.1 3组免疫组化检测结果
结果显示,良性增生组1例弱阳性,17例阴性,阳性表达率5.6%;局限癌组2例阳性,1例强阳性,15例阴性,阳性表达率16.7%,骨转移癌组3例阳性,4例强阳性,5例阴性,阳性表达率58.3%,3组比较差异有统计学意义(χ2=11.99,P=0.002),见表1、图1。
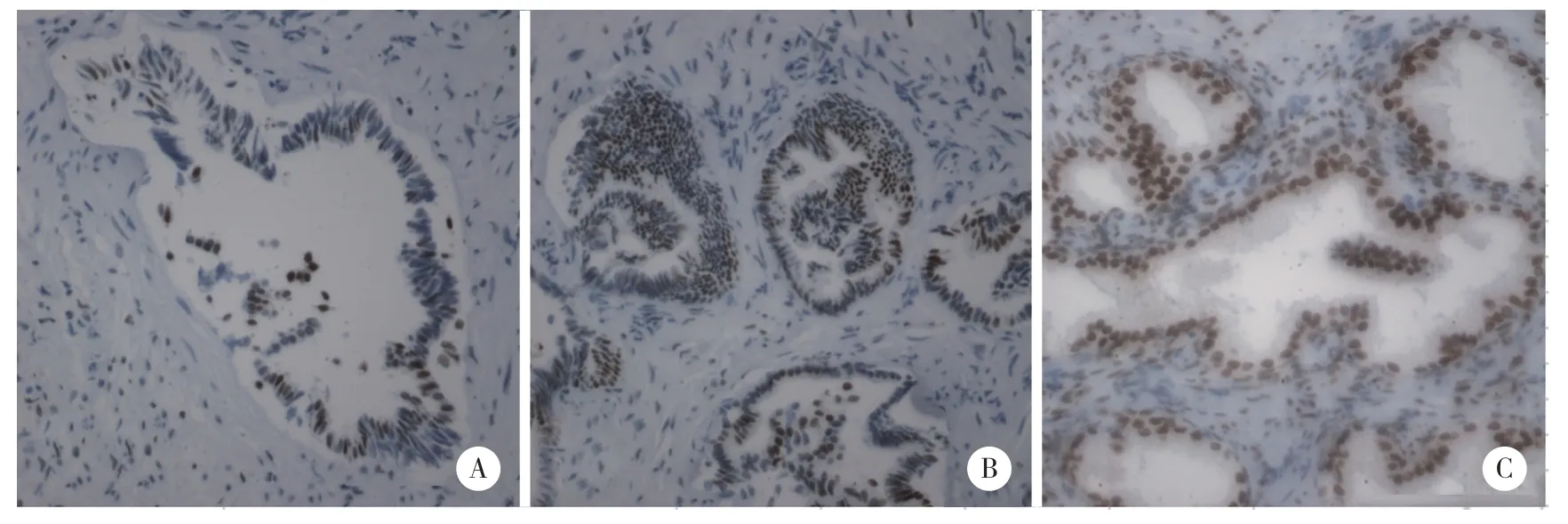
图1 3组免疫组化结果比较 ×400Fig.1 Comparison of immunohistochemical results for the three groups ×400

表1 3组免疫组化结果比较[n(%)]Tab.1 Immunohistochemistry results among the three groups[n(%)]
2.2 3组AR-V7 mRNA检测结果比较
qRT-PCR结果显示,良性增生组、局限癌组和骨转移癌组AR-V7mRNA 表达分别为1.03±0.11、6.36±0.15和14.39±0.13。与良性增生组比较,局限癌组AR-V7mRNA 表达显著增高(P< 0.05);与良性增生组、局限癌组比较,骨转移癌组AR-V7mRNA 表达显著增高(P< 0.05),说明AR-V7mRNA表达随肿瘤临床进展而升高。
3 讨论
前列腺癌是激素依赖性肿瘤,雄激素促进前列腺癌的生长和进展,雄激素受体是常用的前列腺癌的治疗靶点。然而,靶向药物最终会导致雄激素受体畸变,促进前列腺癌进展和耐药,导致mCRPC。研究[4]显示,10%~30% mCRPC患者循环肿瘤细胞(circulating tumor cells,CTCs)AR-V7阳性表达,这类患者使用新型雄激素受体抑制剂(阿比特龙或恩杂鲁胺)效果不佳,但对化疗敏感[5]。目前AR-V7的检测方法多样,qRT-PCR是目前最常用的方法,但技术路线复杂[6]。AR-V7mRNA的检测结果因不同检测标本存在差异[7],而组织标本检测具有结果可靠、灵敏度较高、技术简单等优点,是目前常用的检测方法。
研究[8]表明AR-V7 也存在于正常细胞(癌旁组织或良性腺体)中,本研究发现前列腺良性增生组中1例AR-V7弱阳性(5.6%),与以往研究结果一致。SCHER等[9]分析显示,CTCs细胞核中含有AR-V7蛋白的患者,在基于紫杉醇类化疗中有更长的生存时间。ERB等[10]采用免疫组化检测AR-V7对无进展生存期和治疗反应的预测价值,认为AR-V7蛋白在CTCs中的表达不能预测mCRPC的治疗反应,AR-V7在CTCs中作为生物标志物的价值临床上仍然需要进一步验证。
本研究采用组织标本进行AR-V7检测,结果显示AR-V7mRNA 表达在骨转移癌组最高,局限癌组次之,良性增生组最低。与良性增生组比较,局限癌组AR-V7mRNA 表达显著增高(P< 0.05);与良性增生组、局限癌组比较,骨转移癌组AR-V7mRNA 表达显著增高(P< 0.05),提示 AR-V7 的表达可能与前列腺癌的临床进展相关。OUYANG等[11]研究认为前列腺癌组织中AR-V7水平与根治性前列腺切除术后接受辅助激素治疗患者的无进展生存期、总生存期和癌症特殊生存期的不利预后相关,与本研究结果一致。
综上所述,前列腺癌组织中AR-V7表达增高,且与前列腺癌的临床进展相关,提示AR-V7可能参与前列腺癌的临床进展和骨转移的发生。但是,AR-V7如何促进mCRPC形成以及AR-V7如何参与新型雄激素受体抑制剂耐药机制尚不清楚,需进一步研究论证。

