沙棘对心血管系统和中枢神经系统的影响
张谦,李君,胡玉霞,张微,张百超,孙海鹏,君梅,常福厚,3*(1.内蒙古医科大学新药安全评价研究中心,呼和浩特 010110;2.内蒙古自治区新药筛选工程研究中心,呼和浩特 010110;3.内蒙古医科大学药学院,呼和浩特 010110;.内蒙古医科大学第一临床医学院,呼和浩特 010110)
沙棘是一种落叶灌木,其特性是耐旱、抗风沙,可以在盐碱化土地上生存,因此被广泛用于水土保持,中国西北部大量种植沙棘,用于沙漠绿化。沙棘果实中维生素C 含量很高,素有维生素C 之王的美称[1]。沙棘是植物和其果实的统称。我国是沙棘资源利用最早的国家,早在元朝就被列为宫廷保健品,1977年沙棘被正式列入《中国药典》,20世纪80年代,被原国家卫生部列为我国第一批药食两用植物品种。
沙棘,具有止咳去痰、活血化瘀之功效,在民间一直作为药食两用的植物,现代药理研究证实,沙棘中含有的总黄酮对心血管系统有保护作用,能调节免疫系统;5-羟色胺可以预防癌症;各种有机酸和卵磷脂可以保护肝脏[2-6]。同时沙棘果油开发的具有保健作用的食品如沙棘果油软胶囊等在市场上均有销售,然而目前对沙棘的毒性研究主要集中于对沙棘急性毒性、长期毒性和遗传毒性的研究。尚未有研究数据来综合评价沙棘对于心血管系统和中枢神经系统的毒性。
本项目通过清醒比格犬灌胃沙棘考察其对心血管系统的影响,通过大小鼠自主活动实验、运动协调实验和戊巴比妥钠阈下催眠实验,考察沙棘对中枢神经系统的影响。
1 材料
1.1 试药
沙棘(东营百佳益中药饮片有限公司,批号:20180301);羧甲基纤维素钠(CMC-Na)(天津市光复精细化工研究所,批号:20170810);布洛芬缓释胶囊(中美天津史克制药有限公司,批号:20171208);碘伏(文水大有实业有限公司,批号:20170315);生理盐水(山东华鲁制药有限公司,批号:D16070503)。
1.2 仪器
植入式生理信号遥测系统(美国Data Sciences International 公司),含D70-PCTR 植入子、接收器、数据交换单元、数据采集单元和数据分析软件等;动物麻醉机(美国Matrx 公司);YLS-1C 小动物活动记录仪、YLS-31A 大小鼠转棒测试仪、YLS-27A 大小鼠尾部自动标号仪(济南益延科技发展有限公司);DS-Y350 型粉碎机(上海市顶帅工贸有限公司);CIC1P1-150FE-L电子秤、BSA4202S 分析天平(赛多利斯科学仪器有限公司);注射器(苏州伟康医疗器械有限公司,批号:170305);胃管(太平洋医材股份有限公司,批号:15025519)。
1.3 实验动物
普通级比格犬,5~6月龄,雄性3 只,雌性3 只[北京玛斯生物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0001]。动物初次给药体质量10.45~13.85 kg。比格犬饲养于内蒙古医科大学新药安全评价研究中心普通设施,实验动物使用许可证号:SYXK(蒙)2019-0001。环境控制(温度18~26℃,日温差≤3℃,湿度40%~70%,12 h/12 h 明暗交替)。单笼饲养,每笼1 只;犬维持饲料(北京科奥协力饲料有限公司),定时定量投饲(在动物实验前禁食过夜),自由摄取,自由饮水。
SPF 级ICR 小鼠80 只,雌雄各半,5~6 周龄,体质量18~22 g;SPF 级SD 大鼠40 只,雌雄各半,5~6 周龄,体质量170~250 g[北京维通利华实验动物有限公司,实验动物生产许可证号:SCXK(京)2012-0001]。大、小鼠饲养于内蒙古医科大学新药安全评价研究中心屏障设施,实验动物使用许可证号:SYXK(蒙)2019-0001。环境控制(温度20~26℃,日温差≤3℃,相对湿度41%~64%,12 h/12 h 明暗交替);饲养密度:每笼5 只,60Co 放射灭菌鼠全价颗粒饲料购于北京科奥协力饲料有限公司,定时定量投饲(在动物实验前禁食过夜),自由摄取,自由饮水。
2 方法
2.1 手术及护理
参照DSI D70-PCTR 手术指南方法进行植入手术,术前用异氟烷麻醉实验动物,术中维持,麻醉后对实验动物进行充分备皮,主要包括整个胸腹部和腹外侧及前肢内侧,备皮面积要大于手术区域;植入过程主要包括植入子主体植入、压力导管的植入及电极的植入。植入子主体放于实验动物腹部左侧;心电电极采用模拟标准Ⅱ导联放置,实验动物胸右侧2~3 肋间隙与锁骨中线相交处为电极负极,胸左侧12~13 肋骨体与腋中线相交处为电极正极;呼吸电极植入结束后应对基线阻抗进行确认,确保呼吸波幅在(60±10)ohms 内;压力导管插入腹股沟腹主动脉,为防止压力导管因犬活动拉扯滑出,压力导管植入后应预留O 型回路并用非吸收线缝合固定。手术植入及缝合结束后进入护理周期,术后给予布洛芬缓释胶囊3 d,每日1 次,每次1 粒,每日使用碘伏对伤口消毒1 次,连续7 d,恢复期3~4 周,待全部动物恢复后开始给药。
2.2 供试品的配制
2.2.1 溶媒对照品配制 取CMC-Na 10 g,多次少量地将其加入至蒸馏水中,边加边用玻璃棒搅拌使其完全溶解,最后定容至2000 mL,即得0.5% CMC-Na 溶液,放置7 d 以后,备用。
2.2.2 供试品配制 称取适量供试品于配药瓶中,加入终体积约70%的0.5% CMC-Na,用玻璃棒搅拌溶解后定量至终体积,再用KH-500DV 型数控超声波清洗器100 Hz 振荡约10 min,备用。
2.3 数据采集
2.3.1 比格犬心电、血压、体温指标测定 6 只比格犬采用拉丁方进行实验组别设计,分为4 组,每组雌雄各3 只,设溶媒对照组(0.5% CMCNa),沙棘混悬液低、中、高剂量组(0.08、0.24、0.72 g·kg-1),给药体积 10 mL·kg-1,设4 个给药周期,各给药周期间隔7 d。实验前设定需要采集的相关参数,采用植入式生理信号遥测系统采集动物心电指标、血压指标及体温数据,心电指标包括心率、PR 间期、QRS 间期、QT 间期、P 波、R 波、ST 段、T 波;血压指标包括收缩压、舒张压、平均压,同时采集体温数据。记录给药前1~2 h 基础数据及给药后24 h 数据。采集间隔为每10 s 系统自动记录一次。统计时选取给药前0.5 h 的时间点为给药前基础值,在给药后0.5、1、2、3、4、6、8、10、12、14、18、24 h 取每个时间点后5 min 平均值作为该时间点数据,剔除因动物躁动等因素引起的大幅度漂移数据。
2.3.2 小鼠自主活动实验 选用5~6 周龄SPF级ICR 小鼠40 只,雌雄各半,随机分为4 组,溶媒对照组(0.5% CMC-Na),沙棘混悬液低、中、高剂量组(0.4、1.2、3.6 g·kg-1),每组10只,各组分别经口单次灌胃给药,给药体积10 mL·kg-1。于给药前0.5 h 及给药后0.5、1、2、3、4、6、8 h 将小鼠放入记录仪的活动箱中,测定小鼠活动情况,记录10 min 内小鼠的自主活动次数。
2.3.3 小鼠戊巴比妥钠阈下剂量催眠实验 选用5~6 周龄SPF 级ICR 小鼠40 只,雌雄各半,随机分为4 组,溶媒对照组(0.5% CMCNa),沙棘混悬液低、中、高剂量组(0.4、1.2、3.6 g·kg-1),每组10 只。各组分别经口单次灌胃给药,给药体积10 mg·kg-1。于给药后6 h 腹腔注射30 mg·kg-1的戊巴比妥钠,注射体积均为10 mL·kg-1,即刻开始观察注射戊巴比妥钠后30 min 内每组翻正反射消失达1 min 以上的动物数,凡30 min 内动物翻正反射消失达1 min 以上者,表明发生了睡眠,翻正反射恢复即为动物觉醒,翻正反射消失至恢复这段时间为动物睡眠时间。记录每组发生睡眠的小鼠数和入睡潜伏期、睡眠时间。
2.3.4 大鼠协调运动实验 检疫结束后选取合格的SD 大鼠置于转棒仪滚筒上进行训练,转速为12 r·min-1。训练结束后,选取能在转棒仪滚筒上维持3 min 以上不掉落的大鼠40只,雌雄各半,分为4 组,溶媒对照组(0.5% CMC-Na),沙棘混悬液低、中、高剂量组(0.27、0.81、2.43 g·kg-1),每组10 只。分别经口灌胃给予相应供试品,给药体积10 mg·kg-1。于给药后0.5、1、2、3、4、6、8 h 将大鼠放在转棒仪滚筒上,记录每只大鼠从转棒仪滚筒上掉落所用时间,若10 min 以上不掉落则以10 min 计。
2.4 数据处理与分析
数据采用SPSS 20.0 软件进行统计分析,用均数±标准差(±s)表示,经正态性和方差齐性检验后,采用单因素ANOVA 或秩和检验进行分析,组间比较采用Bonferroni 法进行。P<0.05认为差异有统计学意义。
3 结果
3.1 沙棘混悬液对清醒比格犬心血管系统的影响
比格犬灌胃给予沙棘混悬液后,对各组动物进行心电图检测,结果显示动物心电各项指标都在正常值范围内。与溶媒对照组同一采集时间点的数值相比,沙棘混悬液各剂量组比格犬的心率、PR 间 期、QRS 间期、QT 间期、P 波、T 波、R 波及ST 段,均未出现明显改变(P>0.05)。
3.2 沙棘混悬液对清醒比格犬血压的影响
比格犬灌胃给予沙棘混悬液后,对各组动物血压进行检测,结果显示动物收缩压、舒张压及平均压均处于正常范围,且在测量周期内血压各项指标基本维持在相当水平,没有较大波动,与溶媒对照组同一采集时间点的数值相比,沙棘混悬液各剂量组比格犬的收缩压、舒张压及平均压均未出现明显改变(P>0.05)。
3.3 沙棘混悬液对清醒比格犬体温的影响
比格犬灌胃给予沙棘混悬液后,对各组动物体温进行检测,结果显示动物体温均处于正常范围,与溶媒对照组同一采集时间点的数值相比,沙棘混悬液各剂量组比格犬体温未出现明显改变(P>0.05)。比格犬在夜间的体温值相对来说高于白天,与灌胃与否无关。
3.4 沙棘混悬液对小鼠自主活动的影响
ICR 小鼠灌胃给予沙棘混悬液后,测定小鼠活动情况,记录10 min 内的自主活动次数,与溶媒对照组同一采集时间点的数值相比,沙棘混悬液各剂量组的小鼠自主活动次数未出现明显改变(P>0.05),且从实验开始到结束,溶媒对照组和沙棘混悬液各剂量组的活动次数都呈现下降趋势,结果如图1所示。
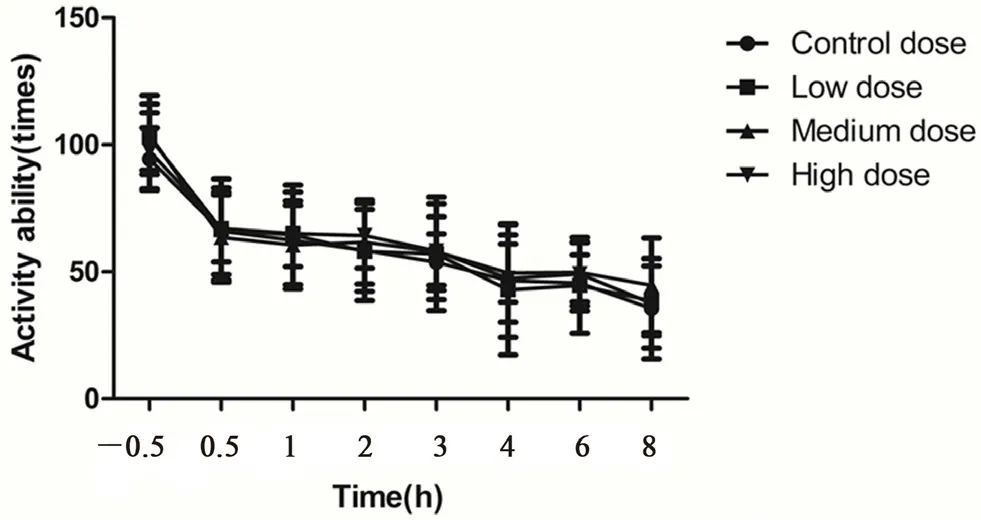
图1 沙棘混悬液对ICR 小鼠自主活动的影响(n=10,±s)Fig 1 Effect of sea buckthorn suspension on the spontaneous activity of ICR mice(n=10,±s)
3.5 沙棘混悬液对小鼠戊巴比妥钠阈下剂量催眠的影响
ICR 小鼠灌胃给予沙棘混悬液后,溶媒对照组、沙棘混悬液各剂量组的小鼠睡眠潜伏期均小于10 min,睡眠时间均大于20 min,与溶媒对照组相比,沙棘混悬液各剂量组的小鼠睡眠潜伏期及睡眠时间均无明显改变(P>0.05),结果如图2所示。

图2 沙棘混悬液对ICR 小鼠睡眠潜伏期及睡眠时间的影响(n=10,±s)Fig 2 Effect of sea buckthorn suspension on the sleep latency and sleep time of ICR mice(n=10,±s)
3.6 沙棘混悬液对大鼠协调运动的影响
SD 大鼠灌胃给予沙棘混悬液后,在0.5、1、2、3、4、6、8 h 将大鼠放在转棒仪滚筒上,记录每只大鼠从转棒仪滚筒上掉落所用时间,溶媒对照组、沙棘混悬液各剂量组大鼠从转棒仪上掉落的时间均集中于200~250 s,与溶媒对照组同一采集时间点的数值相比,沙棘混悬液各剂量组的大鼠协调运动时间未出现明显改变(P>0.05),结果如图3所示。
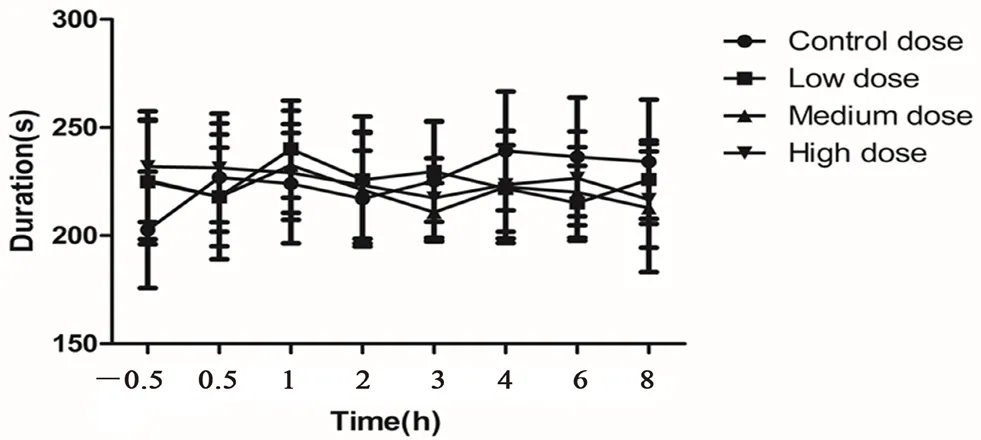
图3 沙棘混悬液对SD 大鼠协调运动的影响(n=10,±s)Fig 3 Effect of sea buckthorn suspension on coordinated exercise of SD rats(n=10,±s)
4 讨论
沙棘在亚洲和欧洲已被用作药物和营养补品已有数百年历史。但是,关于沙棘及其提取物安全性评价的数据仍然很少。目前已有报道沙棘的遗传毒性、致畸性、急性和亚慢性毒性数据,为完善其安全性评价,本课题组评估了沙棘对比格犬心血管系统,对小鼠和大鼠中枢神经系统的影响。
有研究表明,昆明小鼠对沙棘油的最大耐受剂量为20 mL·kg-1,在亚慢性毒性研究中,2.5 mL·kg-1和1.5 mL·kg-1剂量的沙棘油对大鼠和兔子是安全的[7-8]。最近有研究表明,雄性和雌性SD 大鼠在连续90 d 重复口服毒性试验中,沙棘油未观察到不良反应的水平为10 mL·kg-1。遗传毒性研究的结果表明,在暴露浓度分别为8、40、200、1000 和5000 μg·plate-1的条件下,沙棘油对鼠伤寒沙门氏菌的组氨酸依赖性菌株没有任何诱变活性;沙棘油对精子形态没有显著影响,剂量9.36、4.68 和2.34 g·kg-1对小鼠多色红细胞微核率无影响[9]。在致畸性研究中,从妊娠第7日到第16日,用4.68、2.34 和1.17 g·kg-1剂量的沙棘油灌胃妊娠大鼠,未观察到母体毒性或胚胎毒性[9]。然而,在文献中也已经报道了沙棘提取物的不利影响。在90 d 内,用250 和500 mg·kg-1的沙棘浆果提取物灌胃的大鼠血浆葡萄糖水平增加[10]。同样,在饲喂2%沙棘叶粉的日本鹌鹑中观察到淋巴组织的增殖[11-13]。
《中国药典》建议,沙棘安全剂量约为3~10 g·d-1。在本实验中,以0.4、1.2 和3.6 g·kg-1剂量(相当于人类临床剂量的10、30、90 倍)的沙棘灌胃小鼠,以0.27、0.81 和2.43 g·kg-1剂量(相当于人临床剂量的6.75、20.25、60.75 倍)的沙棘灌胃大鼠,以0.08、0.24 和0.72 g·kg-1剂量(相当于人类临床剂量的2、6、18 倍)的沙棘灌胃比格犬,在研究期间未观察到发病或死亡的迹象,且没有沙棘相关毒性或异常的迹象。
在中枢神经系统毒性研究中,在小鼠中给予3.6 g·kg-1剂量的沙棘相当于用标准体表面积换算后平均体质量为70 kg 的成人使用27.9 g·kg-1剂量的沙棘,在大鼠中给予2.43 g·kg-1的剂量相当于用标准体表面积换算后平均体质量为70 kg 的成人使用26.9 g·kg-1剂量的沙棘,都超出《中国药典》建议的安全用量。沙棘最大剂量为2.43 g·kg-1,对SD 大鼠的转棒实验没有显著影响,3.6 g·kg-1沙棘对ICR 小鼠的戊巴比妥诱导的睡眠和活动能力没有明显影响。沙棘在本研究的实验条件下均未表现出中枢神经系统毒性。此外,行为学检测方法能够直接准确地反映出动物中枢神经系统功能的变化情况,然而实验动物的种属、性别、实验间隔、粪便、气味以及实验时间段等均可能会影响动物的行为方式,进而影响实验结果。因此,如何根据实验需要选择恰当的动物行为学检测方法就显得尤为重要。
此外,还对沙棘对于比格犬的心血管毒性进行了评估。6 只健康比格犬口服4 种剂量水平(0、0.08、0.24 和0.72 g·kg-1)的沙棘,用标准体表面积换算,在狗中给予0.72 g·kg-1剂量的沙棘相当于平均体质量为70 kg 的成人口服27.0 g·kg-1剂量。在所有剂量下,对体温,血压(收缩压,舒张压和平均血压),心率和心电图参数(PR,QRS间期和QT 间期,P,T 波和R 波,ST 段)均无明显影响。根据给药过程中的临床体征,在一只以0.72 g·kg-1沙棘灌胃的比格犬中发现了干呕现象。由于在给药时动物出现干呕是普遍现象,因此该事件并不表明由于暴露于测试药物而产生了不良后果。另外,本研究实验表明,该现象也无剂量依赖性的趋势。根据这项研究的结果,比格犬灌胃给予沙棘浓度分别为0.08、0.24 和0.72 g·kg-1,对其体温、血压、心率和心电图无影响。
综上所述,在实验剂量水平内,沙棘对大小鼠中枢神经系统和比格犬心血管系统无影响。

