P21-活化激酶抑制剂PF-3758309脂质体的制备工艺及体外质量评价
徐佳璐,顾艳丽,刘佳,吕晓洁,李瑞娟(内蒙古医科大学药学院,呼和浩特 010110)
PF-3758309(PF-309)是一种以吡唑为母核选择性作用于p21 活化激酶(p21-activated kinases,PAKs)的丝氨酸/苏氨酸激酶抑制剂,可以竞争性地结合PAKs 的ATP 位点,阻断信号传导,抑制肿瘤细胞的增殖、迁移、侵袭,促进肿瘤细胞的凋亡,从而发挥靶向作用[1]。PF-309在临床研究中用于晚期转移性实体瘤的治疗,对不同类型的肿瘤细胞株均表现出广泛的抑制作用[2],但PF-309 口服生物利用度较低,水溶性不高以及药物稳定性较差等特点限制了其临床药效[3]。脂质体是新型的纳米药物递送系统,以卵磷脂为主要膜材,脂质双分子层与生物膜成分相似,组织相容性良好,脂质体包载下不仅能提高难溶药物的溶解度,增强药物的治疗效果,还能提高药物的生物相容性,从而减少给药剂量,降低药物的毒副作用[4-5]。利用脂质体的包埋技术使得药物的释放具有一定的缓释作用,可以提高被包埋药物的稳定性,适合静脉注射使用。脂质体作为药物载体具有淋巴趋向性,抗癌药物包封于脂质体中,能使药物选择性地杀伤癌细胞,增加药物对淋巴的定向性,改变药物在组织中的分布。本课题制备PF-309 脂质体(Lip@PF-309),并以包封率为考察指标,通过正交实验筛选最优制备工艺条件并对其进行体外质量评价,为PF-309 新剂型研究提供参考。
1 仪器与试药
1.1 仪器
1260 vialsampler 高效液相色谱仪(安捷伦科技有限公司);ZD-85 双功能气浴恒温振荡器(常州金坛良友仪器有限公司);S2-100V2 型纳米粒度分析仪(HORIBA日本公司);SB25-12 DTD超声波清洗机(宁波新芝生物科技股份有限公司);N-1300D 旋转蒸发仪(东京理化器械株式会社);S4800 扫描电镜(国仪量子公司);BFX5-320 型低速自动平衡离心机(白洋离心机厂);UpHW-II-90T 超纯水器(四川优普超纯科技有限公司);TU-1901 型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);FDU-2110型冷冻干燥机(上海爱朗仪器有限公司);VOS-310C 真空定温干燥箱(东京理化器械株式会社);Thermo Heraeus Pico 17R 冷冻离心机(赛默飞世尔科技公司)。
1.2 试药
PF-309(质量分数99.20%,批号:AK474043,安耐吉化学);大豆卵磷脂、胆固醇(罗恩试剂有限公司);水为超纯水;甲醇、三乙胺为色谱纯;其他试剂均为国产分析纯;葡聚糖凝胶G-50(北京偶合科技有限公司);D-(+)葡萄糖(分析纯,北京奥博星生物技术有限责任公司);蔗糖(分析纯,天津市科盟化工工贸有限公司);甘露醇(分析纯,上海阿拉丁生化科技股份有限公司);乳糖(分析纯,上海麦克林生化科技有限公司)。
2 方法与结果
2.1 Lip@PF-309 的制备
采用薄膜分散法制备脂质体。按处方量精密称定PF-309 2.5 mg、胆固醇12.5 mg、大豆卵磷脂25 mg,溶于5 mL 无水乙醇-三氯甲烷(3∶7)混合有机溶剂中,超声使药物与膜材完全溶解,45 ℃水浴条件下常压旋转蒸发20 min 后缓慢减压至0.1 MPa,至有机溶剂完全蒸出,在蒸发得到的均匀类脂膜中加入5 mL 磷酸盐缓冲液(PBS),60 ℃水浴条件下水合1.5 h,使膜完全脱落得到脂质体混悬液,冰水浴中超声均化20 min,至均一体系,再经0.45 μm 微孔滤膜过滤10 次整粒,即得Lip@PF-309,4℃下保存。
2.2 包封率的测定
2.2.1 色谱条件 色谱柱为 Hypersll GOLD C18色谱柱(4.6 mm×250 mm,5 μm);流动相为甲醇-0.1%三乙胺水溶液(70∶30);流速为1.0 mL·min-1;紫外检测波长为254 nm;进样量为10 μL;柱温为28℃。结果表明,在此色谱条件下,PF-309 游离药物与空白脂质体分离性良好,辅料对药物的测定无干扰。
2.2.2 标准曲线的制备 将质量浓度为100µg·mL-1的PF-309 对照品溶液稀释为5、10、20、30、40、50 µg·mL-1的系列对照品溶液。按照“2.2.1”项下色谱条件进样分析,得标准曲线方程Y=13.26X+1.187,r=1.000,表 明PF-309在5~50 µg·mL-1与峰面积呈良好的线性关系。
2.2.3 方法学验证 制备含空白脂质体的低、中、高3 种不同质量浓度PF-309 样品溶液,计算平均回收率分别为99.8%、100.0%、100.1%(n=3),RSD均小于2%,结果符合加样回收率要求。精密吸取质量浓度为100 µg·mL-1的PF-309 对照品溶液在同一日内连续进样5 针,记录峰面积,计算日内RSD;用同一个对照品溶液每日进样1针,连续进样5 d,记录峰面积,计算日间RSD,结果日间、日内RSD分别为0.71%、0.26%(n=5),表明精密度良好。精密取同一样品5 份,测定,测得药物峰面积RSD为0.45%(n=5),表明该方法重复性良好。
2.2.4 包封率的测定 采用葡聚糖微型凝胶柱离心法来分离脂质体与游离未包封药物[6-7]。取Lip@PF-309 混悬液0.5 mL 于10 mL 量瓶中,甲醇破乳并稀释定容,按“2.2.1”项下色谱条件检测总的药物含量(W0)。另取Lip@PF-309 混悬液0.5 mL 缓慢滴加到微柱顶端,2500 r·min-1离心2.5 min 后,收集洗脱液,然后补充0.5 mL PBS(pH 7.2)于微柱顶端,同样条件洗脱,连续洗脱3 次,收集所有洗脱液于10 mL 量瓶中,甲醇破乳并稀释定容,按“2.2.1”项下色谱条件检测包封药物含量(W1)。根据公式计算包封率,包封率(EE%)=(W1/W0)×100%。
2.3 Lip@PF-309 处方的单因素考察
2.3.1 卵磷脂浓度对包封率的影响 固定其他条件不变,选取卵磷脂质量浓度1、3、5、9、15 mg·mL-1,测定其包封率分别为79.8%、82.3%、85.2%、77.6%、75.9%,结果表明在一定范围内,药物的包封率随卵磷脂浓度的增加而增加,但过高的磷脂浓度会导致磷脂聚集,使药物难以释放[8],故选择卵磷脂浓度1、3、5 mg·mL-1进行正交实验。
2.3.2 胆固醇与卵磷脂质量比(膜材比)对包封率的影响 胆固醇对脂质体膜流动性起调节作用,改善了药物的包封率与稳定性,但过量的胆固醇会与脂溶性药物(PF-309)在磷脂双层膜中发生竞争置换现象,导致包封率降低。固定其他条件不变,膜材比取1∶1、1∶2、1∶3、1∶4、1∶5,测定其包封率分别为81.2%、85.3%、83.6%、79.5%、76.8%,故选择膜材比为1∶1、1∶2、1∶3进行正交实验。
2.3.3 药脂比对包封率的影响 固定其他条件不变,药脂比分别为1∶5、1∶10、1∶15、1∶20、1∶30,测定其包封率分别为84.2%、88.7%、86.3%、75.5%、73.2%。结果表明,药物的包封率随胆固醇质量增加而增加,当两者比例逐渐增大时,包封率有所下降,当药脂比达到1∶20 时,包封率较低,故选择药脂比为1∶5、1∶10、1∶15进行正交实验。
2.4 正交实验设计优化Lip@PF-309 处方
在单因素实验的基础上,选择膜材比(A)、药脂比(B)、卵磷脂浓度(C)为考察因素,D列为误差列,采用L9(34)因素水平表进行正交设计实验,以包封率为评价指标,筛选制备PF-309 脂质体的最佳工艺。正交因素与水平设计见表1,以包封率为考察指标的正交实验设计与结果见表2,方差分析见表3。根据表中极值(R)直观分析可知,影响Lip@PF-309 脂质体包封率的因素由大到小依次为B>A>C,最佳处方为B2A2C1,即卵磷脂浓度5 mg·mL-1,膜材比1∶2,药脂比1∶10。
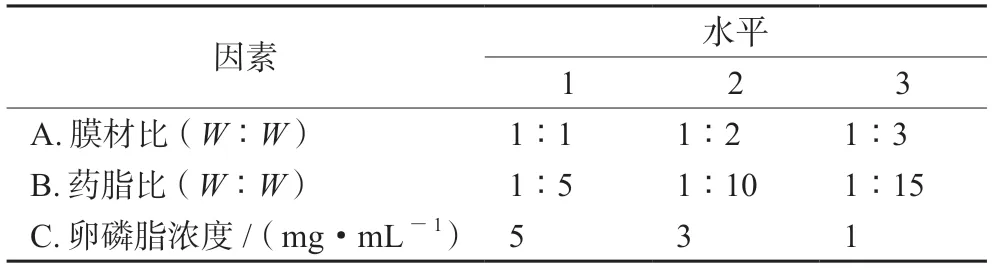
表1 正交因素设计水平Tab 1 Factor and level of orthogonal design
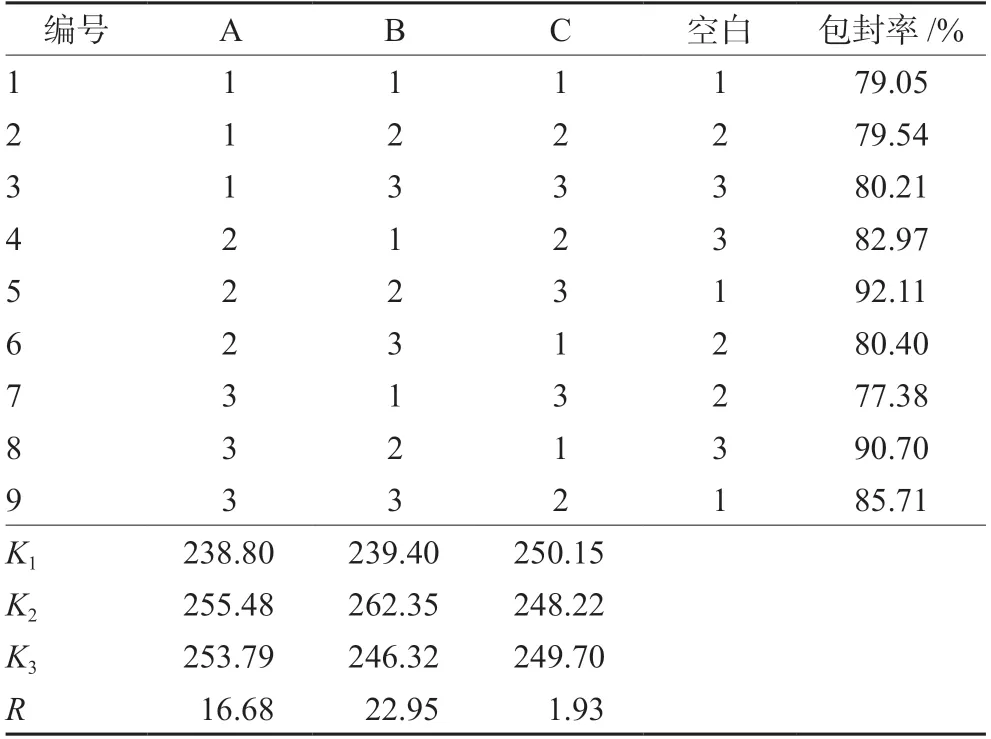
表2 正交实验设计结果Tab 2 Orthogonal design
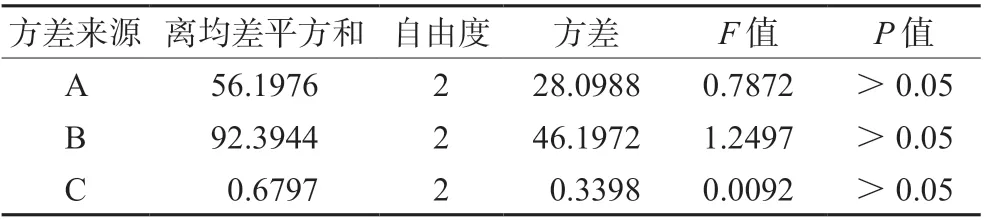
表3 方差分析Tab 3 Analysis of variance
2.5 Lip@PF-309 的验证及质量评价
按“2.4”项下的最优处方,制备3 批Lip@PF-309,测得包封率分别为(92.15±0.21)%、(91.89±0.18)%、(92.22±0.06)%,表示最优工艺有良好的重现性。制得的脂质体外观呈乳白色混悬液,平均粒径为(112.25±0.08)nm,粒径的多分散指数(PDI)为(0.158±0.03)(见图1),Zeta 电位为(-7.75±0.13)mV。制得的Lip@PF-309 呈球形或类球形,粒径集中在110~130 nm,分布较为均匀(见图2)。4℃条件下放置30 d,Lip@PF-309没有出现沉降现象,包封率无明显降低,表明稳定性良好。
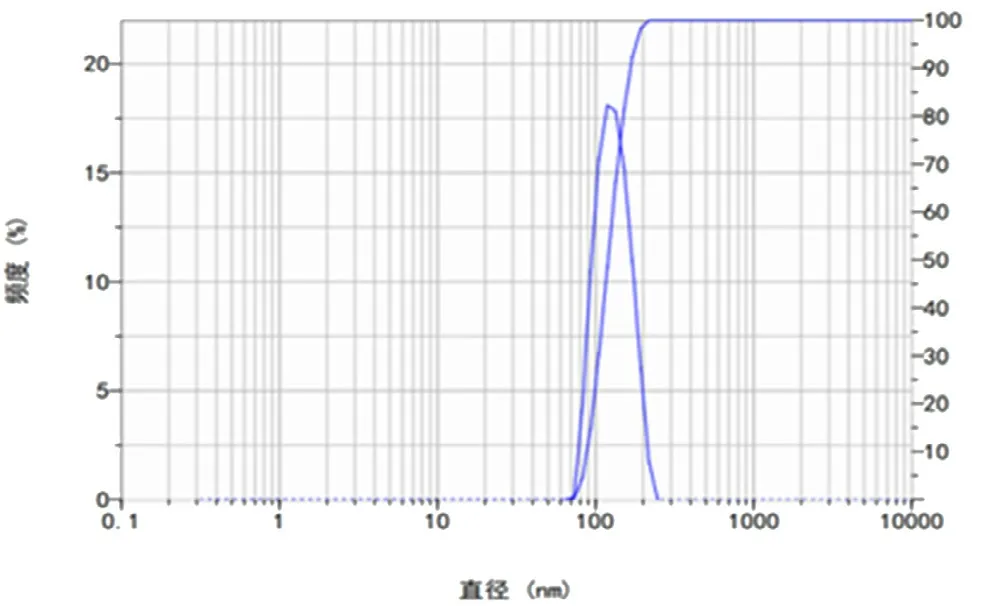
图1 Lip@PF-309 的粒径分布图Fig 1 Particle size of PF-309 liposome
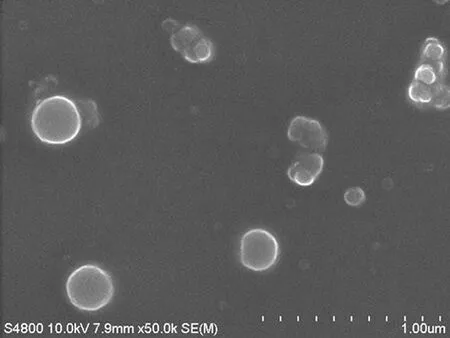
图2 Lip@PF-309 脂质体扫描电镜图Fig 2 Scanning electronic microphotograph of PF-309 liposome
2.6 体外释放度实验
取Lip@PF-309 混悬液,以等浓度的PF-309原溶液作对照,分别吸取1 mL 移入已处理好的透析袋(8000~14 000 D)中,置于50 mL(pH 7.2)PBS 缓冲液中,于恒温(37±1)℃、恒速(85 r·min-1)的摇床中混匀,在0.5、1、1.5、2、4、6、8、10、12、24、48、72 h 不同时段取释放液1 mL,HPLC 测定含量,计算平均累积释放百分率,释放曲线结果见图3。PF-309 原料药组6 h 时PF-309 累积释放率达85.65%,释放迅速。Lip@PF-309 组24 h 时PF-309 累计释放率仅为 85.03%,释放相对于原料药组较为缓慢,参比制剂(Rt)PF-309 溶液与受试制剂(Tt)Lip@PF-309 两者溶出曲线的相似因子(f2)值为41,小于50,说明两者溶出曲线不相似,即缓释效果较为明显。

图3 体外释放曲线Fig 3 Drug release in vitro
2.7 冻干脂质体的制备
分散在水溶液中的脂质体在长期贮存后一般会出现物理化学不稳定性,磷脂的水解氧化和脂质体的聚集是脂质体不稳定的主要原因[9]。为了提高Lip@PF-309 的储备稳定性,解决液态脂质体无法长期贮存的问题,本研究采用真空冷冻干燥技术来制备Lip@PF-309 冻干脂质体,但是脂质体在冻干的过程中,经常会出现脂质体破裂导致包封药物渗漏以及粒子融合造成粒径增大的问题,因此在冷冻干燥过程中需加入冻干保护剂。多元醇类和糖类由于结构中均有羟基基团,均能产生“优先水化作用”,可在脂质体样品冻干过程中起保护作用。但由于采用单个冻干保护剂冻干时,冻干脂质体的外观欠佳,再分散性较差,包封率与冻干前脂质体样品差距较大等问题[10-11],故本研究将采用双冻干保护剂联用,来考察冻干脂质体的最佳工艺。
2.7.1 联用冻干保护剂种类的筛选 固定冻干保护剂加入总量为10%(w/v),两种保护剂质量比相等,以冻干制品的外观、再分散性、包封率等为评价指标,考察保护效果较好的甘露醇与乳糖、蔗糖和葡萄糖分别联用对冻干样品的保护效果。参考文献[12],本研究固定预冻时间为-80℃,在前期预实验的基础上,冷冻干燥的温度设置为-80℃,时间24 h。结果显示甘露醇与蔗糖和葡萄糖分别联用时,得到的冻干品外观均有萎缩且再分散性较差,而甘露醇与乳糖联用时得到的冻干脂质体外观疏松饱满,再分散性良好,复溶后的包封率接近冻干前样品,且粒径无明显变化。
2.7.2 联用冻干保护剂用量的考察 使用甘露醇-乳糖(1∶1)作为联用保护剂,考察保护剂的总量分别为1%、5%、10%、15%、20%时对冻干脂质体的保护作用,结果显示,当保护剂总量为10%时,冻干品的包封率最高。
综上所述,取2 mL Lip@PF-309 混悬液,外加10%(w/v)甘露醇-乳糖(1∶1),-80℃条件下预冻24 h,冷冻干燥过程-80℃条件下进行24 h,制得Lip@PF-309 冻干脂质体。外观如图4所示,冻干品外观疏松平整,为白色粉末状,高度无明显塌陷。冻干脂质体的再分散性良好,加入与冻干前脂质体样品相同体积的PBS 溶液,振摇后,冻干品即可复溶。冻干前样品粒径和包封率分别为112.25 nm 和92.11%,冻干后样品的粒径和包封率分别为115.77 nm 和90.35%,可见冻干后脂质体的粒径略有增大,包封率略有减小,但均无明显的变化趋势。

图4 Lip@PF-309 混悬液(A)及其冻干品(B)Fig 4 Lip@PF-309 suspension(A)and freeze-dried product(B)
2.8 溶血实验及血浆稳定性考察
2.8.1 体外溶血实验 取新鲜鼠血,收集于肝素钠采血管中。3000 r·min-1离心5 min,弃去上层血浆,加入约10 倍量生理盐水摇匀后,4℃、2500 r·min-1离心10 min,弃去上层清液洗涤2~3 次,直至上清液不再呈红色为止。吸取底层红细胞0.8 mL,用生理盐水稀释至40 mL,摇匀,即得2%红细胞混悬液[13]。取8 只洁净离心管,编号依次为A1、A2、A3、B1、B2、B3、阴性对照、阳性对照。A1、A2、A3分别为10、20、40 µg·mL-1的PF-309 对照品溶液;B1、B2、B3分别为PF-309 质量浓度为10、20、40 µg·mL-1的脂质体混悬液;阴性对照为生理盐水;阳性对照为蒸馏水。每管加入适量的2%红细胞混悬液,立即置于(37±0.5)℃的恒温水浴中孵育30 min,离心取上清液,在535 nm 处测定吸光度(A值),计算溶血率。溶血率(%)=(Ai-A0)/(A1-A0)×100%,Ai为各供试品的吸光度,A0为阴性对照吸光度,A1为阳性对照吸光度,溶血率>5%则表明发生溶血。结果见表4,当PF-309 对照品达到20 µg·mL-1时的溶血率>90%,而将PF-309 包裹在脂质体中,当PF-309高达400 µg·mL-1时,也未出现溶血(溶血率仅为1.88%),表明脂质体的包裹可有效解决PF-309 溶血的不良反应。
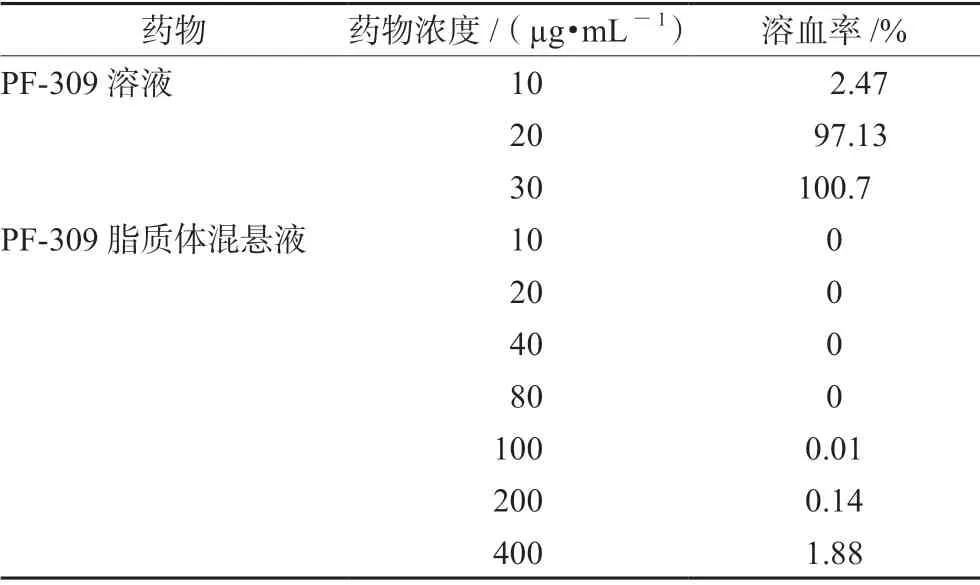
表4 PF-309 溶液及PF-309 脂质体的体外溶血活性Tab 4 In vitro hemdytic activity of PF-309 solution and PF-309 liposome
2.8.2 血浆稳定性实验 脂质体在血液中稳定是发挥药物递送作用的关键,从体循环向各组织器官或者体液转运的过程中,稳定的脂质体形态有助于药物更好地发挥药效[14-15]。取新鲜鼠血置于肝素钠采血管中,迅速于4000 r·min-1低温离心10 min,取上层血浆待用[16]。精密吸取空白血浆450 μL 于离心管中,加入药物质量浓度为200 µg·mL-1的Lip@PF-309 混悬液50 μL(重复5 份),涡旋混匀1 min,得20 µg·mL-1的样品液,37 ℃水浴条件下分别放置0 min、10 min、30 min、1 h、2 h、4 h、6 h、8 h、12 h 后取样。取血浆样品200 µL 加入离心管,涡旋30 s,加乙酸乙酯3 mL,涡旋,于3000 r·min-1离心10 min,吸取上清液于另一试管中,37℃真空干燥后,加流动相100 µL 复溶,涡旋,离心,用0.22 μm 的有机滤膜过滤后,采用HPLC 方法检测,记录色谱图,计算包封率。结果见表5。
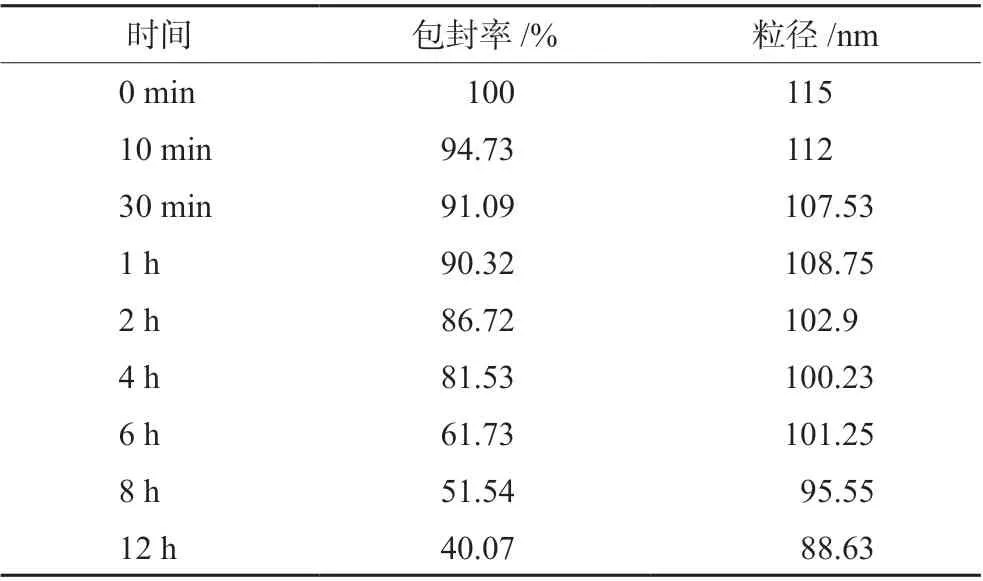
表5 不同时间点Lip@PF-309 在血浆中的包封率及粒径变化Tab 5 Encapsulation efficiency and particle size change of Lip@PF-309 in the plasma at different time points
由表5结果可知,Lip@PF-309 在血浆中包封率下降的速度较慢,至6 h 时Lip@PF-309 的包封率仍大于60%,这表明Lip@PF-309 注射入血后能够较长时间地保持脂质体形态完整,稳定的剂型结构可以使药物在递送系统的包载下,更好地到达靶部位发挥作用。
3 讨论
本研究旨在构建Lip@PF-309 递药系统,利用脂质体的包埋技术,来提高药物的溶解性、稳定性及生物相容性,改善药物的溶血作用,并对其进行体外质量评价。在实体瘤生长部位,病变导致毛细血管的通透性增加,适当粒径范围的脂质体,在病变部位的渗透性和滞留量增加。粒径作为影响纳米载药系统药动学与药物靶向性的主要因素,决定着脂质体在体内的分布与被动靶向性作用[17]。扫描电镜下观察Lip@PF-309 外观圆整、粒径均一,粒径<200 nm,与纳米粒度仪测试结果一致,符合静脉给药的要求。体外释放实验可知,Lip@PF-309 脂质体混悬液相比PF-309溶液,表现出了较好的缓释效果。首先可能是脂质体作为药物的储存形式,能使包埋的内含物缓慢释放;其次阴离子脂质体表面的负电荷与带正电荷的药物分子产生静电吸附作用,提高了药物的包封效率,达到缓释的作用效果[18];除此之外脂质体表面电荷的性质会影响纳米粒子的稳定性、生物分布以及细胞亲和力,Lip@PF-309 表面带有少量的负电荷,较中性粒子可以更快更大程度地通过内吞促进细胞摄取,同时少量的负电荷可以降低粒子的聚集性,避免吞噬机制,从而延长脂质体在体内的循环时间[19]。具有苯环或共轭结构的化合物对乙酰胆碱酯酶有抑制作用,药物作用于红细胞膜的乙酰胆碱酯酶,使其受到高度抑制,使红细胞破坏加速造成溶血[20]。经体外溶血实验发现,PF-309 溶液具有显著的溶血现象,这也是PF-309 在临床中引起毒副反应的主要原因之一,本文制备的Lip@PF-309,当脂质体中药物质量浓度高达400 µg·mL-1时,溶血率仅为1.88%,表明脂质体的包裹可有效解决PF-309 引发的溶血不良反应,这为新剂型的安全性提供了参考。
本研究采用薄膜分散法制备Lip@PF-309,制备工艺简单,且制得的脂质体纳米粒有较高的包封率和良好的体外缓释效果,显著降低了PF-309 的溶血作用,脂质体在血液中表现出良好的稳定性,在进入血循环到达靶部位之前,完整的形态有助于药物更好地发挥药效,这为Lip@PF-309 的后续体内药动学及药效研究奠定了重要基础,对PF-309 药物新剂型的研发具有一定的参考价值。

