青蒿琥酯脂质体的处方优化及抗非小细胞肺癌评价
吴小瑜,龙苗苗,毛静,程沁园,邱立朋*,陈敬华(.江南大学药学院,江苏 无锡 4;.无锡卫生高等职业技术学校药学系,江苏 无锡 408)
癌症作为世界三大疾病之一,其新发病例与死亡人数正逐年递增。与其他国家相比,我国癌症治疗现状不容乐观,发病率和致死率均居于第一位[1]。多年来,癌症的治疗受到广泛关注,化疗作为其治疗的重要策略,不良反应严重、缺乏选择性、患者耐受性差等缺点影响了其临床治疗效果[2-3]。纳米给药系统的迅速发展为癌症的临床治疗开辟了新的方向,通过给药系统的包载可以有效降低药物的毒副作用,增加药物的稳定性,降低给药剂量。此外,纳米给药系统的应用还可以增加药物的体内循环时间,实现缓释给药等作用。
青蒿琥酯(artesunate,ART)是青蒿素衍生物,一直是抗肿瘤药物研究的热点,对很多肿瘤具有较好的抑制作用[4-5]。Efferth 等[6]发现青蒿琥酯对乳腺癌、前列腺癌、结肠癌、卵巢癌、黑色素瘤和中枢神经系统肿瘤等都有较好的抑制作用。然而,ART 的溶解度较低,遇水容易降解,半衰期短,对肿瘤选择性较差,生物利用度低,无法发挥较好的抗肿瘤效果[7],限制了临床应用。因此,将其制备成新型纳米制剂是一个理想的选择。脂质体是纳米制剂的一种,一般是由磷脂和胆固醇构成的一种双分子层小囊泡,具有类似生物膜结构的特性,这种特殊的结构能够有效改善药物水溶效果,维持药物活性,提高药物的生物利用度[8-12]。磷脂和胆固醇是构成细胞膜的关键成分,因此脂质体表现出良好的生物相容性,通过与靶标细胞的吸附与融合能实现药物的有效输送。
虽然青蒿琥酯脂质体(ART-liposome)的文献已有报道,但大多侧重作用机制、功能修饰及对肝癌的治疗等,缺乏对ART-liposome 制备处方工艺及抗非小细胞肺癌的研究。因此,本文在前期筛选的基础上,对关键的制备处方和工艺进行优化,制备出粒径均匀的ART-liposome,并对其体外抗非小细胞肺癌作用进行评价。
1 材料
1.1 仪器
Zetasizer Nano ZS 纳米粒度仪(英国Malvern仪器有限公司);JEM-2100 透射电镜(日本日立公司);UV-2550 紫外可见分光光度计(日本岛津仪器有限公司);Multiskan GO 酶标仪(美国Thermo Fisher Science 公司);Ti2-E+A1 激光共聚焦显微镜(日本尼康公司)。
1.2 试药与细胞
氢化大豆磷脂(HSPC,德国Lipoid GmbH);胆固醇(阿拉丁试剂有限公司);青蒿琥酯(上海麦克林生化科技有限公司);多聚甲醛、氯仿、二甲亚砜(DMSO)(国药集团上海试剂公司),DMEM 细胞培养基(美国Thermo Fisher Science公司);噻唑蓝(MTT)、青霉素-链霉素(上海生工生物工程有限公司);胎牛血清(杭州四季青生物工程材料有限公司)、DAPI 染色液(碧云天生物技术有限公司);Calcein-AM/PI 细胞双染试剂盒(Abcam 试剂有限公司);人非小细胞肺癌细胞A549(中国科学院典型培养物保藏委员会细胞库);其他试剂均为市售分析纯。
2 方法
2.1 脂质体处方筛选及制备
采用薄膜分散法制备脂质体并对HSPC 和胆固醇的比例(摩尔比分别为2.0∶1.0、1.0∶1.0、1.0∶1.5、1.0∶2.5)进行筛选。以1.0∶1.0 为例,称取等摩尔比的HSPC 和胆固醇溶于适量氯仿,将溶液转移至圆底烧瓶中,旋转蒸发除去氯仿,至圆底烧瓶上形成一层均匀的薄膜,将圆底烧瓶置于真空干燥箱24 h,进一步除去氯仿。干燥结束后在圆底烧瓶中加入10 mL 去离子水,超声破碎得到脂质体。随后用动态光散射法(DLS)测定脂质体的粒径、多分散系数(PDI)及电位。
2.2 纳米化时间筛选
选择超声破碎法对所制得的脂质体进行处理,为得到尺寸更小、粒径均一的脂质体,笔者对超声时间进行了筛选。用超声破碎仪对按“2.1”项下方法制得的脂质体分别进行3、5、10、15 min的超声破碎,随后采用DLS 测定脂质体的粒径及电位。
2.3 载药脂质体的制备及表征
将筛选出的最优比例的HSPC 和胆固醇溶于氯仿,并加入适量ART 后,将溶液转移至圆底烧瓶中,旋转蒸发除去氯仿,至圆底烧瓶上形成一层均匀的薄膜,将圆底烧瓶置于真空干燥箱24 h,进一步除去氯仿。干燥结束后在圆底烧瓶中加入10 mL 去离子水超声破碎得到载药脂质体,并用透析法除去未载入的ART,制备得到ARTliposome。用纳米粒度仪测定脂质体的粒径及电位,用透射电镜(TEM)观察其形貌。
2.4 药物释放
通过动态透析法研究载药脂质体的体外药物释放行为。向透析袋中加入载药脂质体,分别浸泡在20 mL pH 7.4 和5.0 的PBS 中,并置于37 ℃摇床中,摇床转速为100 r·min-1,在特定的时间点取出1 mL PBS 用于测量ART,并补充相同体积新的PBS。利用紫外分光光度法测定ART 的释放量(Er)。计算公式如下:
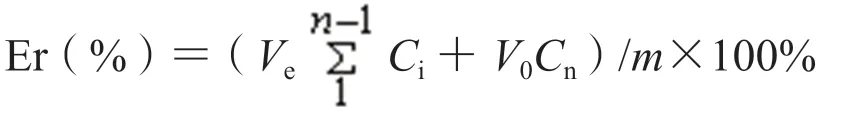
取样体积和释放介质的总体积分别以Ve和V0表示,胶束中药物含量以m表示;第i次取样时样品浓度以Ci表示。
2.5 脂质体细胞毒性
采用MTT 法考察脂质体的体外毒性,并选择A549 细胞作为体外细胞模型。将细胞以6000个/孔的密度铺于96 孔板中,然后于37 ℃培养箱中培养12 h 使其贴壁生长,弃去原培养基并补加100 μL 含不同质量浓度空白脂质体或载药脂质体的培养基,继续孵育48 h 后每孔加入100 μL MTT 溶液(0.5 mg·mL-1),孵育4 h。随后弃去MTT 溶液,加入相同体积的DMSO 溶解蓝紫色晶体,在570 nm 波长下测定吸光度值并计算细胞存活率,以未经脂质体处理的细胞作为对照。细胞存活率(%)=脂质体组吸光度/空白组吸光度×100%。
2.6 细胞状态观察
将细胞以3×104个/孔的密度铺于24 孔板中,然后于37℃培养箱中培养12 h 使其贴壁生长,弃去原培养基并补加1 mL 含不同质量浓度的游离药物和载药脂质体的培养基,继续孵育48 h 后用显微镜观察细胞形态。
2.7 细胞摄取
将细胞以2×105个/孔的密度铺于6 孔板中,然后于37℃培养箱中培养12 h 使其贴壁生长,弃去原培养基并补加2 mL 含不同质量浓度载药脂质体的培养基,继续孵育48 h。弃去培养基并用预冷的PBS 洗涤3 次,每孔加入500 μL 细胞裂解液裂解细胞并离心收集(12 000 r·min-1,10 min),测定上清液中青蒿琥酯的含量。
2.8 Calcein-AM/PI 细胞染色
将细胞以1×105个/孔的密度铺于激光共聚焦小皿中,然后于37 ℃培养箱中培养12 h 使其贴壁生长,弃去原培养基并补加2 mL 不同质量浓度的载药脂质体的培养基,继续孵育48 h 后用Calcein AM/PI 染色15 min,然后用预冷的PBS洗涤3 次,用激光共聚焦显微镜观察。
2.9 统计分析
所有统计分析均采用SPSS 17.0 软件完成,数据以平均值±标准差(Mean±SD)表示,组间差异通过独立样本t检验进行分析,P<0.05为差异具有统计学意义。
3 结果
3.1 HSPC 与胆固醇比例筛选
如图1所示,4 种脂质体粒径都在纳米级,且都带有负电性,HSPC 与胆固醇比例为2.0∶1.0 与1.0∶2.5时,制得的脂质体粒径较大且分布不均匀,PDI 也较大;比例为1.0∶1.0 与1.0∶1.5,粒径较小且分布较为均匀,其中1.0∶1.0 制备的脂质体负电荷更强,更有利于其血清稳定性,因此选择HSPC 与胆固醇比例为1.0∶1.0 进行脂质体制备。
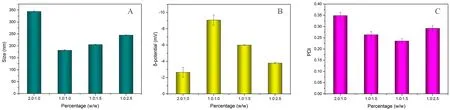
图1 HSPC 与胆固醇不同摩尔比脂质体的粒径(A)、电位(B)以及PDI(C)Fig 1 Effect of different molar ratios of HSPC and cholesterol on the liposome particle size(A),zeta potential(B)and PDI(C)
3.2 超声时间筛选
通过DLS 测定不同超声时间处理的脂质体的粒径和PDI,结果如图2所示。随着超声时间的延长,脂质体的粒径逐渐减小,超声破碎10 min时脂质体的粒径在110~120 nm 且分布均匀(PDI约为0.25),经肿瘤增强渗透滞留效应(EPR)可以有效地蓄积在靶标部位。但是在超声15 min 时粒径分布图显示出现双峰,PDI 也逐渐增大,推测是过度超声破坏了脂质体的结构,部分脂质体发生絮凝,因此超声时间选择10 min。
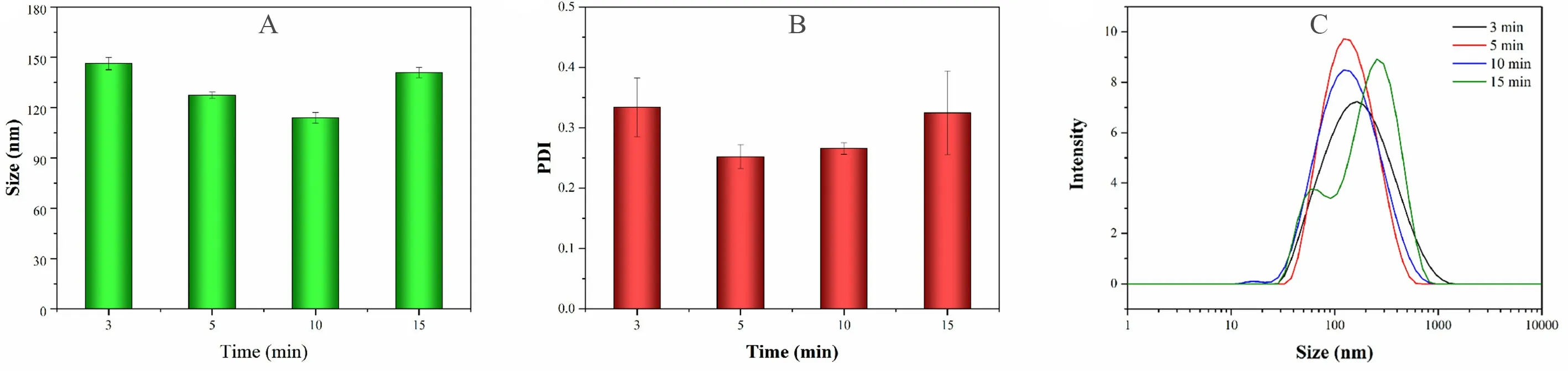
图2 不同超声时间制备的脂质体的粒径(A)、PDI(B)以及粒径分布图(C)Fig 2 Effect of different ultrasonic times on the liposomes particle size(A),PDI(B)and particle size distribution(C)
3.3 载药脂质体的表征
如图3所示,ART-liposome 粒径为(120±5.01)nm,TEM 结果显示ART-liposome 呈规则的球形,且大小均匀。这一特点可使脂质体不被网状内皮系统吞噬,并经EPR 效应蓄积到靶标部位[13]。ARTliposome 的包封率为(92.45±3.57)%,载药量为(15.72±1.31)%,表明脂质体对ART 具有良好的包载药物的能力。
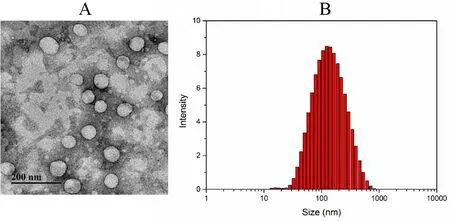
图3 载药脂质体的TEM 图(A)和粒径图(B)Fig 3 TEM image(A)and particle size distribution(B)of ARTliposome
3.4 体外药物释放
如图4所示,载药脂质体在pH 7.4 的PBS 中累积释放率在30%左右,说明脂质体在血液中维持良好的稳定性,可以有效减少血液输送过程中的药物泄露,降低对正常组织的毒副作用。然而,ART-liposome 在pH 5.0 的PBS 中累积释放率达到了60%。这可能是由于青蒿琥酯在弱酸性环境中的溶解度比中性条件下高,扩大药物在脂质体和溶出介质中的浓度差,更有利于药物的溶出。以上结果表明载药脂质体在肿瘤部位酸性条件下可以释放出药物,增加肿瘤部位药物蓄积量,提高治疗效果。
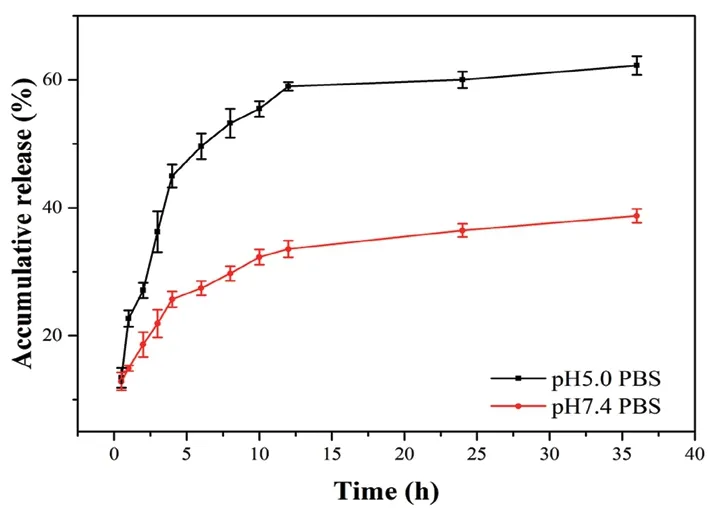
图4 不同pH 条件下载药脂质体的药物释放情况Fig 4 Drug release of ART-liposome at different pH condition
3.5 体外细胞毒性
如图5A 所示,即使空白脂质体的浓度达到500 µg·mL-1,细胞存活率仍高于85%,说明空白脂质体对细胞基本无毒。以游离ART 作为对照组,通过MTT 法考察了载药脂质体在48 h 的体外细胞毒性。结果显示,随着ART 浓度的增加细胞存活率下降,且游离ARTIC50值在24 h 和48 h 分别为(58.79±5.1)µg·mL-1和(81.94±8.4)µg·mL-1,游离药物细胞毒性药强于ART-liposome(见图5B)(P<0.05)。
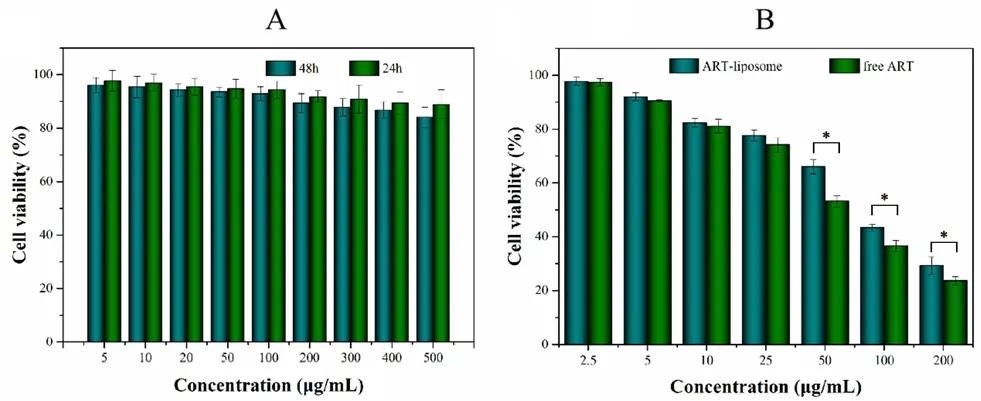
图5 空白脂质体(A)和ART-liposome(B)在48 h 的细胞毒性(P<0.05)Fig 5 Cytotoxicity of blank liposomes(A)and ART-liposome(B)at 48 h(P<0.05)
3.6 细胞形态
如图6所示,未加药物的空白培养基中细胞成明显的梭形,排列紧密且贴壁生长,细胞状态良好。而经ART-liposome 孵育的细胞数目明显减少,且与浓度成负相关,大量细胞变圆且边缘发亮,证明细胞贴壁不牢,生长状态差或已经死亡,说明ART-liposome 对肿瘤细胞有杀伤作用。
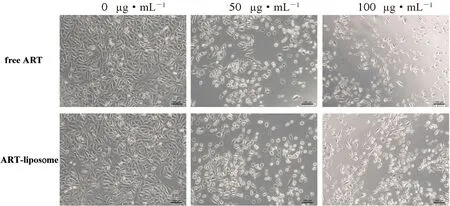
图6 经不同质量浓度ART 和ART-liposome 处理后细胞状态Fig 6 A549 cells treated with different concentrations of free ART and ART-liposome
3.7 细胞摄取
如图7所示,游离ART 的摄取量高于ARTliposome(P<0.05),这可能是由于小分子药物ART 依靠被动扩散进入细胞,而脂质体则可能通过胞饮等主动转运方式进入细胞,具有能量依赖性。此外,随着孵育时间的延长,细胞对ARTliposome 的摄取明显增加,表现出明显的时间依赖性。
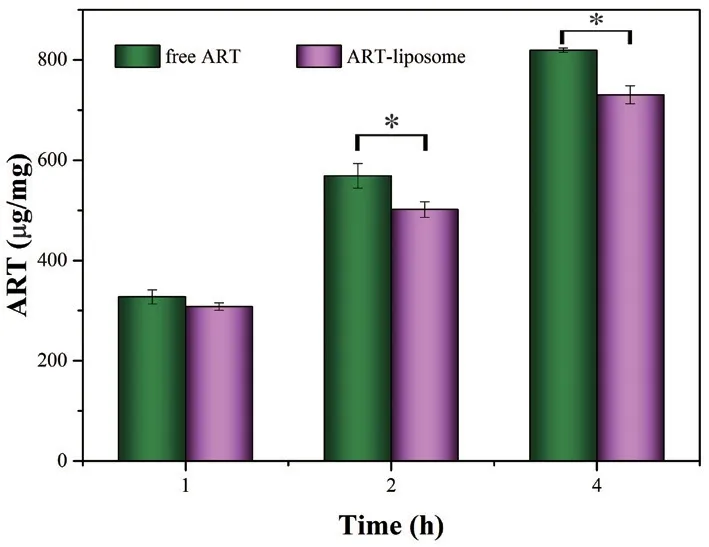
图7 A549 细胞对ART-liposome 的摄取情况(*P<0.05)Fig 7 Uptake of ART-liposome by A549 cells(*P<0.05)
3.8 Calcein-AM/PI 细胞染色
如图8所示,对照组细胞被染成明显的亮绿色,细胞呈梭形,生长状态良好。ART-liposome组有大量细胞核被染成红色,且浓度越高死亡数目越多。被染成绿色的活细胞形状不再是梭形,而是呈圆形或椭圆形,表明细胞状态不佳。3D模式下荧光图更为直观地表明了这一特点(见图8B),这说明ART-liposome 能够有效地杀死肿瘤细胞。
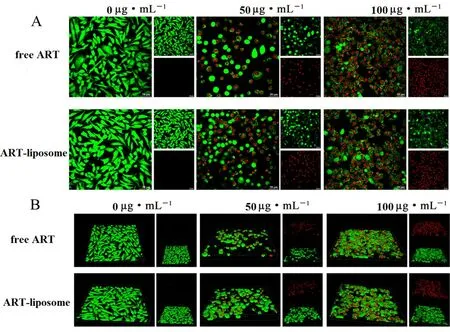
图8 经不同质量浓度制剂处理的A549 细胞荧光平面图(A)和立体图(B)Fig 8 Plane fluorescence images(A)and stereo fluorescence images(B)of A549 cells treated with different concentrations of free ART and ART-liposome
4 讨论
青蒿素及其衍生物对乳腺癌、白血病、前列腺癌等多种肿瘤有抑制其生长的活性,是潜在的高效低毒的新一类抗肿瘤药物。其中,ART 不但对多种肿瘤细胞有抑制作用,还可以增加肿瘤细胞的放射敏感性和逆转肿瘤细胞对传统药物的多耐药性。此外,它有选择性高、安全性好及剂量低等优势,符合当前抗肿瘤药物开发思路。然而,由于ART 半衰期短、溶解度低、遇水易降解,难以制成液体制剂,限制了其作为抗肿瘤药物在临床的应用。
脂质体是较为成熟的纳米制剂,具有生物相容性和肿瘤靶向性等优点,目前已有多种脂质体抗肿瘤药物上市。虽然已有文献制备ARTliposome,验证了其抗肿瘤作用,但缺乏详细的脂质体制备方法和工艺,或仅为通过醋酸钙梯度法等制备功能化ART-liposome[14-15],对具有工业化潜力的ART-liposome 处方和工艺研究较少。此外,已有文献报道ART 可以降低非小细胞肺癌的发生与侵袭[16],增加其放疗的敏感性[17],但ARTliposome 对非小细胞肺癌的治疗作用尚无报道。
因此,本文在前期实验筛选基础上,选择HSPC 和胆固醇为主要处方材料,通过薄膜分散法优化两者配比,并筛选超声工艺,制备ARTliposome。最终ART-liposome 粒径较小,外形均一,具有较高的载药量。通过细胞毒性、生长状态、摄取情况以及染色观察,验证ART-liposome的体外抗肿瘤活性。虽然结果显示游离药物通过被动扩散能够更快地进入肿瘤细胞发挥作用,但是,游离药物水溶性差,并缺乏肿瘤选择性,可能引起全身不良反应。ART-liposome 通过EPR效应被动靶向到肿瘤组织,然后被非小细胞肺癌A549 细胞摄取,发挥抗肿瘤作用。目前本研究仅通过体外抗肿瘤评价了ART-liposome 作为抗肿瘤新剂型的可行性,动物体内抗肿瘤作用、体内安全性等还需要进一步验证。此外,还可以对脂质体进行深入修饰,引入长循环、主动靶向等特性,制备多功能化ART-liposome。

