Nrf2在脑铁代谢中作用的研究进展*
高雅萱, 宋顺晨, 盛 奕, 芮同宇, 罗承良
(苏州大学基础医学与生物科学学院法医学系,江苏苏州215123)
神经细胞的铁代谢平衡对大脑的正常功能至关重要。很多脑部疾病常常伴随有脑铁代谢(brain iron metabolism)的紊乱。这种紊乱不加控制可以引起神经细胞的铁死亡(ferroptosis)——一种可调控性细胞死亡(regulated cell death,RCD)形式,其特征是铁过载引起的脂质过氧化(lipid peroxidation,LPO)积累。作为一种转录因子,核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)调控许多与脑铁代谢和铁死亡相关的基因。研究显示,Nrf2起到了减轻“有毒”铁负载、缓解铁死亡的作用。本文根据此方面的研究进展,从神经细胞吸收、储存、利用、释放铁和抗铁死亡的角度对Nrf2调控脑铁代谢紊乱进行了总结。
1 脑铁代谢及脑铁代谢紊乱所致疾病
在生命体内,铁几乎是所有真核细胞必需的金属元素[1]。铁参与众多氧化还原反应、电子传递及合成反应,也是各种酶的重要辅助因子[2-3]。铁拥有不成对电子,可接受或提供电子,从而表现出灵活的配位和氧化还原活性。在生理情况下,通过细胞多步调控,游离的不稳定铁被转化成稳定的价态后被收集、储存或排出,帮助神经系统循环利用铁元素。但在病理情况下,价态切换的延迟和铁运输的紊乱会导致部分游离铁从这样的平衡中“逃逸”出来,从而产生毒害效应。神经细胞的游离铁超载常表现为细胞代谢异常或细胞死亡,这样的铁被称为“有毒”铁。目前较多的解释是“有毒”铁通过芬顿(Fenton)反应(工业上处理废水的核心反应)产生高度活化的自由基(free radical),即以Fe2++H2O2=Fe3+·OH+OH−为核心(由于浓度、pH值等问题未能在体内直接证明[4],但有大量可靠的间接证据[5]),产生过多的以羟自由基(·OH)为主的自由基团;这些物质会引起生物膜的LPO,破坏以多不饱和脂肪酸、磷脂酰乙醇胺和花生四烯酸为主的细胞膜脂质结构,而他们是脑神经细胞重要的基本组成物质。严重的铁代谢紊乱会导致神经细胞的铁死亡,引起不同程度的脑功能异常[6]。值得注意的是,上述铁紊乱和LPO的修复过程均有Nrf2参与调控。
脑部疾病是人类致残和死亡的主要原因之一。脑铁代谢紊乱在多种脑部疾病中均有体现,其中在神经退行性疾病中最多:有学者提出“金属假说”,即包括帕金森病(Parkinson disease,PD)[7]、阿尔茨海默症(Alzheimer disease,AD)[8]、亨廷顿舞蹈病(Hun⁃tington disease,HD)[9]、肌萎缩性侧索硬化(amyo⁃trophic lateral sclerosis,ALS)[10]等在内的神经退行性疾病存在以脑铁为代表的金属元素紊乱;其次,以脑出血为特征的脑损伤性疾病如创伤性脑损伤[11]、出血性脑卒中[12]等,由于血液中含有的铁大量进入脑组织,会造成神经细胞铁代谢异常和氧化应激;此外,原发性脑肿瘤[13]、癫痫[14]、多发性硬化症[15]、抑郁症[16]、精神分裂症[17]等也均发现有不同程度的脑铁沉积。总之,上述研究提供了各种脑疾病中存在铁代谢紊乱的充分证据。基于此,Nrf2作为一个潜在的调节铁代谢和铁死亡的关键转录因子,引起了大家的关注。
2 Nrf2的结构及基本功能
Nrf2是一种碱性亮氨酸拉链(basic leucine zip⁃per,bZIP)转录因子,可与细胞核内小Maf蛋白特异性结合,共同调节1 000多种基因。正常情况下,Nrf2在胞质内结合于它的负性调节分子Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated pro⁃tein 1,Keap1)后被泛素化标记,Nrf2-Keap1复合物沿着肌动蛋白移动,被运输到26S蛋白酶体降解,从而将神经细胞胞质中的Nrf2维持在低水平。但当细胞受到大量应激时,Keap1结构上的半胱氨酸残基就结合胞内的亲电试剂,从而导致Keap1构象的改变,引起Nrf2与Keap1解离,Nrf2转移入核。在细胞核内,Nrf2与小Maf蛋白结合后小Maf蛋白被诱导,与靶基因启动子区域的抗氧化反应元件(antioxidant re⁃sponse element,ARE)相互作用,促进相关基因的转录(图1)。

Figure 1.The structure and schematic diagram of Keap1-Nrf2.Under unstressed conditions,Keap1 facilitates Nrf2 ubiquitylation,and then Nrf2 is degraded by 26Sprotease.Under conditions of oxidative or electrophilic stress,cysteine(Cys)residues on Keap1 are modified to prevent Nrf2 from degradation,and then Nrf2 accumulates and translocates to the nucleus where it is combined with the small Maf protein to promote the transcription of target genes.图1 Keap1-Nrf2结构及功能示意图
3 Nrf2在脑铁代谢中的作用及机制
研究发现,脑部疾病常常伴有铁代谢异常[18]和Nrf2含量的改变[19]。以往认为Nrf2仅参与神经细胞的抗氧化和抗炎反应,现发现它也调控众多脑铁相关蛋白的代谢活动,包括转铁蛋白受体1(transferrin receptor 1,TfR1)、铁蛋白(ferritin)、铁转运蛋白(fer⁃roportin,Fpn)、亚铁螯合酶(ferrochelatase,FECH)、ATP-binding cassette subfamily Bmember 6(ABCB6)、谷胱甘肽(glutathione,GSH)合成的关键酶、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)、硫氧还蛋白(thioredoxin,TXN)系统的酶、LPO解毒酶等,他们起到了减轻神经细胞铁负荷、缓解铁死亡进程的作用。笔者总结了Nrf2对脑铁代谢的研究,发现无论是胞内还是胞外,未能有效、及时地清理容易引起芬顿反应的“有毒”铁是脑铁代谢紊乱的直接原因。Nrf2一方面通过加速胞外、胞内“有毒”铁的转化和代谢,另一方面又辅助清除由铁紊乱引起的过氧化堆积物,从而维持脑铁的内环境稳态。下文将详述Nrf2如何调控脑铁代谢。
3.1 Nrf2促进脑铁摄入 Nrf2-ARE通过促进血脑屏障(blood-brain barrier,BBB)和神经细胞膜上TfR1的转录,加强了脑铁代谢中铁的摄入,降低细胞外游离铁的危害。一般认为在生理情况下,脑中主要通过转铁蛋白(trransferrin,Tf)与TfR1结合吸收铁。Tf是一种具有2个Fe3+高亲和力位点的糖蛋白,接受循环系统中的铁[20],TfR1是它的受体(图2)。TfR1在脑内广泛分布,尤其在BBB上高表达,在生理情况下TfR1是铁入脑的最主要通道。具有缺乏TfR1多巴胺(dopamine,DA)能神经元的小鼠出现了严重的神经元铁不足、进行性退行性变、运动活性下降及早期死亡的表现[21]。TfR1不仅在转录阶段受到Nrf2的作用[22],在翻译阶段,铁调节蛋白(iron regulatory pro⁃teins,IRPs)能结合TfR1的mRNA上3'端非翻译区,阻止其降解[23]。一方面,从Tf上脱下的Fe3+在复杂的内吞作用后改变价态[24],以Fe2+的形式大部分进入线粒体被利用,其余的可进入铁蛋白储存,或通过Fpn输出细胞;另一方面,TfR1-Tf复合物返回细胞膜[25]后二者分开,再次进入铁循环使用(图2)。
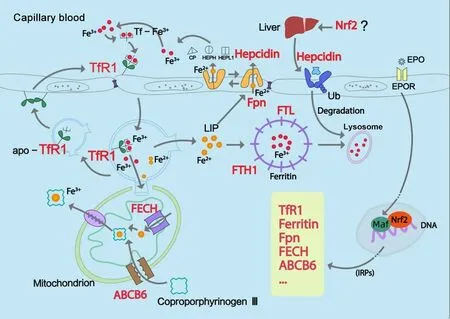
Figure 2.Diagram of iron metabolism in blood-brain barrier(BBB)regulated by Nrf2.Top left shows the loop of Tf-Fe-TfR1,the main iron absorption way in BBB.Tf-Fe3+combines with TfR1.Tf-Fe3+-TfR1 is freed and iron is exported into the cytoplasm by endocytic vesicle after reduction of the iron.A sea of Fe2+ions enter into mitochondria,while some either enter into LIP(iron in pool)or are released by Fpn.Lower left shows that cellular iron efflux is mediated by Fpn and requires iron oxida⁃tion(ceruloplasmin,hephaestin or hephaestin-like 1/zyklopen)on the extracellular side.Fpn is negatively regulated by the ubiquitination marker of hepcidin produced by liver.Top right shows EPO-EPOR-dependent phases of brain cells.The cen⁃ter of the figure depicts the way how ferritin stores and releases iron.Some iron is taken by LIP.All red markers are regu⁃lated by Nrf2.图2 Nrf2促进脑铁摄入及代谢的示意图
3.2 Nrf2促进脑铁储存 Nrf2上调铁蛋白的表达,保证了神经细胞能储存大量稳定的铁,减少不稳定游离铁的含量。神经细胞发展出一套系统用于储存那些暂不需要立即参加代谢活动的铁,这套系统主要靠的是一种缓冲物质——铁蛋白的作用。铁蛋白在生物中广泛存在,进化上高度保守[26]。铁蛋白是细胞内的主要储铁蛋白,有重链(H-ferritin,FTH1)和轻链(L-ferritin,FTL)共24条:FTH1具有铁氧化酶(ferroxidase)的活性,可以催化Fe2+到Fe3+[27];FTL则起到了促进铁储存的作用。在FTH1和FTL的共同作用下,铁蛋白能储存多达4 500个铁原子[28]。在神经细胞内,FTH1和FTL基因的上游均有ARE序列,可被Nrf2结合,发挥调控作用[29]。与TfR1一样,铁蛋白在mRNA水平也有IRPs的参与。铁蛋白对脑铁的调控至关重要,FTL的C端移码突变会导致脑内罕见的神经铁蛋白病变(neuroferritinopathy)[30]。研究发现AD、ALS和PD患者的铁蛋白含量异常升高[31],这可能是疾病引起脑铁紊乱后细胞用以缓冲铁超载的一种方式。
3.3 Nrf2减少神经细胞线粒体内游离铁含量 Nrf2通过原卟啉IX(protoporphyrin IX,PPIX)间接稳定线粒体内游离铁的含量,同时产生多种酶促反应所需的血红素。铁、线粒体与Nrf2的关系密切,其中线粒体是铁含量最高的细胞器。线粒体被认为是铁参与血红素合成的“化工厂”,因为血红素的合成完全依赖于线粒体。线粒体外膜的ABCB6和内膜的FECH都受到Nrf2的正调控,共同负责血红素在线粒体内最后阶段的合成。ABCB6把粪卟啉原III(copro⁃porphyrinogen III)从细胞质输入线粒体[32],粪卟啉原III在线粒体内发生氧化脱羧、脱氢等反应后形成PPIX;FECH本身也是含有铁硫簇的酶[33],可将Fe2+插入到PPIX中,最终生成的血红素在相应膜受体蛋白的帮助下运出线粒体(图2)。一方面,血红素作为众多氧化还原反应酶的重要组成,维持了脑细胞的正常生化代谢,另一方面,Nrf2借助PPIX螯合了过量的铁,减轻了线粒体铁负载。在体内、体外的PD模型中,tricetin作为Keap1-Nrf2的竞争抑制剂,可以诱导神经细胞Nrf2的累积,提高血红素的含量,起到一定的神经保护作用[34]。
3.4 Nrf2调控脑铁运出 在神经系统内,Nrf2调控着唯一能输出铁的蛋白——Fpn。Fpn是目前已知的唯一脑细胞输出铁的蛋白,在哺乳动物中高度保守[35]。星形胶质细胞、小胶质细胞和神经元均表达Fpn[35]。生物计算模拟出了BbFpn(Fpn的细菌同源物)的结构,其晶体结构表明Fpn有两瓣[36],中间形成一个空腔,含有铁结合位点。根据两个瓣的空间组织,中央空腔面向细胞内时接受细胞内的Fe2+,当向 细 胞 外 开 放 时 释 放Fe2+[37]。 大 脑BBB[38]和 脉 络丛[39]的铁输出也主要依靠Fpn[40]。Fpn把胞内的Fe2+运出后,Fe2+被3种不同的氧化酶——铜蓝蛋白(ce⁃ruloplasmin,CP)、hephaestin(HEPH)和zyklopen(hephaestin-like 1,HEPHL1)氧化为稳定的Fe3+(图2)。Fpn基因启动子序列中包含ARE,可以结合Nrf2。Nrf2的激活剂diethyl malate和sulforaphane可以上调小鼠巨噬细胞中Fpn的mRNA水平[41]。同样的,Fpn的mRNA在非翻译区含有5'的铁反应元件(iron response element,IRE),在缺铁条件下,IRE与IRPs结合,起到了抑制翻译的作用[42]。值得注意的是,Fpn还受到铁调素(hepcidin)的调控,后者通过介导泛素化途径降解Fpn[42],在非脑组织尤其是肝脏中,铁调素的合成与Nrf2关系密切(图2),但铁调素在脑内是否受到Nrf2调控还有待进一步研究。
3.5 Nrf2抑制神经细胞铁死亡引起的过氧化 胞内抗LPO的主要物质GSH-GPX4抗LPO轴的关键合成酶的基因都受到Nrf2的正向调控;同时,Nrf2可通过上调TXN系统来代偿GSH系统;并且许多针对铁死亡后过氧化下游产物的解毒酶也被Nrf2激活。上文提及,通过芬顿反应,持久的脑铁负荷会加重神经细胞的LPO累积,引起铁死亡。星形胶质细胞通过Nrf2来介导细胞抗过氧化物和抗氧化应激。以往大量研究表明,GSH-GPX4抗LPO轴是抵抗铁死亡的重要组成[43],而Nrf2是促进GSH生物合成关键酶(谷氨酸-半胱氨酸连接酶、GSH合成酶和SLC7A11)、还原氧化型GSH的酶(GSH还原酶)以及抗LPO关键酶GPX4[44]的基因转录[45]的重要因子。在缺血性脑损伤中,外源性褪黑素通过增加Nrf2-GPX4,可以减少神经细胞铁死亡,明显改善大鼠学习、记忆和认知能力。近期研究发现,TXN系统是防御氧化应激的关键抗氧化系统[46],由NADPH、TXN还原酶和TXN组成,在GSH系统受损或失活时TXN可能起到了抗氧化的代偿作用。在TXN系统中的TXN1和TXNRD1作为Nrf2的靶基因与铁死亡的关联已经有文献报道[47]。Nrf2还调控LPO下游产物的解毒过程[48],比如醛酮还原酶家族(AKR1C1-3)家族和乙醛脱氢酶家族(ALDH3A1)[49]等,在一定程度上能对抗神经细胞铁死亡对周围组织的毒副作用。
4 小结与展望
尽管铁代谢相关脑疾病的临床治疗和预后一直是医学界的难题,但是对Nrf2在脑铁代谢中的研究,依然可以为脑疾病的治疗提供一些借鉴,而且Nrf2对缓解神经细胞铁死亡也有直观的作用。虽然Nrf2在脑铁代谢紊乱中的作用已经被逐步认识,但还有许多问题亟待解决:一方面,Nrf2在基因转录层面指导蛋白质的从头合成,虽然作用持久,但短期内不一定能起到及时的治疗效果,同时部分脑铁代谢相关蛋白的翻译还会受到IRPs调控;另一方面,脑内其他一些不受Nrf2调控的蛋白,如乳铁蛋白(lactofer⁃rin)[49]、TfR2等,常在脑疾病的中后期被异常激活,这会加速脑铁代谢紊乱。由此可见,Nrf2可能适用于脑铁紊乱的早期预防和前期治疗,对于中晚期脑疾病并不一定有效。此外,关于Nrf2的用药:由于Nrf2激活剂靶点较多且难入BBB,常会对机体产生较大的副作用;通过刺激脑内特定靶点,如促红细胞生成素(erythropoietin,EPO)和相应受体EPOR,可激活脑细胞自主分泌Nrf2[50-51(]图2);也有用纳米载体、单克隆抗体、脂质体等靶向作用于TfR而载药入BBB[52]。但总体而言,Nrf2治疗脑代谢铁紊乱还处在试验阶段,在临床治疗上运用较少。我们对Nrf2认识的不断深入必将为脑铁代谢紊乱性疾病的治疗提供有效的策略。

