绿原酸通过ROS/TXNIP/NLRP3信号通路介导的细胞焦亡途径减轻脓毒症小鼠急性肺损伤*
何 荷, 梁隆斌△, 刘 杨, 罗 斌, 周 瑜
(1成都大学附属医院急诊科,四川成都610081;2成都市第二人民医院重症医学科,四川成都610017)
脓毒症是因宿主对感染的反应失调,从而引发多器官功能障碍,严重危及患者生命[1]。脓毒症可诱发全身炎症反应,导致急性肺损伤[2],具有很高的死亡率,目前对于该症状仍没有较好的治疗策略。绿原酸(chlorogenic acid,CGA)广泛存在于植物中,具有抗炎、抗菌和清除自由基等作用,Zhang等[3]研究显示绿原酸可抑制氧化应激和炎症反应,从而减轻应激型鸡小肠损伤。Chen等[4]研究显示,绿原酸可提高机体抗氧化能力。而NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症复合体不仅促进多种炎症因子的释放,还会诱导细胞焦亡这一具有炎症特性的细胞死亡方式[5]。Hao等[6]研究报道,NLRP3炎症复合体在脓毒症的发展过程中起重要促进作用。但是,绿原酸对脓毒症肺损伤及活性氧(reactive oxygen species,ROS)/硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)/NLRP3信号通路介导的细胞焦亡途径的影响尚未见报道。因此,本研究基于绿原酸的效用和脓毒症急性肺损伤的诱因,拟构建脓毒症小鼠急性肺损伤模型,用以探究绿原酸对脓毒症小鼠急性肺损伤的作用及潜在机制。
材料和方法
1 材料
1.1 实验动物 72只健康清洁级雄性BALB/c小鼠,6~8周龄,体质量(21±3)g,购自广东省医学实验动物中心,动物生产许可证号为SCXK(粤)2018-0002,动物使用许可证号为SYXK(粤)2018-0002,动物质量合格证号为GD202040573,实验遵循3R保护原则,本研究经成都大学附属医院伦理委员会批准,批准号为FLD201911-03。
1.2 主要药物、试剂和仪器 地塞米松注射液(国药集团荣生制药有限公司);注射用绿原酸(四川九章生物科技有限公司);小鼠白细胞介素1β(interleu⁃kin-1β,IL-1β)ELISA检测试剂盒、小鼠IL-6 ELISA检测试剂盒、小鼠肿瘤坏死因子α(tumor necrosis fac⁃tir-α,TNF-α)ELISA试剂盒及小鼠ROS试剂盒(上海酶联生物科技有限公司);苏木素-伊红(HE)染色试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(西格玛奥德里奇上海贸易有限公司);TU⁃NEL细胞凋亡检测试剂盒(武汉博士德生物工程有限公司);兔抗小鼠TXNIP抗体、兔抗小鼠NLRP3抗体、兔抗小鼠胱天蛋白酶1(caspase-1)抗体、兔抗小鼠细胞焦亡关键蛋白gasdermin D的N末端片段(N-terminal fragment of gasdermin D,GSDMD-N)抗体和羊抗小鼠IgGⅡ抗(艾博抗上海贸易有限公司)。酶标仪(上海胜卫电子科技有限公司);凝胶成像系统(南京世研仪器设备有限公司)。
2 方法
2.1 实验分组及动物模型制备 采用腹腔注射脂多糖(10 mg/kg)的方法制备脓毒症急性肺损伤小鼠模型[7],当出现小鼠活动和进食明显减少,口鼻分泌物增多,寒战、腹泻、呼吸窘迫等现象,即视为造模成功。本实验成功制造模模型小鼠60只,随机分为5组(每组12只):模型组、阳性对照组、绿原酸低、中、高剂量组。另取12只小鼠腹腔注射等量生理盐水设为对照组。造模成功后,阳性对照组小鼠腹腔注射50µg/kg地塞米松[8];绿原酸低、中、高剂量组小鼠腹腔分别注射5 mg/kg、10 mg/kg和20 mg/kg绿原酸[9];药物注射体积均为10 mL/kg,对照组和模型组注射等量(10 mL/kg)的生理盐水。给药8 h后采集所需样本。
2.2 ELISA检测肺泡灌洗液中IL-1β、IL-6和TNF-α含量 处死小鼠,仰卧位固定于实验台,打开胸腔暴露心脏,结扎右肺门后将右肺切下,置于冰上待用。于小鼠颈部解剖暴露气管,将静脉留置针插入左主支气管,注射器抽取300µL 37℃预热的灭菌生理盐水,通过留置针注入小鼠左肺,这时左肺膨起并变白,对其轻柔按摩后,注射器回吸灌洗液,注入、回吸重复3次,收集灌洗液。注射器重新抽取灭菌生理盐水进行灌洗,灌洗重复2次,最终收集肺泡灌洗液450µL。通过无菌医用纱布过滤灌洗液后,12 000×g离心10 min,吸取上清并按试剂盒说明书进行IL-1β、IL-6和TNF-α含量的检测。
2.3 肺泡灌洗液中炎症细胞数量 取2.2中肺泡灌洗液离心后的沉淀,加入冰醋酸溶破红细胞后用1.8 mL生理盐水重悬细胞,显微镜下计数。
2.4 肺组织湿重(wet weight,W)/干重(dry weight,D)比值 分离的右肺取下叶,用滤纸拭干,置于精密电子天平称量肺组织湿重,记为W;随后将其放入烘箱中70℃烘烤至重量不变,称量肺组织干重,记为D,计算W/D比值。
2.5 肺组织HE染色 取约0.5 cm×0.3 cm×1 cm大小的右肺叶上叶组织,浸于4%多聚甲醛中12 h,捞出固定好的组织经PBS冲洗,梯度乙醇进行组织脱水,液态石蜡包埋,行4µm切片,载玻片捞片后烘烤2 h。随后二甲苯、乙醇处理脱蜡,苏木素浸染,1%盐酸乙醇分化,伊红浸染,再次进行梯度乙醇脱水,二甲苯透明,最后采用中性树胶封片。显微镜下观察肺组织病理学变化。
2.6 肺组织TUNEL染色 取肺组织石蜡切片,滴加蛋白酶K溶液37℃孵育20 min,PBS洗涤;滴加TUNEL溶液37℃孵育1 h,PBS洗涤后观察凋亡细胞情况;再滴加converter-POD溶液37℃孵育30 min,PBS洗涤后进行显色,镜下观察。苏木素复染,分化、返蓝处理后梯度乙醇脱水,透明、封片,光镜下观察。阳性细胞(凋亡细胞)呈现棕黄色,正常细胞呈现蓝色。凋亡率(%)=阳性细胞数/总细胞数×100%。
2.7 肺组织中SOD、MDA和ROS水平检测 取100 mg右肺组织剪碎,与900µL生理盐水一起加入匀浆器,得到的组织匀浆在4℃条件下12 000×g离心15 min,收取上清通过各个试剂盒检测肺组织中SOD、MDA和ROS水平。
2.8 Western blot法检测TXNIP、NLRP3、caspase-1和GSDMD-N蛋白的表达 取组织匀浆上清进行蛋白定量,取50µg蛋白与4倍体积的上样缓冲液混匀,10 min沸水浴后上样进行电泳,电泳结束取凝胶与滤纸、PVDF膜叠放并进行蛋白转膜,转好的PVDF膜经5%脱脂奶粉溶液封闭,加入Ⅰ抗(TXNIP抗体、NLRP3抗体、caspase-1抗体、GSDMDN抗体;均为1∶1 000稀释)孵育,洗涤后加入羊抗小鼠IgGⅡ抗(1∶3 000稀释)孵育,洗涤显色,凝胶成像系统拍照,ImageJ系统分析图片。
3 统计学处理
SPSS22.0系统分析数据,计量资料表现形式为均数±标准差(mean±SD),多组间比较采用单因素方差分析,进一步两组间比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 肺泡灌洗液中IL-1β、IL-6和TNF-α含量
相较于对照组,模型组IL-1β、IL-6和TNF-α含量显著升高(P<0.05);相较于模型组,绿原酸低、中、高剂量组IL-1β、IL-6和TNF-α含量显著降低(P<0.05);绿原酸高剂量组与阳性对照组差异不显著(P>0.05),见表1。

表1 肺泡灌洗液中IL-1β、IL-6和TNF-α含量Table 1.The content of IL-1β,IL-6 and TNF-αin bronchoalveolar lavage fluid(ng/L.Mean±SD.n=12)
2 肺组织病理学变化及炎症细胞数量
对照组肺组织结构正常;相较于对照组,模型组肺泡间隔增厚,肺泡内及肺泡间质水肿,甚至部分肺泡塌陷,并且出现大量炎症细胞浸润,BALF中炎症细胞数量显著增加(P<0.05);相较于模型组,绿原酸低、中、高剂量组肺泡间隔增厚及水肿情况有所减轻,BALF中炎症细胞数量显著减少(P<0.05);绿原酸高剂量组与阳性对照组肺组织病理学改变差异不明显,BALF中炎症细胞数量差异无统计学意义(P>0.05)。见图1、表2。

表2 肺泡灌洗液中炎症细胞数量Table 2.Number of inflammatory cells in bronchoalveolar la⁃vage fluid(×107/L.Mean±SD.n=12)
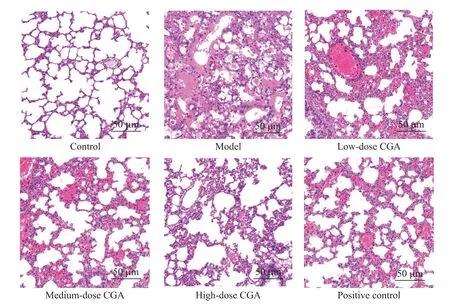
Figure 1.Pathological changesof lung tissue(HEstaining).图1 肺组织病理学变化
3 肺组织湿重/干重比
相较于对照组,模型组W/D比值显著升高(P<0.05);相较于模型组,绿原酸低、中、高剂量组W/D比值显著降低(P<0.05);绿原酸高剂量组与阳性对照组差异不显著(P>0.05)。见表3。
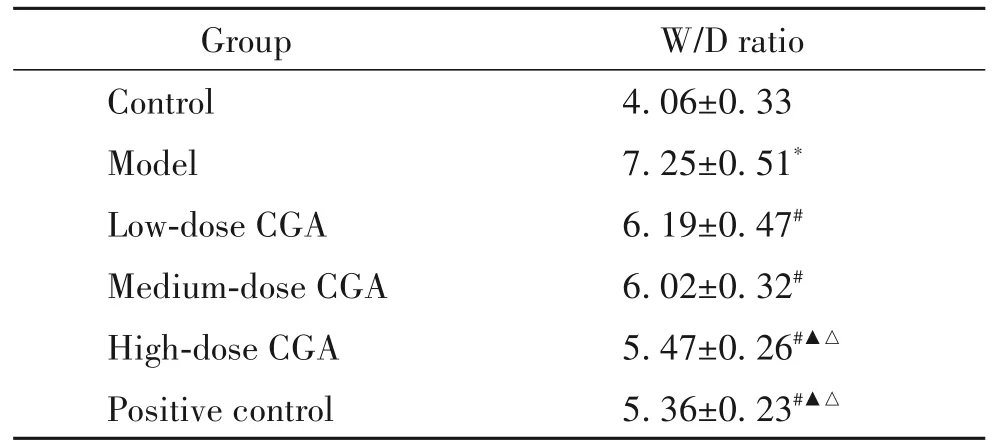
表3 小鼠肺组织湿重/干重比Table 3.The wet weight/dry weight(W/D)ratio of lung tissue in mice(Mean±SD.n=12)
4 肺组织细胞凋亡
相较于对照组,模型组肺组织凋亡细胞数增多,凋亡率显著上升(P<0.05);相较于模型组,绿原酸低、中、高剂量组凋亡细胞数减少,凋亡率显著下降(P<0.05);绿原酸高剂量组与阳性对照组肺组织细胞凋亡率差异无统计学意义(P>0.05)。见图2、表4。
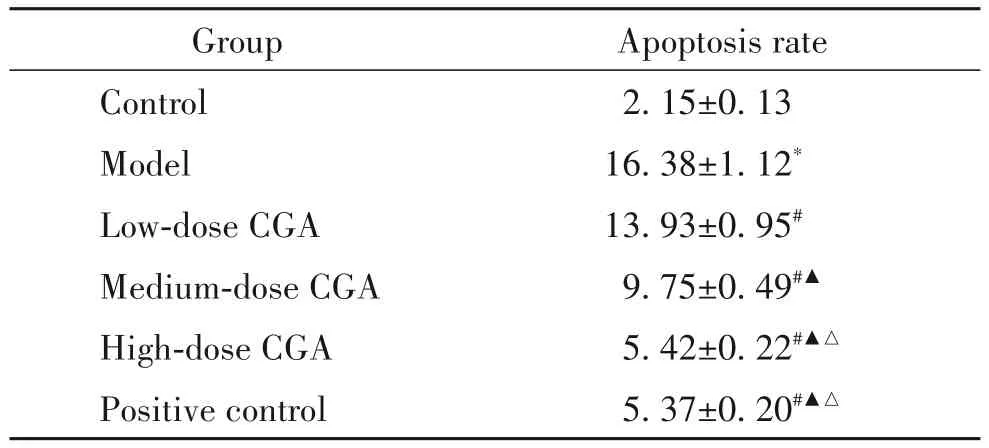
表4 肺组织细胞凋亡率比较Table 4.Comparison of apoptosis rate in lung tissue(%.Mean±SD.n=12)
5 肺组织中SOD、MDA和ROS水平
相较于对照组,模型组SOD水平显著降低,MDA和ROS水平显著升高(P<0.05);相较于模型组,绿原酸低、中、高剂量组SOD水平显著升高,MDA和ROS水平显著降低(P<0.05);绿原酸高剂量组和阳性对照组肺组织中SOD、MDA和ROS水平差异无统计学意义(P>0.05)。见表5。
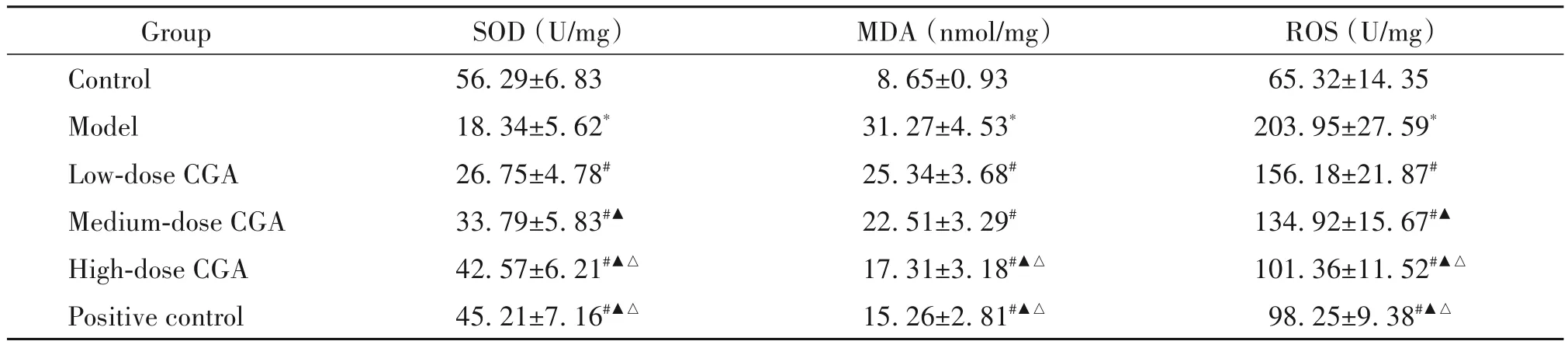
表5 肺组织中SOD、MDA和ROS水平Table 5.Levels of SOD,MDA and ROSin lung tissues(Mean±SD.n=12)
6 肺组织TXNIP、NLRP3、caspase-1和GSDMD-N蛋白水平
相较于对照组,模型组TXNIP、NLRP3、caspase-1和GSDMD-N蛋白水平显著上升(P<0.05);相较于模型组,绿原酸低、中、高剂量组TXNIP、NLRP3、cas⁃pase-1和GSDMD-N蛋白水平显著下降(P<0.05);绿原酸高剂量组和阳性对照组肺组织TXNIP、NLRP3、caspase-1和GSDMD-N蛋白水平差异无统计学意义(P>0.05)。见图3、表6。

表6 肺组织TXNIP、NLRP3、caspase-1和GSDMD-N的蛋白水平Table 6.The protein levels of TXNIP,NLRP3,caspase-1 and GSDMD-Nin lung tissue(Mean±SD.n=12)
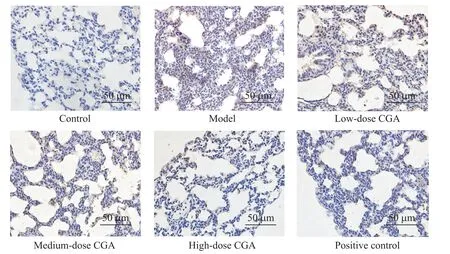
Figure 2.Apoptosis in lung tissue(TUNEL staining).图2 肺组织细胞凋亡(TUNEL染色)
讨 论
脓毒症可造成机体多个器官急性损伤,通常肺脏最先受累,脓毒症诱发的全身炎症反应可导致肺泡上皮细胞严重受损,并且发生炎症细胞浸润,最终引起肺水肿以及肺功能障碍[10-11]。另外,脓毒症也可诱导氧化应激,使得机体大量合成ROS,导致氧化/抗氧化稳态失调,引起细胞凋亡[12-13]。本研究观察到模型组小鼠肺组织出现肺泡间隔增厚,大量炎症细胞浸润等脓毒症急性肺损伤病理变化,伴随IL-1β、IL-6和TNF-α含量、W/D比值、细胞凋亡率及MDA和ROS水平显著升高,SOD水平显著降低,提示了本研究模型建立成功,可用于后续对于绿原酸作用的研究。
绿原酸具有抗炎、抗氧化、抗菌、抗病毒、抗肿瘤和降糖降脂等生物学功能,本研究结果显示,相较于模型组,低、中、高剂量绿原酸均可减轻肺组织损伤,降低IL-1β、IL-6、TNF-α、MDA、ROS含量和W/D比值,减少肺组织细胞凋亡,而显著升高SOD水平。Song等[14]报道,绿原酸可清除并抑制ROS,提供有效的抗氧化应激防御。Kim等[15]在乙醇诱导的肝损伤小鼠中显示,绿原酸可降低细胞凋亡和氧化应激水平,发挥保护作用。本研究表明绿原酸在脓毒症急性肺损伤中也可发挥抑炎和抗氧化损伤作用。另外,通过抑制促炎介质TNF-α、IL-6水平和氧化应激反应,可缓解脓毒症急性肺损伤小鼠肺、肝损伤及肺水肿程度,恢复其体内免疫平衡,提高小鼠的存活率[16]。我们的研究提示,绿原酸对脓毒症急性肺损伤小鼠的保护作用与提高其抗氧化能力,缓解炎症反应有关。另外,绿原酸调解炎症、氧化应激和细胞凋亡的机制可能与抑制NF-κB通路的激活及炎症因子、Bax等凋亡蛋白的表达有关[17]。我们推测,绿原酸可有效抑制促炎、促氧化因子等表达而促进抗氧化因子活性,从而调节炎症和氧化应激反应,缓解脓毒症急性肺损伤小鼠的病变,但其调节机制仍待探究。
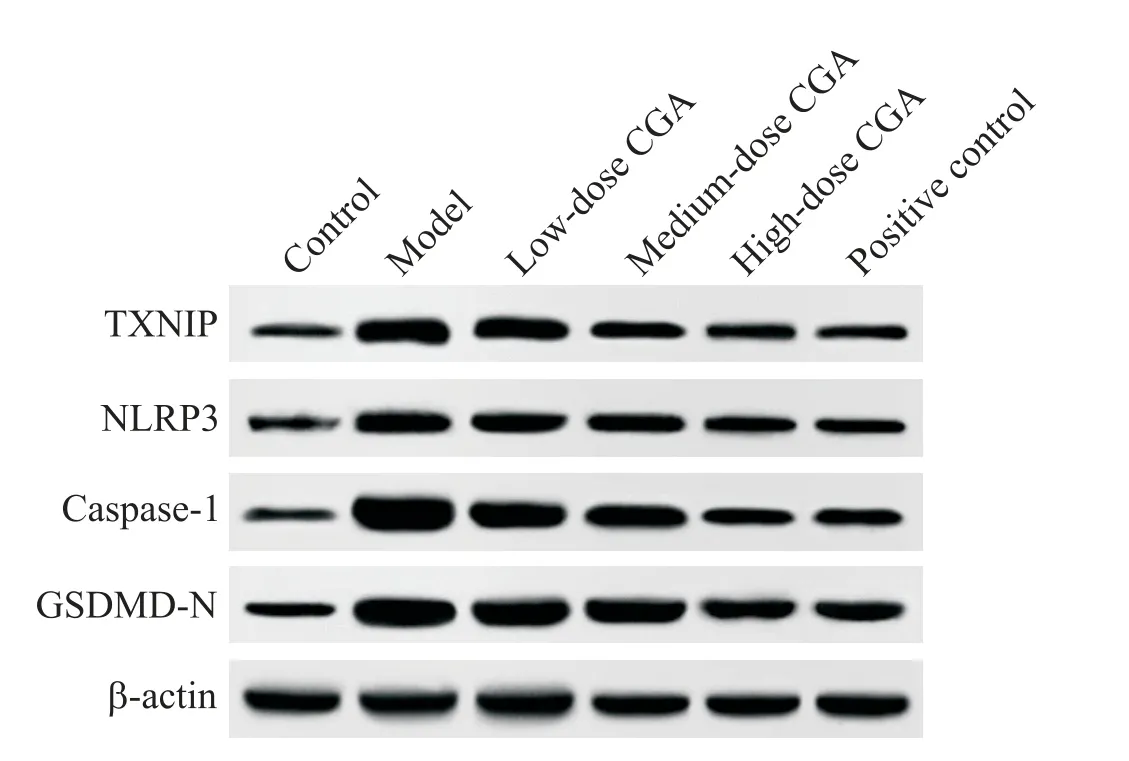
Figure 3.The protein levels of TXNIP,NLRP3,caspase-1 and GSDMD-Nin lung tissues.图3 肺组织TXNIP、NLRP3、caspase-1和GSDMD-N的蛋白水平
本研究结果显示,与对照组相比,模型组肺组织ROS水平以及TXNIP、NLRP3、caspase-1和GSDMD-N蛋白表达显著上升,绿原酸干预后,ROS水平及上述蛋白表达均显著下降。脓毒症发生时,可诱导ROS的大量合成,促使TXNIP与硫氧还原蛋白解离,TXNIP再与NLRP3结合,激活NLRP3,以NLRP3为代表的炎性小体则进一步切割活化caspase-1,活化的caspase-1不仅可以促进多个炎症因子的产生,还可以切割GSDMD的N端结构域,介导细胞焦亡。已有研究显示,抑制NLRP3/caspase-1/GSDMD通路,可抑制细胞焦亡的发生[18]。Wang等[19]研究显示,在脓毒症急性肺损伤小鼠肺组织中存在NLRP3炎性小体的激活,且细胞焦亡程度较高,是导致肺组织炎性浸润等损伤的原因。目前,抑制NLRP3炎症小体的激活是多种药物治疗脓毒症急性肺损伤的作用靶点。Lee等[20]指出,NLRP3炎症小体介导的细胞焦亡参与了急性肺损伤等肺部炎症类疾病的发生。本研究推测,绿原酸可能通过抑制ROS/TXNIP/NLRP3信号通路的表达,抑制肺组织细胞焦亡,进而减轻脓毒症急性肺损伤。
综上所述,绿原酸可能通过下调ROS/TXNIP/NLRP3信号通路的表达,减轻氧化应激反应,降低炎症因子的表达,抑制细胞焦亡。但是,绿原酸对脓毒症急性肺损伤的作用及机制较为复杂,尚需后续进一步探究。

