卡络磺钠通过抑制parkin介导的线粒体自噬减轻脓毒症大鼠的肺损伤*
王佳兴, 付鹤鹏, 王蓓蕾, 于井刚, 刘向迪, 刘莹莹, 徐 成, 张玉想△
(1解放军总医院第八医学中心重症医学科,北京100091;2沧州市中西医结合医院重症医学科,河北沧州061001)
脓毒症的病理生理特征是感染引起宿主体内失控性的炎症反应,这导致机体内组织和器官功能损伤,严重可进展为多脏器功能衰竭[1]。急性肺损伤和急性呼吸窘迫综合征是脓毒症的并发症之一[2]。但目前对脓毒症肺损伤的机制和治疗方法仍不十分明确。
线粒体自噬可以清除细胞内受损线粒体,是线粒体动态平衡的重要保护机制[3-4]。然而,线粒体自噬的过度激活则会加重线粒体损伤,加速细胞衰亡[5]。Pink1(PTEN-induced putative kinase 1)/parkin通路是线粒体自噬的经典通路之一。已有研究证实,parkin参与了脓毒症肺损伤的形成,抑制parkin的过度表达则可减轻脓毒症引起的肺损伤[6-7]。
卡络磺钠(carbazochrome sodium sulfonate,Car)是一种肾上腺色素缩氨脲与磺酸钠的复合物,其主要是通过提高毛细血管壁的弹性而降低血管通透性,增强血管损伤部位的回缩能力而减少出血或止血[8]。既往研究显示,卡络磺钠可以降低大鼠肺血管通透性,减轻大鼠放射性肺损伤[9]。本研究通过建立盲肠结扎穿孔(cecal ligation and puncture,CLP)脓毒症大鼠模型,观察卡络磺钠对脓毒症大鼠生存率、肺影像学、肺组织病理学、肺血管通透性及肺组织凋亡和线粒体自噬水平的影响,探讨其可能机制,为脓毒症肺损伤的救治提供参考资料。
材料和方法
1 材料
清洁级8周龄雄性Wistar大鼠115只,体重220~240 g,由斯贝福(北京)生物技术有限公司提供,许可证号为SYXK(军)2012-0016。注射用卡络磺钠(武汉华龙生物制药有限公司,每支20 mg);伊文思蓝(Evans blue,EB;Sigma);TUNEL试剂盒(Roche);兔抗大鼠parkin多克隆抗体和小鼠抗大鼠Tom20单克隆抗体(Abcam);兔抗大鼠微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)和GADPH多克隆抗体(CST);辣根过氧化物酶标记的山羊抗兔多克隆抗体(北京中衫生物技术有限公司);其他试剂均为国产分析纯。Micro-CT系统(Sie⁃mens);DM4000 B光学显微镜(Leica);Spot On图像采集处理系统(Nikon);凝胶成像系统(Bio-Rad)。
2 方法
2.1 脓毒症大鼠模型制备 按照Hubbard等[10]报道的方法行大鼠CLP,复制严重腹腔感染致脓毒症模型。动物术前称重、编号,并禁食12 h,自由饮水。3%戊巴比妥(40 mg/kg)进行腹腔注射麻醉。大鼠麻醉后固定,沿腹中线做一长约15 cm的切口,逐层切开,暴露直肠并小心游离其盲端,在距盲端1 cm处结扎,用18号针头贯穿2次,挤出少量肠内容物,并留置一条2 mm宽的橡皮条贯通盲肠,防止针孔闭合。然后将盲肠小心移入腹腔,逐层缝合腹壁切口。术后动物可自由活动和饮水。假手术组只开腹翻动肠管后关腹,不结扎和穿孔盲肠。
2.2 实验动物分组 将雄性Wistar大鼠随机分为5组:假手术组、脓毒症组、卡络磺钠低剂量(8 mg/kg)组、卡络磺钠中剂量(40 mg/kg)组和卡络磺钠高剂量(80 mg/kg)组,每组23只大鼠,其中每组15只大鼠用于生存率研究,其余8只大鼠用于术后24 h研究。实验过程均经解放军总医院第八医学中心实验动物管理委员会批准。假手术组除不结扎盲肠及盲肠穿孔外,余同脓毒症组。卡络磺钠低、中、高剂量组大鼠分别于术后即刻、8 h和16 h用不同剂量的注射用卡络磺钠(8、40和80 mg/kg,腹腔内注射)干预。脓毒症组大鼠于同时点腹腔注射等体积生理盐水。
2.3 大鼠72 h生存率的观察 每组随机取15只大鼠,术后分别于6、12、24、36、48和72 h观察其生存情况并记录,计算各组生存率。
2.4 大鼠肺部Micro-CT检测 术后24 h,采用异氟烷吸入将大鼠麻醉,利用Micro-CT仪记录大鼠肺部的影像学,测量参数:摄片时间120 s,电压90 kV,电流160µA,照片像素为40µm。
2.5 大鼠肺组织病理学观察 剪取右肺下叶组织小块,浸入4%多聚甲醛内固定,梯度乙醇脱水,常规石蜡包埋、切片(5µm),苏木精-伊红(hematoxylineosin,HE)染色,光镜下观察肺组织病理学变化。在DM4000 B光学显微镜(×200)下随机选取10个视野,参照Hong等[11]标准进行肺组织病理损伤评分。评分项目包括肺泡腔充血、中性粒细胞浸润、纤维蛋白渗出和肺泡间隔增宽,每项的评分按损伤程度分为0、1、2和3分,分别为无损伤、轻度损伤、中度和重度损伤,取其平均值。
2.6 大鼠肺血管通透性测定 采用EB染料渗出技术[12]。溶于生理盐水的EB,以2 mL/kg从大鼠尾静脉注射。然后用磷酸盐缓冲液(phosphate-buffered saline,PBS)10 mL冲洗肺循环。取右下肺叶约0.2 g,浸泡在2 mL甲酰胺溶液中(10 mL/kg),然后与甲酰胺在60℃的条件下共孵育16 h,待肺组织中色素全部萃取出,取出组织,7 000×g离心10 min后取上清液,测量吸光度(A),并计算组织中的EB含量。
2.7 TUNEL法测定凋亡 大鼠肺组织石蜡切片经过梯度乙醇脱蜡,脱水后,吹干,PBS清洗3次,封闭液室温封闭1 h。以3%的H2O2阻断内源性过氧化物酶10 min后,PBS清洗2次。按照TUNEL试剂盒说明要求,进行TUNEL染色和DAPI染色,应用荧光显微镜(Nikon)观察肺组织中细胞凋亡情况。绿色荧光为凋亡细胞,蓝色荧光为细胞核。每张切片显微镜下随机选取5个视野,计算各组肺组织细胞凋亡指数。
2.8 Western blot测定大鼠肺组织中parkin和LC3的蛋白含量 100µg大鼠左肺组织裂解液进行SDSPAGE,转膜,脱脂奶粉封闭。Ⅰ抗为兔抗大鼠parkin(1∶1 000)和LC3(1∶800)多克隆抗体。Ⅱ抗为辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000),增强化学发光法显色。以GADPH作内参照。以特异性蛋白条带光密度值与对应GADPH蛋白条带光密度值间的比值对相关蛋白表达量进行半定量分析。
2.9 免疫荧光检测 大鼠肺组织石蜡切片经过梯度乙醇脱蜡,脱水后,吹干,PBS清洗3次,1‰Triton-X-100与2%羊血清混合室温封闭1 h。PBS清洗后,加入Ⅰ抗[兔抗大鼠多克隆抗体:Tom20(1∶100)、parkin(1∶50)或LC3(1∶50)],4℃孵育过夜。清洗Ⅰ抗后,加入山羊抗兔荧光Ⅱ抗(DyLight 594,1∶500)或山羊抗小鼠荧光Ⅱ抗(DyLight 488,1∶500)后,室温孵育30 min。PBS清洗后,DAPI染细胞核。应用荧光显微镜(Nikon)观察Tom20、parkin和LC3在肺组织中的表达情况。
3 统计学处理
采用SPSS17.0软件进行统计分析。数据均采用均数±标准差(meann±SD)表示。多组之间比较采用单因素方差分析,多重比较用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 卡络磺钠对脓毒症大鼠生存率的影响
与脓毒症大鼠相比,所有卡络磺钠组大鼠的生存率均显著升高(P<0.05);与低剂量组相比,中剂量和高剂量卡络磺钠组大鼠的生存率也显著升高(P<0.05);而中剂量和高剂量之间的大鼠生存率无显著差异(P>0.05),见图1。
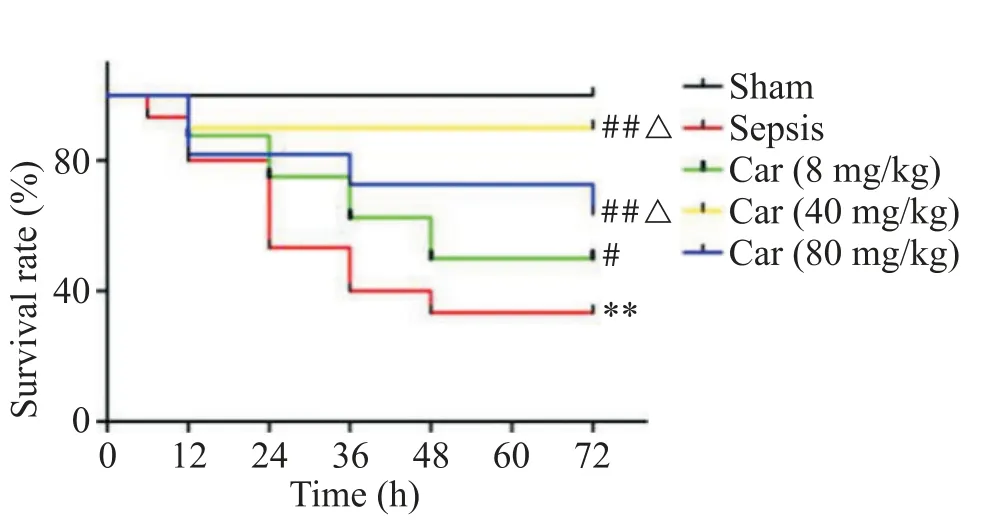
Figure 1.Carbazochrome sodium sulfonate(Car)increased the survival rate of the septic rats.Mean±SD.n=15.**P<0.01 vs sham group;#P<0.05,##P<0.01 vs sepsis group;△P<0.05 vs Car(8 mg/kg)group.图1 卡络磺钠提高脓毒症大鼠生存率
2 卡络磺钠对脓毒症大鼠肺影像学的影响
大鼠肺Micro-CT结果显示,脓毒症大鼠双肺可见斑片状渗出,严重可发生肺不张和肺实变(图2B红色箭头所示)。给予卡络磺钠干预后,大鼠双肺的斑片渗出显著减少,未见明显的肺不张和肺实变;且随着药物剂量的增加,大鼠肺部炎症表现逐步减轻,见图2C~E。
3 卡络磺钠对脓毒症大鼠肺血管通透性的影响
如图3所示,与假手术组相比,脓毒症大鼠肺血管通透性显著增加(P<0.05);低剂量、中剂量和高剂量卡络磺钠组大鼠的肺血管通透性均低于脓毒症组(P<0.05);中、高剂量组大鼠的肺血管通透性较低剂量组均进一步降低(P<0.05)。
4 卡络磺钠减轻脓毒症引起的大鼠肺组织学改变
HE染色结果显示,假手术组大鼠肺组织肺泡壁光滑,肺泡腔无渗出且结构清晰完整,见图4A;脓毒症组大鼠肺组织肺泡腔出现大量红细胞、炎症细胞和血浆样物质渗出,肺泡间隔和肺泡壁明显增厚不均,部分肺泡腔塌陷(图4B),肺病理评分明显增加;低剂量组、中剂量组及高剂量组大鼠肺部均呈一定程度的组织水肿和炎症浸润,但严重程度均不及脓毒症组,各组肺病理评分均低于脓毒症组,中剂量组及高剂量组大鼠肺组织炎症改变程度和肺病理评分较低剂量组进一步降低,见图4C~E。
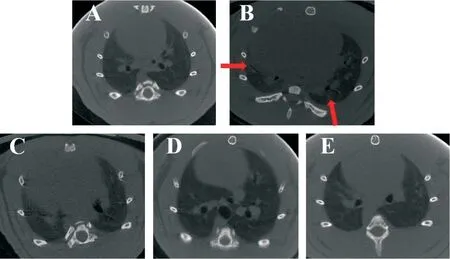
Figure 2.Carbazochrome sodium sulfonate(Car)alleviated the effusion and consolidation in the lung of septic rats.A:sham group;B:sepsis group,the lung of septic rats had presented the effusion and consolidation(red arrow),as evidenced by CT scanning;C:Car(8 mg/kg)group;D:Car(40 mg/kg)group);E:Car(80 mg/kg)group.图2 卡络磺钠减轻脓毒症大鼠肺渗出和肺不张
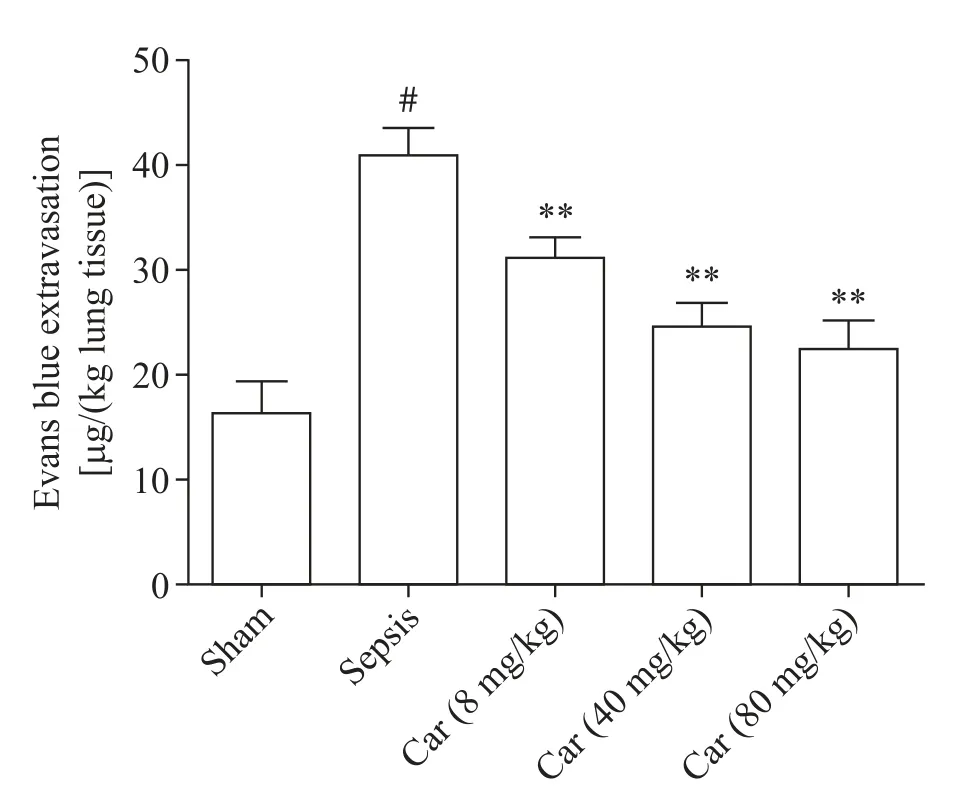
Figure 3.Carbazochrome sodium sulfonate(Car)decreased the pulmonary vascular permeability in septic rats.Mean±SD.n=8.#P<0.05 sham grouup;**P<0.01 vs sepsis group.图3 卡络磺钠对脓毒症大鼠肺血管通透性的影响
5 卡络磺钠对脓毒症大鼠肺组织凋亡的影响
如图5所示,与假手术组相比,脓毒症大鼠肺组织的凋亡指数显著升高(P<0.01);卡络磺钠低剂量、中剂量和高剂量组大鼠肺组织的凋亡指数均低于脓毒症组,且中、高剂量组大鼠肺组织的凋亡指数较低剂量组进一步降低(P<0.01)。
6 卡络磺钠对脓毒症大鼠的肺组织中parkin和LC3表达的影响
如图6所示,与假手术组相比,脓毒症大鼠肺组织中parkin的表达显著增多(P<0.05),自噬水平标志物LC3-II/LC3-I比值显著升高(P<0.05);卡络磺钠组大鼠肺组织中parkin表达及LC3-II/LC3-I比值与脓毒症组相比均显著降低(P<0.05),且上述改变具有药物浓度依赖趋势。
7 卡络磺钠对脓毒症大鼠肺组织中线粒体自噬水平的影响
免疫荧光结果显示,假手术组大鼠肺组织parkin荧光强度较弱(红色荧光),parkin与Tom20(线粒体外膜标志物)共染荧光(黄色荧光)也较弱;脓毒症大鼠肺组织parkin荧光及parkin与Tom20共染荧光较假手术组均显著增强;而与脓毒症大鼠相比,卡络磺钠干预组大鼠肺组织的parkin荧光强度及parkin与Tom20共染荧光强度均减弱,这种变化呈一定的剂量依赖性,见图7A。此外,假手术组大鼠肺组织LC3荧光强度较弱(红色荧光),LC3与Tom20共染荧光(黄色荧光)也较弱;脓毒症大鼠肺组织LC3荧光及LC3与Tom20共染荧光较假手术组均显著增强;而与脓毒症大鼠相比,卡络磺钠干预组大鼠肺组织的LC3荧光强度及LC3与Tom20共染荧光强度均明显减弱,这种变化呈一定的剂量依赖性,见图7B。
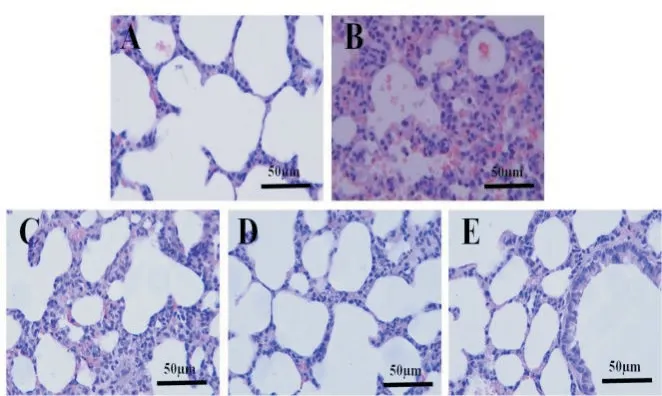
Figure 4.Carbazochrome sodium sulfonate(Car)alleviated the pathological injury in lung tissues of the septic rats(HE staining,scale bar=50µm).A:sham group;B:sepsis group;C:Car(8 mg/kg)group;D:Car(40 mg/kg)group;E:Car(80 mg/kg)group.Mean±SD.n=8.#P<0.05 vs shamgroup;**P<0.01 vs sepsisgroup.图4 卡络磺钠减轻脓毒症大鼠肺组织的病理损伤
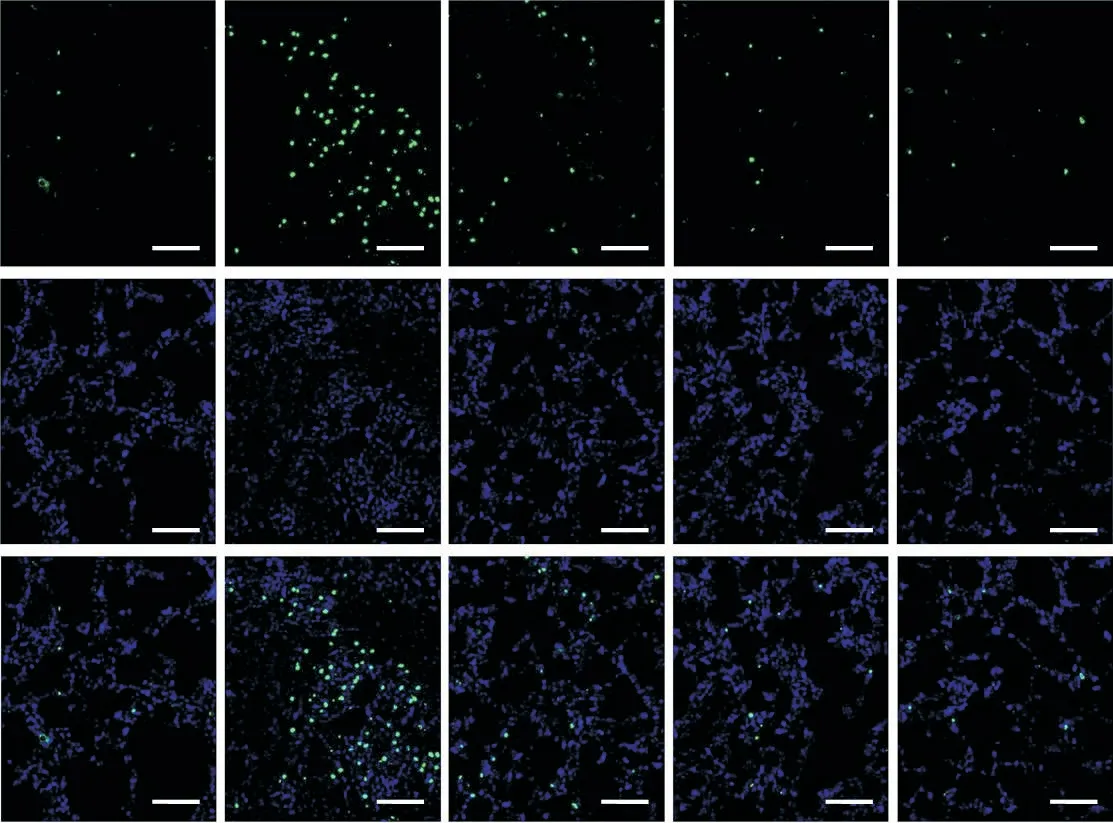
Figure 5.Carbazochrome sodium sulfonate(Car)reduced sepsis-induced apoptosis in the lung tissue of rats(TUNEL staining,scale bar=100µm).Mean±SD.n=8.##P<0.01 vs sham group;**P<0.01 vs sepsis group.图5 卡络磺钠对脓毒症大鼠肺组织凋亡的影响

Figure 6.Carbazochrome sodium sulfonate(Car)increased the autophagic level in lung tissue of the septic rats.The expression of parkin and LC3 in the lung tissue of rats in each group was detected by Western blot.Mean±SD.n=8.##P<0.01 vs sham group;**P<0.01 vs sepsisgroup.图6 卡络磺钠对脓毒症大鼠肺组织中线粒体自噬相关分子的影响
讨 论
本研究表明,卡络磺钠可以提高脓毒症大鼠的生存率,证实了卡络磺钠对脓毒症具有保护作用,且具有剂量依赖性。进一步研究结果显示,卡络磺钠可以减轻脓毒症大鼠肺损伤时出现的肺毛细血管渗漏,改善脓毒症大鼠急性肺损伤的病理特征性改变、减少细胞凋亡。由此可见在CLP致脓毒症模型,卡络磺钠可以对急性肺损伤产生保护作用,且该保护作用具有一定的剂量依赖性。
卡络磺钠是一种毛细血管稳定剂,已被广泛用于毛细血管脆弱性引发的出血的治疗。在一个成人呼吸窘迫综合征的实验模型中,卡络磺钠已经被报道可以降低肺血管通透性的增加以及减少由于碘克沙酸诱导而导致的动脉氧分压的降低[9]。我们的研究结果与上述研究相一致,卡络磺钠降低了脓毒症引起的肺血管高通透性,改善了肺的氧合功能。除肺组织外,卡络磺钠被证实同样可以减轻膀胱、前列腺、盆腔、关节腔等器官或组织发生病变时的血管高通透性,从而达到保护器官功能的作用[13-16]。创伤、感染和应激等因素打击机体时,机体内可产生大量血管活性物质,比如凝血酶,缓激肽和组胺等,引起血管内皮细胞中的磷脂酰肌醇水解和蛋白激酶C(protein kinase C,PKC)活化,进一步激活细胞内的三磷酸肌醇(inositol triphosphate,IP3)受体而造成细胞内钙离子浓度升高和钙黏蛋白的降解,最终导致内皮细胞间隙形成、血管通透性增加。而卡络磺钠可以抑制磷酸肌醇的水解,抑制细胞内钙离子浓度的升高和PKC激活,从而降低血管内皮通透性,减轻肺水肿的形成[17]。
线粒体自噬在维持线粒体稳态中发挥着重要作用[18]。研究证实,通过线粒体自噬清除损伤线粒体,可以减少活性氧簇(reactive oxygen species,ROS)产生,减轻肺损伤的发生[19]。然而,线粒体自噬程度过强反而对机体有害,降低线粒体自噬可以减轻肺损伤[20]。我们的研究同样发现,CLP脓毒症大鼠肺组织中LC3-II/LC3-I比值升高,LC3与线粒体共定位增强,提示脓毒症引起肺组织线粒体自噬水平增强。该发现预示线粒体自噬过度增强可能并没有维持正常的线粒体功能和细胞稳态,反而促使了脓毒症肺损伤的发生。这与既往研究相一致[7,20]。而卡络磺钠干预后,脓毒症大鼠肺组织中自噬水平,尤其线粒体自噬强度,均明显下降,且呈一定的浓度依赖性。因此我们的研究证实卡络磺钠可以降低脓毒症大鼠肺组织中的线粒体自噬水平,抑制线粒体自噬过度激活,从而维持肺上皮中线粒体的功能,减轻脓毒症肺损伤。

Figure 7.Carbazochrome sodium sulfonate(Car)inhibited parkin-mediated mitophagy pathway in lung tissues of the septic rats(n=8,scale bar=50µm).A:immunofluorescence showing the co-localization of parkin(red)and Tom20(green);B:immu⁃nofluorescence showing the co-localization of LC3(red)and Tom20(green).图7 卡络磺钠对脓毒症大鼠肺组织中parkin介导的线粒体自噬通路的影响
由parkin介导的线粒体自噬是线粒体自噬经典通路之一。当线粒体发生损伤,线粒体膜电位发生去极化,进而招募胞浆中的parkin分子与受损线粒体膜表面相结合,从而介导线粒体自噬发生[21]。脓毒症引起肺组织中parkin表达增多,线粒体自噬水平增强;敲除或沉默parkin基因后,肺组织的线粒体自噬水平明显降低,从而使脓毒症导致的肺损伤明显减轻,因此parkin介导的线粒体自噬过度增强是脓毒症肺损伤的机制之一[7]。抑制或降低该通路的活性,可以减轻脓毒症引起的肺损伤。我们的研究同样显示,脓毒症大鼠肺组织中parkin蛋白表达显著增多。进一步的免疫荧光显示,parkin与线粒体标志物Tom20的共定位荧光在脓毒症大鼠肺组织中明显增强。这些结果表明,脓毒症肺损伤发生时,par⁃kin介导的线粒体自噬水平明显增强。而卡络磺钠干预后,脓毒症大鼠肺组织中parkin的表达减少,parkin与Tom20的共定位明显减弱。该结果证实,卡络磺钠可以抑制脓毒症大鼠肺组织中parkin介导的线粒体自噬过度激活。这可能是卡络磺钠减轻脓毒症肺损伤的机制之一。
综上所述,卡络磺钠通过减少肺毛细血管渗漏,减轻肺组织细胞凋亡和病理损伤,从而减弱肺损伤程度,提高脓毒症大鼠生存率。卡络磺钠减轻脓毒症肺损伤的机制可能与其抑制parkin介导的线粒体自噬过度激活有关。

