Caspase-1介导的细胞焦亡对脑出血大鼠神经损伤的影响*
郭亚净, 任 静, 刘 寒, 李亭亭, 王 洪
(河北中医学院中西医结合学院,河北石家庄050200)
脑出血(intracerebral hemorrhage,ICH)具有很高的死亡率和致残率,占所有卒中类型的15%~20%,且其发病人数呈逐年上升趋势[1]。并且,大多数幸存者会遗留不同程度的神经功能障碍[2]。大量研究表明,血脑屏障破坏、脑水肿、炎症反应和凝血酶毒性效应等继发性脑损伤是导致神经功能障碍,造成不良预后的主要原因[3-4]。
胱天蛋白酶1(caspase-1)作为炎症性半胱天冬酶,介导细胞固有免疫炎症反应,促进白细胞介素1β(interleukin-1β,IL-1β)和IL-18等炎症因子的成熟与释放。同时,caspase-1还能使细胞焦亡执行蛋白gasdermin D(GSDMD)发生剪切,并在细胞膜聚集,造成细胞穿孔,引起细胞焦亡[5]。实验研究显示,caspase-1介导的炎症反应和细胞焦亡参与多种神经相关性疾病的发展过程[6-10]。然而,其在ICH后神经损伤中是否起作用仍不十分清楚。
本课题组利用自体非抗凝血注射法制造大鼠ICH模型,采用脑室内注射caspase-1选择性抑制剂Ac-YVAD-CMK的方法,观察caspase-1介导的细胞焦亡在ICH后神经损伤中的作用。
材料和方法
1 动物
SPF级雄性Sprague-Dawley(SD)大鼠,8~10周龄,体重约250~300 g,购于北京维通利华实验动物技术有限公司,动物许可证号为SCXK(京)2016-0006。饲养条件,温度恒定为(22±1)℃,湿度为(50±20)%,光照条件为昼夜各12 h,自由饮食、水。适应性饲养1周后,开始第1部分实验。将30只大鼠随机分为5组(每组6只大鼠):假手术(sham)组、ICH 12 h组、ICH 24 h组、ICH 48 h组和ICH 72 h组。采用Western blot方法,观察caspase-1和GSDMD在ICH后的表达及激活情况,选取活化变化最明显的时间点。根据第1部分实验结果,采用同样的造模方式,开始第2部分实验:54只大鼠随机平均分为3组(每组18只大鼠):sham组、ICH组和Ac-YVAD-CMK给药组(YVAD组),用于观察Ac-YVAD-CMK的作用。造模过程中未出现动物死亡情况,成功率为100%。动物实验程序通过河北中医学院实验动物伦理委员会批准(编号DWLL-2018005)。
2 主要试剂
Ac-YVAD-CMK购自APExBIO;BCA蛋白浓度测定试剂盒、神经元核抗原(neuronal nuclei,NeuN;神经元特异性核蛋白)抗体、离子钙结合接头分子1(ionized calcium-binding adaptor molecule-1,Iba-1;小胶质细胞标志物)抗体和β-actin抗体购自Servicebio;ECL显色试剂盒购自北京康为世纪生物科技有限公司;caspase-1和GSDMD抗体购自Santa Cruz;IL-1β和IL-18抗体购自Abcam;辣根过氧化物酶标记的Ⅱ抗IgG购自Cell Signaling Technology;TUNEL试剂盒购自Roche;Fluoro-Jade C(FJC)染色剂购自Millipore。
3 主要方法
3.1 Ac-YVAD-CMK给药方法 给药方法参考已有文献[11]。将Ac-YVAD-CMK溶解于DMSO中,用PBS进一步稀释至浓度为1 g/L(DMSO终浓度<0.2%)待用。大鼠称重,1%戊巴比妥钠,100 mL/kg腹腔注射麻醉。待大鼠麻醉成功后,将其固定于全自动脑立体定位仪上(51700,Stoelting),剪去大鼠头顶毛发,碘伏消毒,剪开大鼠头部正中皮肤约1 cm×1 cm,轻轻擦拭掉颅骨表面筋膜及软组织,定位前囟,然后以前囟作为原点,向后1.0 mm、向右旁开1.5 mm标记为穿刺点,颅钻垂直向下钻开一个直径约1 mm的注射孔,将装有Ac-YVAD-CMK的微量注射器安装到电动注射装置上,垂直向下进针4.5 mm穿刺进入脑室后,以1µL/min的速度注入Ac-YVAD-CMK,每只大鼠注射1µL。注药完毕后留针3 min,再缓慢退针。sham组和ICH组操作方法同上,以等体积PBS稀释的DMSO注入侧脑室,不注入任何药物。
3.2 ICH模型的制备 侧脑室注射Ac-YVAD-CMK 20 min后,建立ICH模型。以前囟作为原点,向前0.12 mm、向右旁开3.8 mm标记为穿刺点,然后用颅钻垂直向下钻开直径约1 mm的注射孔。碘伏擦拭大鼠尾尖,剪断尾尖取血,迅速将100µL血液转移到微量注射器中,将微量注射器安装到电动注射装置上,垂直向下进针5.5 mm穿刺进入纹状体,以10µL/min的速度注入自体非抗凝血,注射结束后停针20 min,然后缓慢退针。最后用骨蜡封闭注射孔,并用手术线缝合切口。
3.3 神经功能评价 (1)前肢放置实验用于评价大鼠的感觉运动功能:测试者握住大鼠背部皮肤使四肢悬空,将大鼠胡须接触桌面边缘诱导其将前肢放置于桌面上,纹状体受损大鼠,其受损对侧肢体将出现不同程度的放置能力缺失。大鼠每侧受测10次,左侧前肢成功放置的百分率反应损伤情况。(2)转角实验用于评价大鼠肢体协调功能:将大鼠放入一个两块板所形成的30°夹角内,使其转身,观察并记录大鼠向左侧转身的次数。每只大鼠重复放置10次,每次间隔至少30 s,左侧转身次数百分率反应损伤情况。(3)改良神经功能缺损评分(modified neurologi⁃cal severity score,mNSS)用于评价大鼠的运动、感觉、平衡和反射功能:评分范围为0~18分,分值越高,其神经损害越严重,评分方法参考相关文献[12]。
3.4 干湿比重法 用于检测脑组织含水量,观察水肿情况。大鼠麻醉后,迅速取脑组织。将其分为病灶侧皮质、病灶侧基底、病灶对侧皮质、病灶对侧基底及小脑5个部分。将脑组织分别放入锡纸中,称量湿重并记录。然后,将锡纸包裹的脑组织,放入恒温干燥箱(UF160,Memmert)中,以100℃烘干24 h。将烘烤后的脑组织取出,称量干重。脑组织含水量(%)=(湿重−干重)/湿重×100%。
3.5 标本的留取和制备 将麻醉成功的大鼠固定于操作台上,充分暴露大鼠胸腔,在右心耳处做一小切口。自左心室注入冰冷的生理盐水,将心血管系统内的血液冲洗干净。脑组织完整取出后去除小脑和脑干,仅留大脑。用于病理学检测的组织,在血液注射进针点冠状面将大脑分为前后两部分,放入4%组织细胞固定液中进行固定,随后进行蜡块包埋和组织切片;用于Western blot检测的组织,以血液注射进针点冠状面为基准,分别向其前后延伸1 mm距离,切取厚约2 mm的脑组织切片,并留取患侧纹状体脑组织,于液氮中存放24 h后,转入−80℃冰箱备用。所有操作均在冰上快速进行,以防止蛋白酶降解蛋白。
3.6 HE染色 用于观察血肿周围脑组织病理学变化及水肿情况。正置显微镜下(DM5300,Leica),每张切片选取4个视野进行拍照,每只动物选取3张切片进行观察。
3.7 FJC染色 用于检测血肿周围神经元退化情况。石蜡脑组织切片脱蜡至水后,用PBS冲洗,每次5 min,冲洗3次后将切片浸入0.06%的髙锰酸钾溶液中10 min(在摇床上轻摇)。从高锰酸钾溶液中取出切片,PBS冲洗3次,每次5 min。在避光环境下,将切片转移浸入0.000 1%的FJC染色液中染色30 min。用蒸馏水冲洗3次,每次5 min,切片周围水用纸巾擦干,晾干5 min,烤箱中(50℃)烘烤5 min。然后,将干燥后的切片置于二甲苯中进行透明,用抗荧光淬灭封片剂封片。荧光显微镜下(DM5300,Lei⁃ca),每张切片选取血肿周围组织4个视野进行拍照,并用ImageJ软件进行FJC阳性细胞数量统计。
3.8 Western blot 用RIPA裂解液进行脑组织匀浆后,在4℃下,12 000×g离心15 min。然后收集上清液,使用BCA蛋白检测试剂盒检测蛋白浓度。将含有50µg蛋白质的上清液加入SDS-PAGE分离,然后将分离的蛋白质转移到PVDF膜上。5%脱脂牛奶封闭PVDF膜后,分别孵育caspase-1、GSDMD、IL-1β、IL-18和β-actin抗体,于4℃过夜。然后,将TBST洗涤后的PVDF膜孵育过氧化物辣根酶标记的Ⅱ抗,于室温下放置90 min。使用ECL显色试剂盒进行显影,多功能激光扫描系统(Fusion FX5 Spectra,Vil⁃ber)检测蛋白含量,ImageJ软件进行灰度分析。
3.9 免疫荧光双标染色 石蜡切片脱蜡至水,稍甩干后用3%H2O2处理切片10 min,抑制内源性过氧化酶的活性,PBS漂洗3次,每次5 min。放入枸橼酸盐缓冲液中加热修复抗原10 min,室温冷却,PBS漂洗3次,每次5 min;滴加羊血清,于37℃恒温箱中封闭1 h;轻轻甩掉封闭液,在切片上滴加鼠源和兔源Ⅰ抗(GSDMD和Iba-1抗体,或GSDMD和NeuN抗体),于湿盒内4℃孵育过夜;次日用PBS漂洗3次,每次5 min。切片滴加两种相应种属的荧光Ⅱ抗,避光室温孵育30 min。PBS中漂洗3次后,滴加DAPI染液,避光室温孵育10 min。PBS中漂洗3次,抗荧光淬灭封片剂封片。正置荧光显微镜下(DM5300,Leica),观察并采集图像,用ImageJ软件进行分析。
3.10 免疫荧光与TUNEL双染 TUNEL(绿色)和Iba-1(红色)双染色用于评估ICH后小胶质细胞焦亡情况。石蜡切片经脱蜡至水、抑制内源性过氧化酶、抗原修复步骤后,根据TUNEL检测试剂盒(Roche)说明书,进行TUNEL染色;然后往切片上加入Iba-1抗体,4℃孵育过夜;次日将切片与荧光染料标记的Ⅱ抗在室温黑暗环境中孵育2 h;最后DAPI染核,抗荧光淬灭封片剂封片。在正置荧光显微镜下进行观察和拍照,每个切片在血肿周围选取3个视野,每个脑组织选取3个切片进行观察。使用ImageJ软件分析TUNEL阳性小胶质细胞数量。
4 统计学处理
用GraphPad Prism 7软件进行统计分析。数据均采用均数±标准误(mean±SEM)表示。多组间均数比较采用单因素方差分析(one-way ANOVA),两两比较采用Tukey's检验。以P<0.05为差异有统计学意义。
结 果
1 ICH后患侧纹状体中caspase-1和GSDMD蛋白的表达及激活情况
Western blot结果显示,与sham组比较,caspase-1、pro-caspase-1、caspase-1/pro-caspase-1、GSDMD-N、GSDMD和GSDMD-N/GSDMD均在ICH后72 h时显著升高(P<0.05),并且在72 h时病变最为明显,见图1。因此,本课题组选择ICH 72 h时点作为后续实验时点。
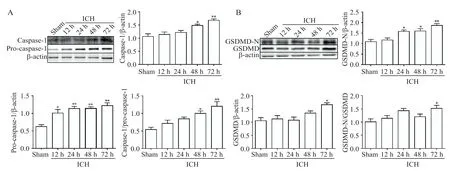
Figure 1.Western blot results for the changes of caspase-1(A)and GSDMD(B)activation and expression in the perihematoma after intracerebral hemorrhage(ICH).Mean±SEM.n=6.*P<0.05,**P<0.01 vs sham group.图1 脑出血后血肿周围组织caspase-1和GSDMD的激活及蛋白表达
2 抑制caspase-1对ICH大鼠神经功能的影响
前肢放置实验结果显示,与sham组比较,ICH大鼠左侧前肢放置成功率显著下降(P<0.01),而抑制caspase-1显著提高了大鼠左侧前肢放置成功率(P<0.05),见图2A。转角实验结果显示,与sham组比较,ICH大鼠左侧转身的百分比显著下降(P<0.05),而抑制caspase-1显著提高了大鼠左侧转身的百分比(P<0.05),见图2B。mNSS结果显示,与sham组比较,ICH大鼠mNSS显著升高(P<0.01),而抑制caspase-1显著降低了大鼠mNSS(P<0.05),见图2C。

Figure 2.Neurological function assessment in the rats with intracerebral hemorrhage(ICH).A:forelimb placement test;B:corner turn test;C:modified neurological severity score(mNSS).Mean±SEM.n=6.*P<0.05,**P<0.01 vs sham group;#P<0.05 vs ICH group.图2 脑出血大鼠的神经功能评估结果
3 抑制caspase-1对ICH大鼠神经损伤的影响
HE染色结果显示,sham组大鼠脑组织中神经细胞排列整齐、分布匀称,细胞组织结构染色均匀;ICH组大鼠血肿周围脑组织中小胶质细胞数量增加,神经细胞肿胀,排布不均,部分细胞固缩性坏死,染色加深;YVAD组大鼠血肿周围脑组织中神经细胞肿胀明显减轻,固缩坏死细胞数量减少,见图3A。干湿比重结果显示,与sham组比较,ICH大鼠病灶侧基底显著水肿(P<0.05),而抑制caspase-1显著缓解了病灶侧基底的水肿(P<0.05),见图3B。然而,与sham组比较,ICH大鼠病灶侧皮质、病灶对侧基底、病灶对侧皮质及小脑的水肿情况无显著差异。FJC染色结果显示,与sham组比较,ICH大鼠血肿周围脑组织中FJC染色阳性细胞数量显著增加(P<0.05),而抑制caspase-1显著减少了FJC染色阳性细胞的数量(P<0.05),见图3C、D。

Figure 3.Nerve injury in the rats with intracerebral hemorrhage(ICH).A:HE staining was used to observe the histopathological changes in the surrounding tissues of hematoma(scale bar=50µm);B:the changes of brain water content in different parts of brain tissue(Ispi:ispilateral;Cont:contralateral;BG:basal ganglia;CX:cortex)in each group;C:representa⁃tive microphotographs and quantitative analysis of Fluoro-Jade C(FJC)-positive neurons in the surrounding tissues of hema⁃toma(scale bar=50µm);D:representative image of the surrounding tissues of hematoma.Mean±SEM.n=6.*P<0.05 vs shamgroup;#P<0.05 vs ICH group.图3 脑出血大鼠神经损伤情况
4 抑制caspase-1对ICH大鼠患侧纹状体中cas⁃pase-1和GSDMD蛋白表达及激活的影响
Western blot结果显示,与sham组比较,ICH大鼠脑组织中caspase-1、pro-caspase-1、caspase-1/pro-cas⁃pase-1、GSDMD-N、GSDMD和GSDMD-N/GSDMD均显著升高(P<0.05),而抑制caspase-1显著降低了上述蛋白的表达及激活水平(P<0.05),见图4。
5 抑制caspase-1对ICH大鼠血肿周围脑组织中TUNEL和GSDMD阳性神经元和小胶质细胞的影响
免疫荧光双标结果显示,与sham组比较,ICH大鼠血肿周围脑组织中GSDMD阳性表达小胶质细胞的数量显著增加(P<0.01),而抑制caspase-1显著减少了GSDMD阳性表达小胶质细胞的数量(P<0.01),见图5A。免疫荧光与TUNEL共染色结果显示,与sham组比较,ICH大鼠血肿周围脑组织中TUNEL阳性小胶质细胞的数量显著增加(P<0.01),而抑制caspase-1显著减少了TUNEL阳性小胶质细胞的数量(P<0.05),见图5B。免疫荧光双标结果显示,ICH组大鼠血肿周围脑组织中GSDMD阳性表达神经元数量与sham组比较无显著差异,见图5C。
6 抑制caspase-1对ICH大鼠患侧纹状体中IL-1β和IL-18蛋白表达的影响
Western blot结果显示,与sham组比较,ICH大鼠脑组织中IL-1β和IL-18蛋白表达显著升高(P<0.05),而抑制caspase-1显著降低了IL-1β和IL-18的表达(P<0.05),见图6。
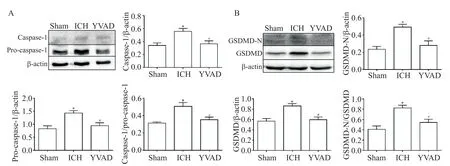
Figure 4.Western blot results showed that Ac-YVAD-CMK inhibited the activation and protein expression of caspase-1(A)and GSDMD(B).Mean±SEM.n=6.*P<0.05 vs shamgroup;#P<0.05 vs ICH group.图4 Ac-YVAD-CMK抑制caspase-1和GSDMD的激活及蛋白表达
讨 论
1 由caspase-1介导的细胞焦亡在ICH后神经损伤中发挥重要作用
细胞焦亡是一种炎症程序性细胞死亡方式,兼具凋亡和坏死的特征[13]。焦亡细胞病理表现为核固缩,DNA断裂,TUNEL染色为阳性,但胞体增大,胞膜完整性被破坏,胞膜上形成1~2 nm的膜孔[5]。GSDMD是细胞焦亡的效应蛋白,属于gasdermin家族。GSDMD被激活的caspase剪切,释放N末端与细胞膜的脂质融合,形成膜孔,改变细胞的渗透压,破坏细胞膜的功能,使得细胞膜破裂,导致细胞焦亡[14]。
焦亡途径包括caspase-11或caspase-4/5介导的非经典焦亡途径和caspase-1介导的经典焦亡途径。在刺激信号作用下,pro-caspase-1被招募到炎症小体后二聚体化,激活其自身的蛋白酶活性,自剪切形成具有催化活性的caspase-1,caspase-1切割pro-IL-1β和pro-IL-18,使其活化成为有活性的IL-1β和IL-18,活化后的炎症因子通过GSDMD形成的膜孔释放至细胞外,募集更多的炎症细胞聚集,扩大炎症反应[15-16]。研究结果显示,ICH大鼠患侧纹状体中cas⁃pase-1和GSDMD的表达及活化在72 h内逐渐升高,表明ICH大鼠脑组织中出现了细胞焦亡。
Ac-YVAD-CMK是一种caspase-1选择性抑制剂,有研究显示其可以改善胶原酶诱导的ICH小鼠或大鼠的神经功能障碍和caspase-1介导的炎症反应[11,17]。为了进一步证实caspase-1介导的细胞焦亡对ICH后神经损伤的影响,我们在制备ICH模型前,将Ac-YVAD-CMK注入侧脑室,观察其对大鼠神经损伤和神经功能的作用。结果显示,Ac-YVAD-CMK显著改善了大鼠的神经功能障碍、组织病理学变化和脑组织水肿,减少了退行性神经元的数量,说明抑制caspase-1显著地改善了ICH大鼠的神经功能障碍和神经损伤,与其他学者的研究结果一致。同时,Ac-YVAD-CMK显著降低了ICH大鼠患侧纹状体内caspase-1和GSDMD的表达及激活水平,降低了IL-1β和IL-18的表达水平,说明抑制caspase-1显著抑制了ICH大鼠脑组织中的细胞焦亡。这些结果表明,caspase-1介导的细胞焦亡在ICH大鼠的神经损伤和神经功能障碍中发挥重要作用。
2 ICH后激活的小胶质细胞内发生caspase-1介导的细胞焦亡
小胶质细胞是中枢神经系统内特有的固有免疫细胞,约占脑内所有细胞总数的5%~10%[18]。当中枢神经系统受到损害时,小胶质细胞数分钟即被激活,并迁移到损伤部位[19-20]。激活后的小胶质细胞存在M1和M2两种状态:M1状态下的小胶质细胞主要作用为释放多种促炎因子来加强炎症反应,例如IL-1β、IL-18和MCP-1等[21],M2状态下的小胶质细胞主要作用则为抑制炎症反应[22-23]。当小胶质细胞被过度活化,其释放大量的促炎细胞因子、趋化因子和氧化代谢物等会加剧神经损伤[24]。有研究显示,ICH发生后数分钟内小胶质细胞即被激活,且主要表现为M1型,产生IL-6和TNF-α等细胞因子,促进炎症反应,加重脑组织损伤[25]。虽然我们的研究结果显示,ICH大鼠脑组织中发生caspase-1介导的炎症反应和细胞焦亡,但焦亡发生在小胶质细胞内还是神经元内仍不清楚。为了进一步进行验证,我们采用免疫荧光双标和免疫荧光与TUNEL共染色的方法进行观察。结果显示,ICH大鼠血肿周围脑组织中GSDMD和TUNEL阳性小胶质细胞数量显著增加,Ac-YVAD-CMK可以显著减少GSDMD和TUNEL阳性小胶质细胞的数量。然而,对照组与ICH组大鼠血肿周围脑组织中GSDMD阳性神经元的数量无显著差异。这些结果说明ICH大鼠脑组织中caspase-1介导的细胞焦亡主要发生在小胶质细胞内。
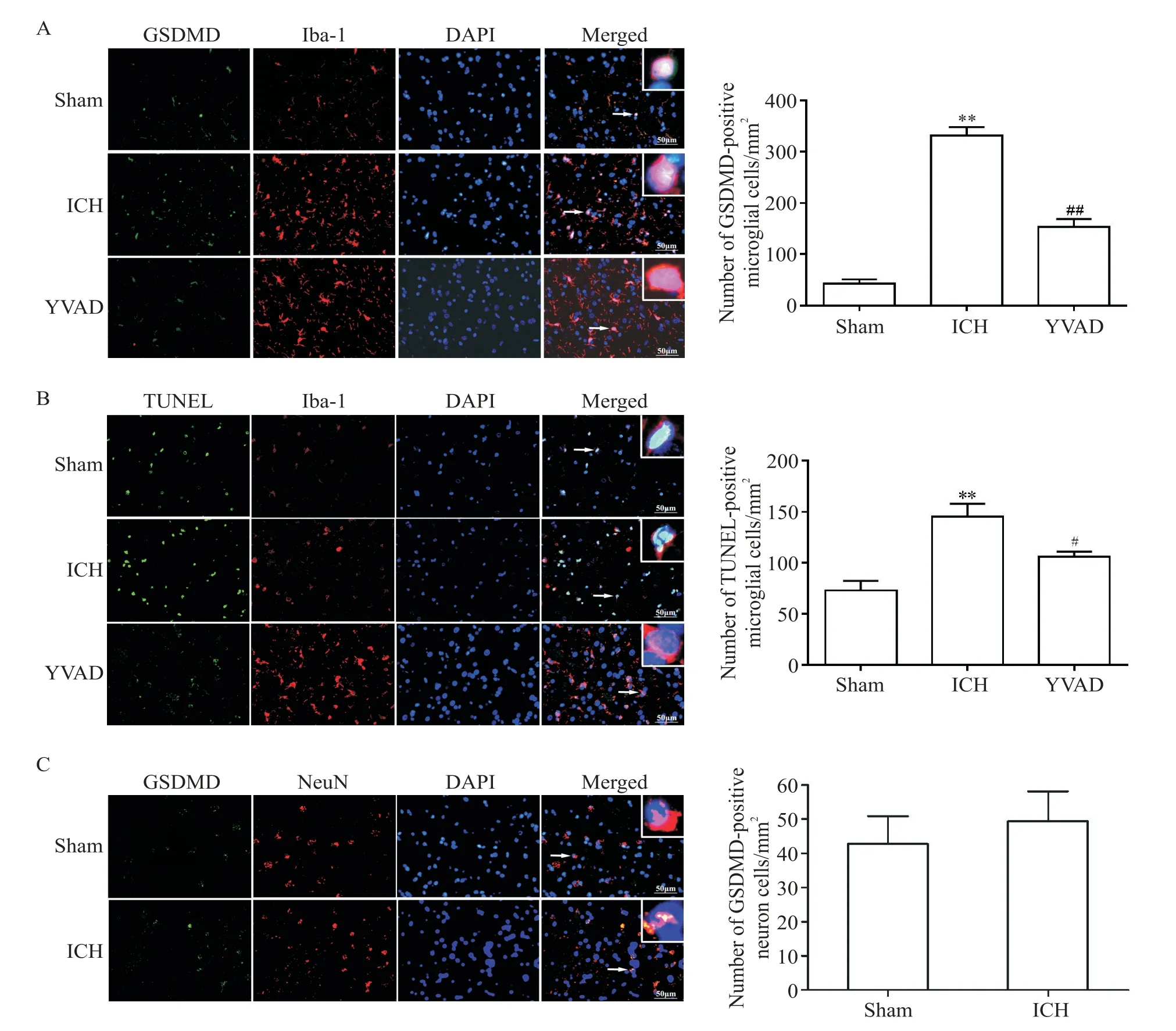
Figure 5.The results of double immunofluorescence labeling and co-staining of immunofluorescence and TUNEL.A:representative microphotographs and quantitative analysis of GSDMD-positive microglia in the surrounding tissues of hematoma;B:repre⁃sentative microphotographs and quantitative analysis of TUNEL-positive microglia in the surrounding tissues of hematoma;C:representative microphotographs and quantitative analysis of GSDMD-positive neurons in the surrounding tissues of he⁃matoma.The scale bar=50µm.Mean±SEM.n=6.**P<0.01 vs sham group;#P<0.05,##P<0.01 vs ICH group.图5 免疫荧光双标和免疫荧光与TUNEL共染色结果

Figure 6.Western blot results showed that Ac-YVAD-CMK in⁃hibited the expression of IL-1β(A)and IL-18(B).Mean±SEM.n=6.*P<0.05,**P<0.01 vs sham group;#P<0.05 vs ICH group.图6 Ac-YVAD-CMK抑制IL-1β和IL-18蛋白表达
综上所述,大鼠ICH发生后,小胶质细胞被激活,发生caspase-1介导的炎症反应和细胞焦亡,释放大量炎症因子,造成周围神经元退化,导致神经损伤和神经功能障碍。然而,造成小胶质细胞激活和神经元退化的机制仍有待进一步研究。

