REDD1升高加重脑梗死后血管内皮细胞损伤*
柳双桂, 张慧燕, 王震华
[华中科技大学协和江南医院(武汉市江夏区第一人民医院)康复医学科,湖北武汉430200]
缺血性卒中是卒中的主要亚型(约87%),是成人死亡和长期残疾的主要原因之一[1]。脑微血管内皮细胞(brain microvascular endothelial cells,BMECs)是脑血管系统的重要组成部分,在缺血性卒中的病理过程中起着重要作用[2]。内皮细胞的主要功能之一是在生理条件下维持血脑屏障的完整性[3]。缺血性卒中后,血脑屏障被破坏,导致出血性转化和脑组织梗死。因此,BMECs成为治疗缺血性卒中的新靶点。发育及DNA损伤反应调节蛋白1(protein regu⁃lated in development and DNA damage response 1,REDD1)受多种应激刺激诱导,包括氧糖剥夺(oxy⁃gen-glucose deprivation,OGD)和缺氧[4],在氧化应激和炎症反应过程中具有多种生物学功能[5]。有证据表明REDD1的表达在OGD作用下上调[6]。最近,已有研究证明REDD1缺失减少了活性氧(reactive oxy⁃gen species,ROS)的产生和促炎细胞因子的表达[7]。此外,REDD1是哺乳动物雷帕霉素靶蛋白(mamma⁃lian target of rapamycin,mTOR)的内源性抑制剂,可调节细胞应激反应[4]。然而,REDD1激活在脑梗死后血管生成中的作用尚未见深入研究。因此,本研究以OGD处理人BMECs(human BMECs,HBMECs)模拟缺血性脑卒中的细胞损伤,分析REDD1的血管保护作用和促血管生成机制,旨在寻找治疗缺血性脑卒中的潜在治疗靶点。
材料和方法
1 实验材料
HBMECs购自北京北纳创联生物技术研究院。2′,7′-二氢二氯荧光素二乙酸酯(DCFH-DA)、胎牛血清、DMEM培养基、脂质体3000、Trizol试剂和Alexa Fluor 594 Phalloidin(Invitrogen);第1链cDNA合成试剂盒(Roche);SYBRGreen PCRMaster Mix试剂盒(Applied Biosystems);2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)、裂解缓冲液+蛋白酶抑制剂混合物和小鼠抗BrdU抗体(Sig⁃ma-Aldrich);BCA蛋白浓度测定试剂盒(Thermo Fisher Scientific);PVDF膜和兔抗神经元核抗原(neuronal nuclei,NeuN)抗体(EMD Millipore);兔抗REDD1和GAPDH抗体(Santa Cruz);CCK-8试剂盒(Boster);与过氧化物酶结合的Ⅱ抗、兔抗vWF抗体、Cy3标记的山羊抗小鼠IgG和FITC标记的山羊抗兔IgG(Abcam);针对REDD1的小干扰RNA[REDD1small interfering RNA(siRNA),si-REDD1]及其阴性对照(negative control siRNA,si-NC)均由GenePhar⁃ma设计合成。
2 实验方法
2.1 细胞培养和转染 HBMECs在含10%胎牛血清的DMEM培养基中培养。为了模拟体外缺血样条件,HBMECs在不含葡萄糖的DMEM培养基中培养,并在37℃的N(295%)和CO(25%)湿空气中孵育2 h。随后,用正常培养基替换不含葡萄糖的DMEM培养基,并在正常条件下培养细胞。对照组在正常条件下在正常培养液中培养。在模拟OGD前,将HB⁃MECs以每孔5×104个的密度接种于24孔板。然后用脂质体3000将100 nmol/L si-REDD1和si-NC分别转染入细胞。转染48 h后,收集细胞并进行OGD处理。
2.2 RT-qPCR分析 使用Trizol试剂从HBMECs中提取总RNA。使用SmartSpec Plus分光光度计(Bio-Rad Laboratories)评估RNA纯度。使用第1链cDNA合成试剂盒合成cDNA,使用SYBR Green PCR Mas⁃ter Mix试剂盒和ABI 7500实时PCR系统(Applied Biosystems)进行实时定量PCR。mRNA表达值根据2−ΔΔCt法计算,GAPDH为内参照。REDD1的正向引物序列为5′-TGCTTAGGGTGAAAAATACCTT-3′,反向引物序列为5′-TGATTTGTATGACCTGAGAAA-3′;GAPDH的正向引物序列为5′-CACCATTGGAT⁃GAGGGTTC-3′,反 向 引 物 序 列 为5′-TGCTG⁃GAAGGGATGAGGG-3′。
2.3 Western blot分析 使用裂解缓冲液+蛋白酶抑制剂混合物提取蛋白质,并采用BCA蛋白浓度测定试剂盒测量蛋白浓度。将每个样品中等量的蛋白分离到10%SDS-PAGE上,然后转移到PVDF膜上。将膜用5%脱脂奶粉缓冲液封闭1 h,并在4℃下与抗REDD1抗体(1∶500)和抗GAPDH抗体(1∶1 000)孵育过夜。然后,在室温下与过氧化物酶结合的Ⅱ抗孵育1 h。使用增强化学发光系统(Thermo Fisher Scientific)观察蛋白条带。用Image-Pro Plus 6.0软件定量测定蛋白表达。以GAPDH作为内参照。
2.4 CCK-8法分析细胞活力 将细胞悬浮液(100µL)接种到96孔板中。转染和/或OGD处理后,将10µL CCK-8试剂添加到每个孔中并孵育2 h。最后,通过微孔板读取器(Bio-Rad)检测450 nm处的吸光度(A)值。
2.5 细胞内ROS生成的检测 使用DCFH-DA染色测量细胞内ROS的生成。将细胞悬浮液(100µL)接种到96孔板中。转染和/或OGD处理后,加入10µmol/L CM-H2DCF-DA在37℃黑暗中孵育30 min。用PBS洗涤细胞3次后,通过荧光显微镜拍摄图像。使用ImageJ软件对每组随机选取的3个显微视野的相对细胞荧光强度进行定量分析。
2.6 肌动蛋白染色 细胞以每孔5×105个的密度接种在12孔板上,当细胞融合率达到70%~80%时,用4%多聚甲醛固定,加入0.1%Triton X-100透皮3 min,5%牛血清白蛋白封闭30 min,细胞与Alexa Flour 594 Phalloidin在37℃中避光孵育1 h。随后,用PBS洗涤3次后,用DAPI染色3 min,并使用荧光显微镜获得图像。
2.7 大脑中动脉闭塞(middle cerebral artery occlu⁃sion,MCAO)模型的建立和分组 雄性Sprague-Dawley(SD)大鼠(260~300 g)购自北京维通利华实验动物技术有限公司,动物许可证编号为SCXK(京)2018-0002,在手术前可以自由获得水和食物。大鼠随机分为假手术(sham)组、MCAO组、MCAO+si-NC组和MCAO+si-REDD1组。将所有siRNA溶解于无RNase的水中,终浓度为2 g/L,振荡并反复离心,然后注入MCAO造模大鼠大脑受损区域(12µL),坐标如下:前后0.9 mm、左右1.9 mm和背侧3.5 mm,并保留10 min。24 h后建立MCAO模型。MCAO模型建立方法如下:SD大鼠用3%异氟醚麻醉并置于立体定向框架中。在颞肌与顶骨交界处作纵切口。然后用刀柄将颞肌与颞板分离,暴露颞窝,用小电钻在颞窝上钻一个小孔,暴露大脑中动脉后,在左侧大脑中动脉内放置一根尖端呈圆形的尼龙丝(北京西浓科技有限公司)60 min,然后缓慢取出尼龙丝,恢复缺血动脉的血流,开始再灌注。用PeriFlux 5000激光多普勒仪(Perimed AB)在缺血前、MCAO期间和再灌注期间检测脑血流。假手术组大鼠除不进行闭塞外,其余步骤同MCAO大鼠。手术过程中使用加热灯将大鼠直肠温度维持在37℃左右。在MCAO造模后3、7和14 d,采用改良神经功能缺损评分(modi⁃fied neurological severity score,mNSS)对大鼠进行神经功能评分。
2.8 脑梗死体积的测量 MCAO造模后14 d处死大鼠。大鼠脑灌流生理盐水,再灌注4%多聚甲醛。取出整个大脑,在4℃下用4%多聚甲醛固定过夜,然后用30%蔗糖脱水。将脑组织切成20µm厚的冰冻切片。将切片放入2%的TTC溶液中放置15 min,无光照。用4%多聚甲醛固定24 h,用ImageJ软件定量分析。梗死(白色部分)体积以占整个脑区体积的百分比表示。
2.9 免疫荧光染色 采用免疫荧光双染法检测BrdU/NeuN和BrdU/vWF阳性细胞。将20µm厚的冰冻切片用50%甲酰胺/2×生理盐水枸橼酸钠缓冲液在65℃处理2 h,用37℃、2 mol/L盐酸孵育30 min,再用0.1 mol/L硼酸(pH 8.5)中和10 min,再用5%山羊血清处理1 h,并与小鼠抗BrdU抗体(1∶200)、兔抗NeuN抗体(1∶500)和兔抗vWF抗体(1∶200)在4℃孵育过夜,随后与Cy3标记的山羊抗小鼠IgG和FITC标记的山羊抗兔IgG(1∶100)在37℃下孵育1 h。使用DMIL倒置荧光显微镜(Leica)获取图像。从每个样本中随机选择3个区域进行阳性细胞计数分析。
3 统计学处理
所有统计分析均使用GraphPad Prism 7.0软件进行。所有实验均独立重复至少3次,结果以均数±标准差(mean±SD)表示。统计推断采用单因素方差分析和Tukey事后检验。以P<0.05为差异有统计学意义。
结 果
1 OGD处理对HBMECs中REDD1表达的影响
在体外缺血性卒中模型中,OGD处理后6、12和24 h的HBMECs中REDD1的mRNA表达均上调(P<0.05),见图1A。Western blot分析证实REDD1在蛋白水平上亦显著上调(P<0.05),见图1B。这提示REDD1可能在缺血性卒中中起重要作用。
2 敲减REDD1表达减轻OGD对HBMECs的损伤
为了确定REDD1在OGD诱导的HBMECs损伤中的作用,本研究用si-NC和si-REDD1分别转染细胞,然后用OGD处理细胞。结果显示,特异性si-REDD1可有效下调OGD处理的HBMECs中REDD1蛋白的表达,见图2A。进一步的细胞功能评价显示,OGD处理诱导细胞骨架紊乱,应力纤维减少,足细胞骨架皱缩成多边形,且细胞活力降低(P<0.05);而REDD1沉默使细胞骨架趋于正常,并且提高了细胞活力,见图2B、C。为了研究REDD1在调节OGD介导的氧化应激中的作用,我们使用DCFH-DA染色测定了细胞内ROS的产生。如图2D所示,将细胞暴露于OGD可显著增强ROS的生成,而敲减REDD1阻止了细胞内ROS生成的增加(P<0.05)。

Figure 1.The effect of OGD treatment on the expression of REDD1 in HBMECs.A:the mRNA expression of REDD1 was detected by RT-qPCR;B:Western blot was used to detect the protein level of REDD1.Mean±SD.n=3.*P<0.05 vs control group.图1 OGD处理对HBMECs中REDD1表达的影响
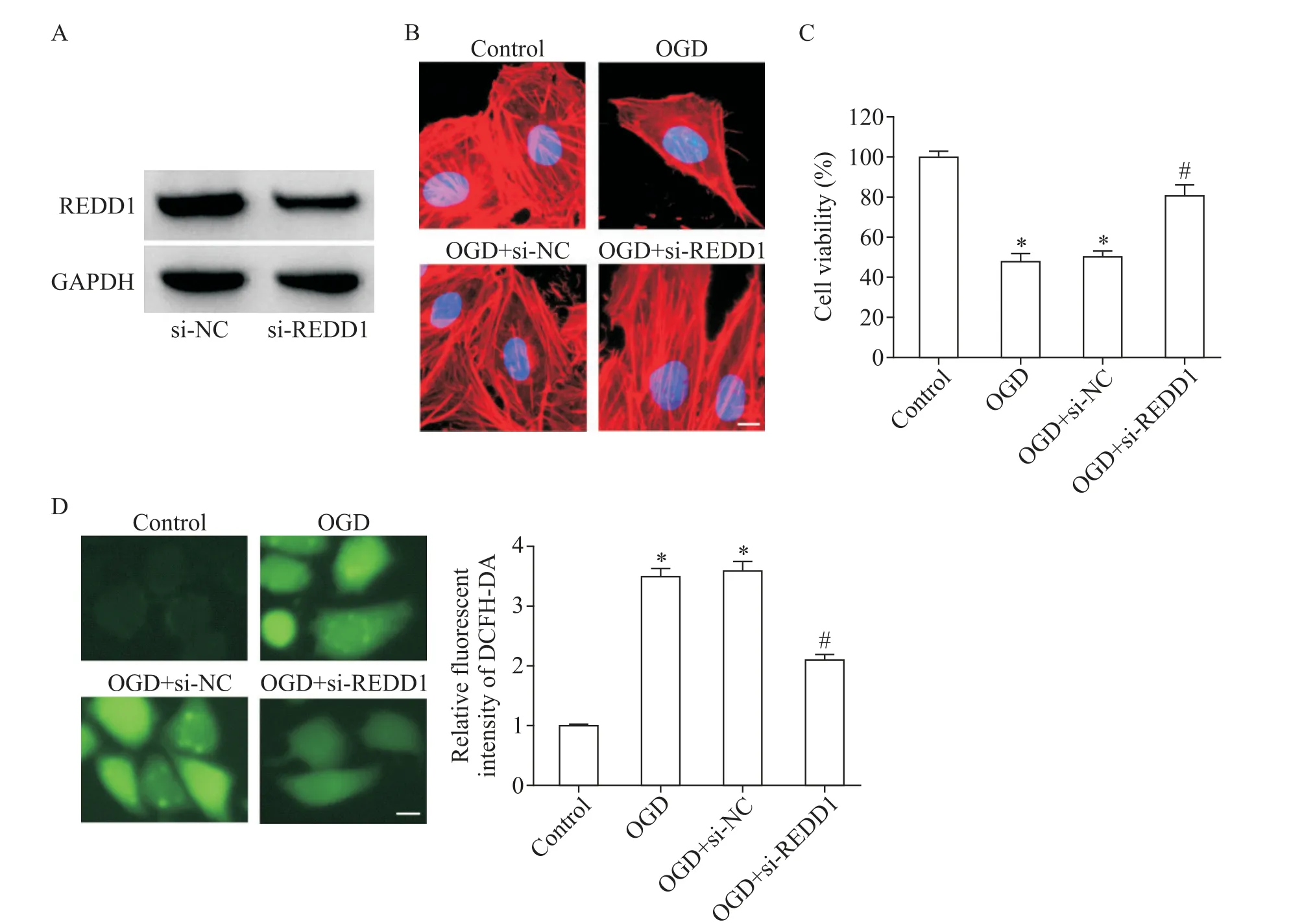
Figure 2.Silencing of REDD1 reduced the damage of HBMECs with OGDtreatment.A:Western blot was used to detect the efficien⁃cy of REDD1 knock-down;B:the cytoskeleton was detected by F-actin staining;C:CCK-8 assay was used to measure the cell viability;D:the intracellular ROScontent was analyzed by DCFH-DA staining.The scale bar=5µm.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs OGD+si-NCgroup.图2敲减REDD1表达减轻OGD对HBMECs的损伤
3 敲减REDD1表达促进MCAO大鼠神经功能 恢复
MCAO大鼠神经功能损害严重,在MCAO术后第3、7和14天的mNSS均显著高于假手术组(P<0.05),且在MCAO后第14天时TTC染色显示大脑半球梗死体积显著高于假手术组(P<0.05),表明MCAO模型成功建立;此外,Western blot分析显示,MCAO大鼠脑梗死组织中REDD1蛋白表达显著高于假手术组(P<0.05),通过si-REDD1降低MCAO大鼠脑组织中REDD1蛋白表达(P<0.05)后,大鼠在3、7和14 d的mNSS均显著低于MCAO组(P<0.05),且大鼠的梗死体积显著减少(P<0.05),见图3。

Figure 3.REDD1 silencing promoted the recovery of neural function in MCAO rats.A:the modified neurological severity score(mNSS)of rats in each group at different time points after MCAO(n=3);B:the representative images of TTCstaining and quantitative analysis of cerebral infarction volume in each group(n=5);C:Western blot was used to detect the protein ex⁃pression of REDD1 in rat brain tissues(n=3).Mean±SD.*P<0.05 vs control group;#P<0.05 vs MCAO+si-NCgroup.图3敲减REDD1的表达促进MCAO大鼠神经功能恢复
4 敲减REDD1表达促进MCAO大鼠神经发生和血管生成
采用BrdU/NeuN和BrdU/vWF免疫荧光染色,观察REDD1敲减后神经发生和血管生成情况。与MCAO组相比,REDD1沉默组BrdU+/NeuN+细胞数和BrdU+/vWF+细胞数均显著增加(P<0.05),见图4。这一结果表明,敲减REDD1表达促进了MCAO大鼠神经发生和血管生成。
讨 论
发现有希望的靶点和有效的治疗方法是缺血性脑卒中研究的主要目标之一。血管生成对于改善缺血性卒中的预后非常重要[8]。在缺血性卒中患者中,新血管的数量与延长生存期相关[9]。BMECs功能障碍是影响血管生成的主要原因[10]。OGD诱导BMECs损伤的分子机制复杂。本研究发现,在OGD处理的HBMECs中,REDD1的表达明显升高,且细胞存在明显的骨架紊乱、应力纤维减少和细胞活力降低。REDD1是一种高度保守的应激相关蛋白,其表达可由缺氧/缺血和DNA损伤等多种环境胁迫诱导[11]。先前的研究发现,蛛网膜下腔出血后患者脑脊液中REDD1水平明显升高,REDD1水平与Hunt-Hess分级呈正相关,而正常脑脊液中几乎不存在REDD1表达,表明REDD1与蛛网膜下腔出血所致神经元损伤有密切关系[12]。值得注意的是,本研究发现,敲减REDD1的表达对OGD诱导的HBMECs损伤有缓解作用,表明REDD1与缺血性脑卒中进展有关。这些结果证明REDD1的表达增加参与介导了OGD诱导的HBMECs损伤。
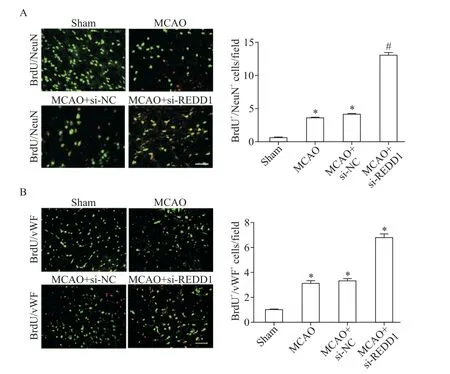
Figure 4.REDD1 silencing promoted neurogenesis and angiogenesis in MCAO rats.A:BrdU(red)/NeuN(green)double immuno⁃fluorescence staining and quantitative analysis;B:BrdU(red)/vWF(green)double immunofluorescence staining and quantitative analysis.The scale bar=50µm.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs MCAO+si-NCgroup.图4 敲减REDD1的表达促进MCAO大鼠神经发生和血管生成
氧化应激是由氧化和抗氧化系统之间的不平衡引起的。目前认为,REDD1对不同神经元的毒性作用是通过降低对氧化应激的敏感性介导。REDD1/TXNIP复合表达能够诱导ROS产生,抑制ATG4B活性,激活自噬。在REDD1缺失小鼠中,ATG4B活性上调和自噬通量的增加减少了线粒体缺陷,进而减轻了氧化磷酸化损伤[13]。REDD1沉默可能通过减轻OGD诱导的氧化应激保护HBMECs。为了了解REDD1在OGD诱导的氧化应激中的作用,我们检测了OGD诱导的HBMECs的ROS生成的情况,结果显示敲减REDD1的表达减少了OGD诱导的细胞内ROS的生成。这些发现为REDD1通过激活氧化应激促进OGD诱导的内皮功能障碍的主要机制提供了有力的证据。总的来说,我们的结果证实了REDD1在HBMECs中的重要作用,从而可能在缺血性卒中发展过程中发挥作用。
为了进一步明确REDD1在缺血性卒中治疗中的作用,本研究进一步考察了敲减REDD1的表达对MCAO大鼠神经功能恢复的影响。结果显示,REDD1沉默可改善缺血后14 d MCAO大鼠的神经功能评分并减轻脑梗死体积。脑卒中诱导的神经发生和血管生成促进脑修复和功能恢复[14-15]。鉴于敲减REDD1的表达可减轻OGD诱导的HBMECs细胞骨架损伤,并增强其功能。本研究进一步通过免疫荧光染色发现,敲减REDD1的表达增加了MCAO大鼠BrdU+/NeuN+和BrdU+/vWF+的细胞数量,提示REDD1在调节缺血性脑卒中后的神经发生和血管生成中发挥重要作用。
总的来说,敲减REDD1表达降低了OGD诱导的HBMECs损伤和氧化应激,并有助于增强MCAO大鼠神经发生和血管生成,促进神经功能恢复。因此,REDD1可能是缺血性卒中后脑修复和功能恢复的潜在治疗靶点。

