硫酸盐还原菌对重金属污染土壤的处理研究*
朱 煜
(上海市政工程设计研究总院(集团)有限公司,上海 200092)
据统计,我国目前遭受铅、铬、砷、镉等重金属污染的耕地面积将近2 000万km2[1]。一般,原位土壤修复技术更具经济效益,并且污染物去除和提取比固化/稳定化更有利。固化/稳定化主要是向土壤中加入某些物质,使其与金属离子形成沉淀,从而在土壤中稳定。目前,常用的固定剂包括碳酸盐、磷酸盐、碱性试剂、黏土、含铁矿物和有机物质等[2]。但固定剂的施用将产生额外碳排放,同时药剂将持续存留在土壤和地下水中,造成严重的二次污染。
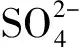
在土壤修复领域中,有学者采用SRB与解磷菌联合修复镉污染土壤,去除率可达70%以上[5]。也有研究使用表面活性剂与SRB耦合淋洗处理Cr(Ⅵ)污染土壤,Cr(Ⅵ)转换率可达到98%以上[6]。董净等[7]分析耐镉菌的生长特性、Cd2+浓度变化及矿化产物特性后发现,当Cd2+初始质量浓度为10 mg/L时,菌株对Cd2+的去除率达到95%。魏威等[8]探究了3种化学固定剂联合SRB对土壤中铅的固定效果,发现沸石和SRB组配能显著降低土壤中铅的活性,其固定效率可达到70.14%。研究现状表明,目前利用SRB处理污染土壤研究还较少。
本研究筛选并驯化高效的SRB,通过实验调控和比选外界环境因素,探索其对Cu2+和Cd2+的去除作用机制,确定重金属污染土壤修复技术的应用方式和应用效能,研究成果可为SRB生物无害化技术在重金属污染土壤修复领域的扩大应用提供技术支撑。
1 材料与方法
1.1 功能菌群的驯化筛选
构建一个10 L、水力停留时间为1 d的上流式厌氧污泥床反应器。
进水组分:Na2SO4、乳酸钠均为3 g/L,NH4Cl、CaCl2、MgSO4·7H2O和K2HPO4·3H2O投加量均为0.1 g/L。加入1.5 g/L的小苏打调节进水pH至8.0。每升水中加入1 mL的微量元素液(500 mg/L 投加量的H3BO3、ZnCl2、NiCl·6H2O、AlCl3·6H2O、(NH4)6Mo7O24·4H2O、CoCl2·6H2O和CuSO4·5H2O,1 000 mg/L投加量的Na2SeO3·5H2O,1 500 mg/L投加量的FeCl3·6H2O,5 000 mg/L投加量的MnCl2·4H2O,5 mL/L 37%(质量分数)HCl溶液),以满足微生物的正常生长需求。
接种污泥为上海某城市污水处理厂二沉池的剩余污泥,混合液悬浮固体(MLSS)质量浓度为30 000 mg/L。
1.2 SRB培养及修复实验
SRB的培养采用500 mL血清瓶,加入与进水组分相同的培养液并持续通入高纯氮气15 min,以充分去除培养瓶中存在的空气,充气结束后迅速盖上胶塞。将SRB放置在35 ℃、150 r/min中的振荡环境下培养。后续实验中加入菌液和采集样品通过注射器来实现,从而确保实验过程中的厌氧环境。
利用沙壤土分别制备铜/镉污染土壤,自然风干后采用Tessier法[9]提取可交换态目标金属离子并确定其污染强度,依据目前的实际污染状态,获得低、中、高3种强度的污染土壤。土壤修复实验采用快速序批实验,在500 mL血清瓶中进行,土壤为饱和水状态。20 g土壤加入SRB为(980±50) mg/L、200 mL的培养液中,SRB与土壤的质量比为1∶100。在150 r/min振荡环境下培养,温度依据实验需求设置。机理探究实验中,于污染土壤中接种(980±50) mg/L的SRB,120 h后对土壤进行形态提取。
1.3 分析方法

2 结果与讨论
2.1 菌株的筛选及富集培养
培养SRB菌群24 h后加入硫酸亚铁铵,迅速生成黑色沉淀FeS,表明该接种的SRB具有较高的活性。将SRB接种至Cu2+和Cd2+均为5 mg/L的培养液中培养24 h,SRB的生长代谢没有出现抑制现象[10-11],并且在底部可发现褐色的CuS和黄色的CdS沉淀,说明该SRB具有较好的耐受能力。
2.2 SRB的代谢能力
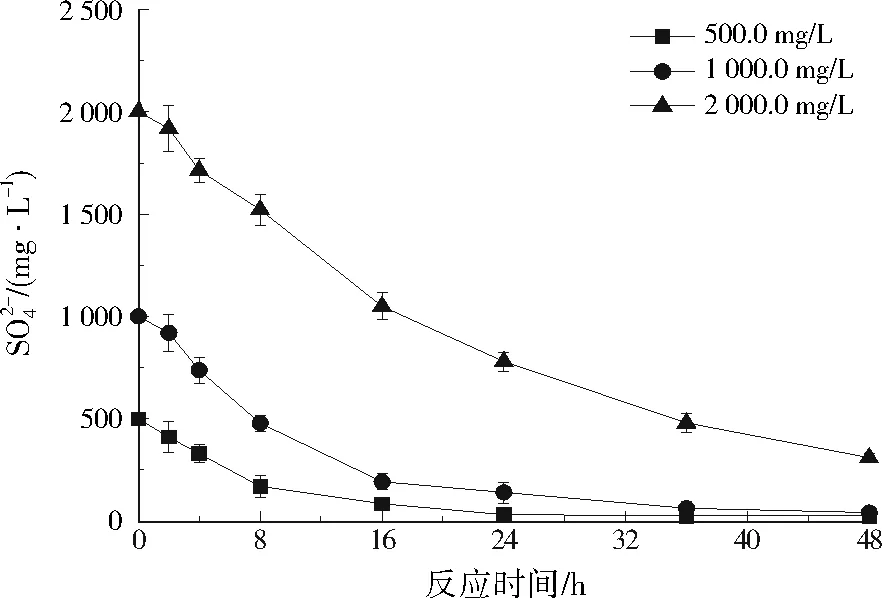
图1 不同初始质量浓度下SRB的降解能力Fig.1 Degradability of SRB under different initial mass concentrations
2.3 Cu2+和Cd2+对去除率的影响

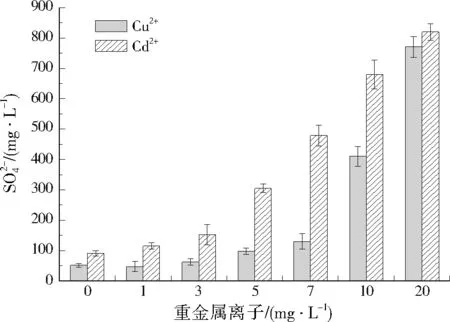
图2 SRB对Cu2+和Cd2+的耐受能力Fig.2 SRB tolerance to Cu2+ and Cd2+
将培养后的污泥和沉淀物进行扫描电镜分析,结果见图3。驯化培养获得的SRB种群中细菌的形态为长杆菌,在细菌周围有明显的硫化物沉淀,进行能量色散X射线光谱扫描分析,可确定沉淀物为CuS和CdS,其中CuS形态呈微球状,CdS形态为棒状。

图3 污泥及沉淀物中CuS和CdS的微观形态Fig.3 Microscopic morphology of CuS and CdS in sludge and sediment
2.4 修复机理
通过人工污染土壤模拟修复实验探究SRB对于重金属的修复机理。对修复前后的污染土壤进行形态提取和分析,经SRB处理后的土壤主要表现为重金属可交换态的降低。经SRB处理120 h后,Cu2+污染土壤中可交换态、碳酸盐态和铁(锰)态分别由32%、17%和28%降低至7%、10%和16%,有机态和残渣态则分别由7%和16%增加至30%和36%;Cd2+污染土壤中可交换态和碳酸盐态分别由22%和15%降低至2%和4%,铁(锰)态、有机态和残渣态则分别由29%、8%和25%增加至35%、23%和36%。这表明,经SRB处理后,可交换态会转变为其他较稳定的形态。可交换态是衡量土壤中金属离子稳定性的常用重要指标之一,故在后续的实验中,均通过可交换态来表征SRB对污染土壤的固化/稳定化效果。
2.5 Cu2+/Cd2+污染土壤的修复效能
由图4可见,96 h时,低、中强度(2.2、5.7 mg/g)的污染土壤中Cu2+分别为0.1、0.6 mg/g,去除率可达到85%以上。由于污染土壤中的重金属在饱和水状态下缓慢释放,Cu2+的去除速率低于沉淀速率,该情况有利于高强度污染土壤的修复。48 h时,高强度(11.3 mg/g)污染土壤中Cu2+降至9.9 mg/g,去除率为12.4%,随着产生的硫化物通过沉淀作用逐渐去除金属离子,消除了高浓度Cu2+的抑制作用,至96 h时,Cu2+进一步降至3.2 mg/g,这一阶段的去除率可达到67.7%。土壤中Cd2+的去除过程和规律与Cu2+类似。120 h时,低、中、高强度(2.9、5.6、9.8 mg/g)污染土壤中Cd2+分别为0.2、0.6、1.9 mg/g(见图5),去除率分别为93.1%、89.3%和80.6%。可看出,SRB对中低强度污染土壤中Cu2+和Cd2+的修复效果较好,去除率均可达到85%以上。
图4 SRB对土壤中Cu2+的去除效果Fig.4 Removal effect of Cu2+ in soil repaired by SRB
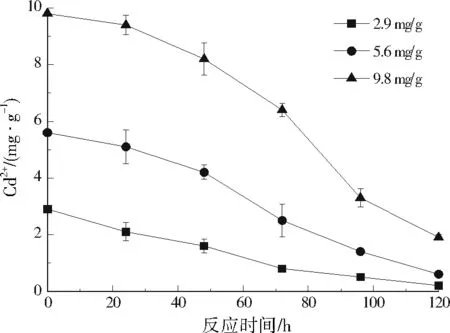
图5 SRB对土壤中Cd2+的去除效果Fig.5 Removal effect of Cd2+ in soil repaired by SRB
当污染土壤中Cu2+初始质量浓度为6.3 mg/g或Cd2+初始质量浓度为5.6 mg/g时,15、25、35 ℃下培养120 h后,Cu2+去除率分别为74.0%、92.0%和95.4%,Cd2+去除率分别为58.6%、77.6%和87.8%。由于温度越低,酶的活性越低,故中、高温条件下的修复效果较好,因此微生物修复技术过程必须考虑实际温度的影响。本研究中SRB对较高浓度Cd2+的去除率比脱硫弧菌属耐镉菌株(Desulfovibriosp. 821)[14]略高,在Cd2+浓度升高后,SRB对其的去除机制逐渐由胞内吸收向胞外吸附转移。
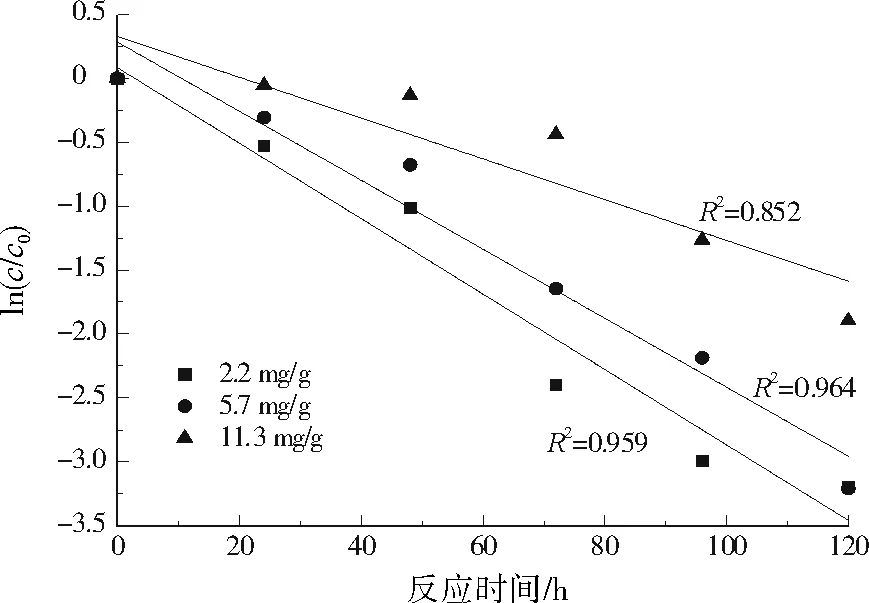
2.6 SRB对土壤中Cu2+和Cd2+修复反应动力学研究
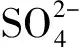
注:c0、c分别为土壤中相应重金属初始、反应后质量浓度,mg/g。图6 SRB对土壤中Cu2+修复反应动力学拟合情况Fig.6 Fitting of the reaction kinetics of Cu2+ in soil repaired by SRB
图7 SRB对土壤中Cd2+修复反应动力学拟合情况Fig.7 Fitting of the reaction kinetics of Cd2+ in soil repaired by bacteria
3 结 论
(2) 在模拟土壤修复实验中,经SRB处理后,重金属中可交换态会转变为其他较稳定的形态。SRB对中低强度污染土壤中Cu2+和Cd2+的修复效果较好,去除率均可达到85%以上,且中高温条件下的修复效果较好。
(3) SRB去除土壤中重金属的反应符合准一级反应动力学方程,去除速率常数随着土壤中重金属初始浓度的增加而逐渐降低。中低强度污染土壤中,SRB去除Cu2+的速率比Cd2+高。

