基于单巯基β-环糊精修饰的纳米金比色法检测水中的芘*
向 霄 郑博文 李佳男 聂宏宇 邢海波 黄波涛#
(1.上海市环境科学研究院,上海 200233;2.上海应用技术大学化学与环境工程学院,上海 201418)
随着煤、石油在工业生产、交通运输以及日常生活中的广泛应用,不断产生的多环芳烃(PAHs)严重威胁着人类健康[1]。PAHs是一类含有两个或两个以上苯环的芳烃化合物,包括蒽、芘、苯并芘等[2],已被列为典型的持久性有机污染物,其中大多数都为致癌物和致畸物[3-4]。在PAHs污染危险日益严重的情况下,对环境中PAHs进行及时、准确测定有助于环境的修复与保护,使公民免受污染的威胁。
目前对PAHs的检测方法有质谱、色谱分析法[5-7],酶联免疫吸附法[8],表面增强拉曼光谱法[9]等,上述方法虽然成熟稳定,但基本都需要大型仪器,检测耗时较长。因此,开展环境中PAHs快速筛查,建立高效、快速、简单的检测方法,对保护环境、保护公民健康具有重要的理论意义和实用价值。
纳米金(AuNPs)因其独特的光学性质备受广大研究者的青睐,其水溶液的具体颜色与金粒子间的间隔有关,当金粒子发生团聚,粒子间的间距变小时,水溶液会由红色变为蓝紫色。目前,利用AuNPs比色法开发的生物传感器一般是利用未经修饰的AuNPs溶液,在强电解质的直接作用下,使AuNPs表面电荷发生变化,产生聚集,从而引起颜色变化;也有的是用适配体等功能性基团通过共价作用修饰到AuNPs表面,当修饰在表面的功能基团和待测物特异性结合时,会改变AuNPs颗粒之间的距离,从而引起AuNPs聚集并产生肉眼可见的颜色变化。利用这种性质可以设计出多种检测探针,例如使用氨基酸修饰AuNPs检测卡那霉素[10],利用核酸适配体修饰AuNPs检测三聚氰胺[11]等。
β-环糊精作为大分子物质,拥有一个空腔结构,对一些大小适中的分子具有识别作用,因此成为近些年的研究热点[12-15]。通过修饰β-环糊精外沿可以使其与纳米粒子结合,用来检测PAHs[16-18]。
本研究基于单巯基β-环糊精(以下简称β-环糊精)、AuNPs、四甲基联苯胺(TMB)、H2O2设计出了一种新型快速传感器,用来检测水中的代表性PAHs之一——芘。将AuNPs与β-环糊精结合,β-环糊精对PAHs具有分子识别作用,会使PAHs嵌入其疏水空腔中[19-21]。当体系中存在TMB/H2O2时,会拉近β-环糊精腔体间的距离从而使AuNPs发生聚集。通过肉眼可观察到体系颜色的变化,能达到定性检测水中芘的目的。之后可以进一步借助紫外—可见分光光度计检测吸光度,从而实现对水中芘的定量分析。
1 材料与方法
1.1 实验仪器
实验所使用的主要仪器如下:台式离心机(TD5M-WS);恒温振荡器(THZ-98C);pH计(PB-10);电子天平(BSA224S);超声波清洗器(KS-7200E);紫外—可见分光光度计(UV-3500)。
1.2 试 剂
β-环糊精、TMB、KCl、NaCl、CaCl2、MgCl2、柠檬酸三钠、四氯金酸、H2O2均为分析纯。所有试剂和缓冲溶液均用超纯水(电阻率18 MΩ·cm)配置,实验中所用实际水样来自海湾旅游区相关河道。
1.3 β-环糊精修饰AuNPs的制备
AuNPs的制备:烧杯中加入98 mL超纯水和1 mL四氯金酸(质量分数1%)加热搅拌至微沸再加1 mL柠檬酸三钠(质量分数1%),溶液颜色变为紫红色后继续加热10 min,停止加热并冷却至室温保存。
β-环糊精修饰AuNPs的制备过程参考文献[11],将制备好的AuNPs和β-环糊精(1 μmol/L)以体积比1∶1混合搅拌12 h后保存。
1.4 吸收曲线
配置7组混合液,在400~800 nm波长下扫描,绘制吸收曲线,并记录下溶液颜色的变化。7组混合液均以AuNPs为基质,再添加下列系列混合液。混合液1为0.5 μmol/L β-环糊精、0.8 mol/L H2O2;混合液2为0.5 μmol/L β-环糊精、0.3 μmol/L TMB;混合液3为0.5 μmol/L β-环糊精、0.8 mol/L H2O2、0.3 μmol/L TMB;混合液4为0.5 μmol/L β-环糊精、0.8 mol/L H2O2、50 μmol/L芘;混合液5为0.5 μmol/L β-环糊精、0.3 μmol/L TMB、50 μmol/L芘;混合液6为0.5 μmol/L β-环糊精、0.8mol/L H2O2、0.3 μmol/L TMB、50 μmol/L芘;混合液7为0.5 μmol/L β-环糊精、50 μmol/L芘。
1.5 β-环糊精修饰的AuNPs的透射电镜扫描
将上述7组样品送往上海交通大学分析测试中心进行透射电镜(Tecnai G2 Spirit BioTWIN)扫描,进一步完成检测体系的表征。
1.6 检测体系的优化实验
分别设定β-环糊精梯度为0.1、0.5、1.0、5.0、10.0 μmol/L,TMB梯度为0.1、0.2、0.3、0.4、0.5 μmol/L,H2O2梯度为0.2、0.4、0.6、0.8、1.0 mol/L,以优化检测体系。除实验变量外,固定β-环糊精为0.5 μmol/L,TMB为0.5 μmmol/L,H2O2为1.0 mol/L,芘为50 μmol/L,反应时间为10 min,反应结束后测定680 nm处吸光度。
1.7 反应时间的优化实验
为研究反应时间对β-环糊精/AuNPs、TMB/H2O2和芘之间相互作用的影响,选择了0、20、100 μmol/L的芘与检测体系混合,反应时间分别为0、5、10、15、20、25、30 min后测定680 nm处吸光度。
1.8 水中常见离子的影响实验
为了研究水中常见的金属离子对检测体系的影响,在待测溶液中分别加入摩尔浓度为1 mmol/L的CaCl2、MgCl2、NaCl、KCl,并设定芘为100 μmol/L,反应10 min,测定680 nm处吸光度。
1.9 检测方法灵敏度实验
配置一系列已知摩尔浓度的芘标准溶液,其中芘分别为10、20、30、40、50、60、70、80、90、100 μmol/L,反应10 min后,测定680 nm处吸光度,以摩尔浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.10 实际水样的加标回收率实验及与传统方法的比较
在实际水样中分别添加10.0、20.0、50.0、100.0 μmol/L芘,采用此检测方法和气相色谱—质谱(GC/MS)分别测定其加标回收率,进行比较。
2 结果与讨论
2.1 β-环糊精修饰的AuNPs检测水中芘的原理
AuNPs溶液的颜色反映了其颗粒的聚集状况,这种聚集一般是受溶液中电解质的影响[22]。分散态的AuNPs颗粒表面会发生等离子体共振,从而在520 nm处有最大吸收峰,此时溶液呈红色。而AuNPs颗粒呈聚集状态时,粒径较大,AuNPs粒子之间的表面等离子体共振作用降低了电子激发所需要的能量,从而使AuNPs溶液的最大吸收波长发生移动,体系颜色变为蓝色[23]。
鉴于此,实验从修饰AuNPs开始,将β-环糊精连接到AuNPs表面。如图1所示,β-环糊精二级空间结构呈现碗状,内部有一个较大的空腔,体系中的芘可以嵌入到空腔中,形成稳定的复合结构。AuNPs首先与β-环糊精结合;由于β-环糊精对芘的分子识别作用,芘嵌入其疏水空腔中;当体系中存在TMB/H2O2时,会拉近β-环糊精腔体间的距离从而使AuNPs发生聚集,体系颜色由红色变为蓝色。

图1 β-环糊精修饰的AuNPs检测水中芘的原理示意图Fig.1 Schematic description for pyrene detection by the β-cyclodextrin modified AuNPs
2.2 检测体系的吸收曲线
首先对显色情况进行了研究,结果见图2。实验结果显示,用β-环糊精修饰AuNPs的基础上,无论β-环糊精单独与H2O2、TMB共存,还是催化TMB/H2O2的反应(混合液1~3),都没有明显的显色反应,溶液还是呈现出β-环糊精修饰的AuNPs的混合液4~6分别在混合液1~3的基础上加入了芘。混合液6颜色发生明显变化,长波区域的吸光度增加,AuNPs颗粒产生了一定程度的聚集。混合液7作为对照实验,在体系中没有H2O2和TMB,只有芘存在的情况下,颜色也没有发生明显的变化。因此,可以通过使用加入了H2O2、TMB和β-环糊精修饰的AuNPs来达到检测水溶液中芘的目的。

图2 检测体系的吸收曲线Fig.2 Absorption curve of detection system
本来颜色。可能是因为β-环糊精修饰的AuNPs失去了原本的催化活性,无法正常催化TMB/H2O2的显色反应。
2.3 β-环糊精修饰的AuNPs的透射电镜扫描结果
通过透射电镜对不同样品进行扫描,扫描结果见图3。

图3 不同处理下β-环糊精修饰的AuNPs的透射电镜扫描图Fig.3 Transmission electron microscope images of different β-cyclodextrin-modified AuNPs
当溶液中不含有芘时,β-环糊精修饰的AuNPs是规则的球形,并均匀分布在溶液中,H2O2和TMB的存在并没有影响β-环糊精修饰的AuNPs形态。
混合液4~7中有芘的加入,也没有使得体系中β-环糊精修饰的AuNPs发生明显的变化。连在AuNPs表面的β-环糊精中可能已经嵌入了芘,但是β-环糊精修饰的AuNPs之间没有发现有明显的相互作用。
当检测体系中H2O2和TMB同时存在时,芘的加入使得β-环糊精修饰的AuNPs发生了明显的聚集现象。进一步证明当体系中存在TMB/H2O2时,会拉近β-环糊精腔体间的距离使AuNPs发生聚集,从而使溶液的颜色也由红色变为蓝色。
2.4 β-环糊精浓度的优化结果
检测体系中β-环糊精的浓度影响着传感器的稳定性。β-环糊精通过巯基连在AuNPs的表面,其浓度对灵敏度有着较大影响,因此需要对β-环糊精的浓度进行优化。由图4可以看出,在β-环糊精为0.5 μmol/L时,检测体系的吸光度最大,而过量的β-环糊精可能会对AuNPs正常的聚合产生阻碍作用,所以选择0.5 μmol/L为β-环糊精最适摩尔浓度。

图4 β-环糊精对检测体系的影响Fig.4 Effect of β-cyclodextrin on detection system
2.5 TMB浓度的优化结果
TMB作为一种显色剂,会在强氧化剂的作用下发生颜色的变化。检测体系中H2O2的存在可能会引起TMB颜色的变化,从而影响整个检测体系颜色的变化。正是因为体系中TMB的浓度对反应最终颜色有较大影响,因此需要对其进行浓度优化。由图5可以看出,TMB低于0.3 μmol/L时,吸光度呈上升趋势;TMB超过0.3 μmol/L后,吸光度较为稳定。因此,选择0.3 μmol/L为TMB最适摩尔浓度。

图5 TMB对检测体系的影响Fig.5 Effect of TMB on detection system
2.6 H2O2浓度的优化结果
检测体系中H2O2的浓度对反应最终颜色也有较大影响,因此需要对其进行浓度优化。由图6可以看出,H2O2为0.8 mol/L时吸光度最大,且高于0.8 mol/L后吸光度略有下降,因此选择0.8 mol/L为H2O2最适摩尔浓度。

图6 H2O2对检测体系的影响Fig.6 Effect of H2O2 on detection system
2.7 反应时间的优化结果
制备好的AuNPs溶液放置过久,可能会发生沉降;且检测体系若需要较长的反应时间,也无法满足快速检测的需求。所以,考察了反应时间对检测体系的影响。
通过图7可以发现,在反应最初的10 min,吸光度随着时间延长增幅较大;反应时间超过10 min后,吸光度基本上不再增长且很快达到平衡。这说明在H2O2和TMB的作用下,β-环糊精空腔内嵌入芘的AuNPs已经全部产生聚集,溶液颜色也不会继续改变。综上所述,选择10 min为最佳反应时间。

图7 反应时间对检测体系的影响Fig.7 Effect of reaction time on detection system
2.8 水中常见离子的影响
离子强度可能对AuNPs的聚集情况产生一定影响,所以考察了水中常见的金属离子对检测体系的影响。由图8可以看出,在溶液中存在Ca2+、Mg2+、Na+、K+这些离子的情况下,吸光度并没有明显的变化。所以离子强度对该检测体系的结果几乎没有影响。

图8 常见离子对检测体系的影响Fig.8 Effect of ions on detection system
2.9 检测方法灵敏度
配置一系列已知浓度的芘标准溶液,所得的吸光度在低浓度和高浓度范围内变化趋势不太一致,所以分别绘制低浓度和高浓度芘标准曲线,结果见图9。芘处于低浓度与高浓度时,均与吸光度呈良好的线性关系。使用分光光度计检测的检测限为3.4 μmol/L。

图9 检测方法的灵敏度Fig.9 Sensitivity of the detection method
2.10 加标回收实验结果
由表1可见,此检测方法的加标回收率为96%~106%,相对标准偏差绝对值小于5%。同时用GC/MS平行测定相同样品3次,测得的加标回收率介于98%~110%。经过对比可说明该方法用于快速检测水中芘是可行的。
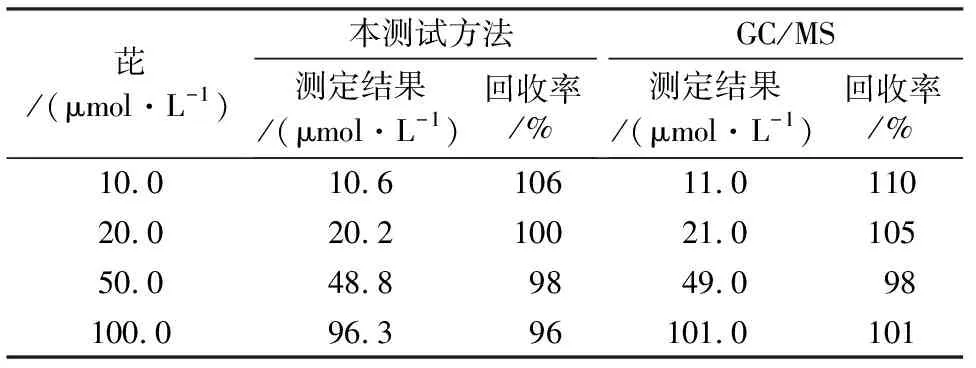
表1 本检测方法和GC/MS分别检测水中芘
3 结 语
以水中芘作为检测目标,将β-环糊精修饰到AuNPs表面,选取TMB、H2O2作为聚合剂,建立了一种简单、高效、快速检测水中芘的新方法。其原理是TMB、H2O2的存在改变了AuNPs在芘嵌入β-环糊精空腔后的距离,使得AuNPs颗粒产生聚集。随着反应的发生,AuNPs溶液颜色由红色变为蓝色,吸收曲线和特征吸收峰的吸光度也随之发生了改变。
此检测体系最适条件分别为0.5 μmol/L β-环糊精、0.3 μmol/L TMB、0.8mol/L H2O2,最佳反应时间10 min。使用分光光度计检测的检测限为3.4 μmol/L。在实际水样的检测中,芘的加标回收率为96%~106%,可以满足实际水样中芘的精确检测要求。

