类卒中:3例分析及文献回顾
武亚萍, 张医芝, 南善姬, 范 佳, 韩艳秋
随着急性缺血性脑卒中溶栓时间窗的延长及各级医院卒中中心的建立,静脉溶栓的病例不断增多。为了更好的静脉溶栓效果、更低的出血风险,缩短DNT时间成为各个卒中中心的重点工作。但DTN时间的缩短可能会导致短期内对疾病评判的错误,导致卒中的过度诊治问题。临床中非血管源性疾病而以类似卒中形式起病被称为类卒中(stroke mimics)。可见于多种情况,文献报道[1]偏头痛和癫痫发作是最常见的类卒中,其他包括内科疾病(低血糖、中毒代谢病)、晕厥、前庭神经病、感染、肿瘤、脱髓鞘病、功能性疾病等。有文献报道[2~6]:在静脉溶栓患者中类卒中的比率达到1%~16%。由于发病4.5 h内急性脑梗死静脉溶栓时间窗限制、由于静脉溶栓一定比率的症状性脑出血的发生,要求我们临床工作中一定注意早期准确快速识别类卒中。我们吉林大学白求恩第二医院自2017年1月至2018年9月初诊缺血性脑卒中而后被证实为类卒中31例,其中代谢、中毒性脑病9例,癫痫7例,前庭神经病变5例,心因性疾病2例,菌血症2例,脱髓鞘病2例,脑硬膜下脓肿1例,脊髓硬膜外血肿1例,主动脉夹层1例。本文重点介绍3个典型病例,供临床医生借鉴。
1 临床资料
病例1,男,46岁。因言语不清4 h就诊于当地医院,查头部CT后诊断为“脑梗死”,治疗后5 h出现右侧肢体活动不灵而转入我院。既往“糖尿病”病史2 m,吸烟、饮酒史20 y。入院时体温37.3 ℃,血压正常,意识清楚,不完全性混合性失语,右侧肢体肌力3级,无病理反射。患者因幽闭恐惧症未及时查头部MRI,肺CT示双肺炎症,血糖18.5 mmol/L,尿酮体(KET) 3+,尿葡萄糖(GLU) 4+,血白细胞总数 15.1×109/L,中性粒细胞百分比 88.0%,超敏C反应蛋白22.20 mg/L,诊断为脑梗死、糖尿病酮症、肺内感染,给予相应治疗。次日患者发热体温39.0 ℃,癫痫发作2次,出现嗜睡,用肺内感染无法解释临床改变。查头部MRI示双侧基底节区见斑点状长T1长T2信号影,左侧额顶颞枕部见条形长T1长T2信号影,DWI成像显示左侧额顶颞枕部颅板下见条形高信号为主的混杂信号影(见图1)。考虑颅内硬膜下脓肿可能性大,因患者患者病情进行性加重,神经外科行急诊手术治疗。手术中有豆腐渣样碎块,引流管引出浑浊液体约180 ml,抗感染治疗后好转出院。

左侧额顶颞枕部颅板下见条形长T1长T2信号影;弥散成像示见条形高信号为主的混杂信号影
病例2,男,70岁。因一过性左上肢不适、左下肢活动不灵5 h来急诊就诊,初步诊断为脑梗死。入院详细询问病史,患者发病早期有数分钟的一过性肩背部疼痛。既往高血压病20 y。查体:血压:175/100 mmHg,神经系统查体未见异常。双下肢动脉血管彩超:左下肢动脉粥样硬化伴斑块形成,左胫前动脉中远段、足背动脉闭塞。头部核磁提示颅内陈旧性多发脑梗死,双侧脑白质脱髓鞘改变,未见新发脑梗死征象;颈椎磁共振示颈椎退行性变、颈间盘突出、C7-T1椎体水平脊髓后方见长条状短T1短T2信号改变(见图2)。诊断不考虑缺血性脑血管病而考虑脊髓硬膜外血肿。患者行手术治疗,术中使用枪钳去除C7左侧椎板、T1左侧椎板近端,见暗红色出血覆盖于硬膜背侧,髓核钳取出,送检病理为坏死组织,最终诊断为:脊髓硬膜外血肿、高血压病3级(极高危险组)。术后患者疼痛明显减轻,随访近1 y,无肢体无力发作。
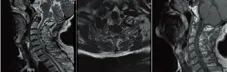
C7-T1椎体水平脊髓后方见长条状短T1短T2信号改变
病例3,女,55岁。因“抽搐、不能言语、右侧肢体活动不灵20 h”入院。既往癫痫病史4 y余,无其他病史及不良嗜好。入院查体:体温、血压正常,内科查体无异常。嗜睡,运动性失语,双侧瞳孔、眼位无异常,右侧鼻唇沟浅,伸舌稍偏右,右侧肢体肌力0级,肌张力低,双侧病理征阴性。当地头部CT未见出血,以脑梗死、癫痫收入院。发病后约30 h查头部MRI弥散成像未见异常高信号影,头部MRA示左侧大脑中动脉狭窄,头部核磁3D动脉自旋标记脑灌注成像未见异常(见图3)。脑电图示左侧颞区较多中至高波幅慢波、尖波、欠规则尖慢波散发或簇发,右侧颞区可见少量中至高波幅慢波、欠规则尖慢波散发,双侧不同步出现,左侧波幅低于右侧(见图4)。神经内科疾病诊断考虑脑梗死、癫痫(全面强直-阵挛发作)、左大脑中动脉严重狭窄。给予抗栓、抗癫痫、补液、保肝、抗感染治疗。患者虽然有癫痫发作,但瘫痪对侧大脑中动脉狭窄,瘫痪是Todd’s瘫痪还是缺血性脑血管病所致?于住院5 d复查头部MRI,仍未见新发脑梗死征象,患者逐渐好转,言语明显恢复,右侧肢体肌力基本恢复正常,可自行行走,明确诊断为Todd’s瘫痪、癫痫(全面强直-阵挛发作)。
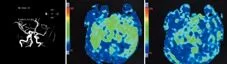
A:头MRA提示左侧大脑中动脉狭窄;B、C:头核磁3D动脉自旋标记脑灌注成像未见异常
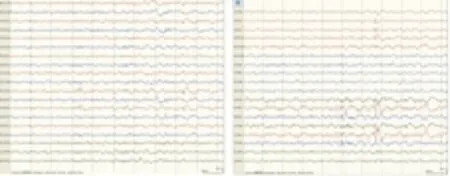
发作间期脑电图:左侧颞区中至高波幅慢波、尖波、欠规则尖慢波,右侧颞区可见少量中至高波幅慢波、小尖波
2 讨 论
非血管源性疾病而以类似卒中形式起病被称为类卒中。类卒中被列为溶栓治疗禁忌证中。类卒中包括多种疾病,各种疾病没有关联。我们描述的3个病例,除Todd’s瘫痪外,颅内硬膜下脓肿和脊髓硬膜外血肿对神经内科医生比较生疏,很容易误诊误治。
颅内硬膜下脓肿是一种罕见的疾病,占局部颅内感染的15%~20%。该病最常见的临床症状是发热、头痛、呕吐和意识改变。引起颅内硬膜下脓肿的原因常见的为硬膜下出血术后、鼻窦炎、耳源性疾病(慢性中耳炎和乳突炎),其它有外伤、脑膜炎、牙科疾病等。澳大利亚[7]一项十年36例患者调查中,11例(31%)有运动障碍。我们报告的这个病例,患者以语言障碍和偏瘫为主诉,起病较急,临床上符合急性卒中的起病形式,且发病早期2次头部CT均未见硬膜下异常密度影而只显示陈旧多发腔隙性脑梗塞,极易误诊为脑血管病。其后患者出现发热及两次癫痫发作,提示可能存在颅内感染可能。入院后经头部核磁检查才得以确诊。首诊误诊为急性缺血性卒中的原因:一是病史询问不详细(该患者病前有牙龈肿胀史),二是对患者感染征象未予充分重视。该病绝大多数需要广谱抗生素和手术治疗,报道病死率为4.4%~24%[8]。
脊髓硬膜外血肿是一种罕见的脊柱急症,占脊髓硬膜外占位性病变的1%以下[9]。尽管该病的确切发病机制尚待阐明,但是抗凝剂、溶栓剂和抗血小板剂与发病有关,血小板功能障碍、妊娠、血管畸形、肿瘤、系统性疾病如高血压、类风湿性关节炎等被认为是诱发因素,有些病例病因不清[10]。硬膜外静脉网被认为是血肿最可能的来源。发病年龄大多数在60~70岁左右,男性稍多。血肿的位置好发在C6-C7和T12,40岁以下可发生在腰骶段。血肿通常局限于3~4个节段。颈部和/或背部疼痛以及截瘫或四肢瘫痪是常见的临床表现。有不少报告描述了脊椎硬膜外血肿出现类似缺血性卒中的急性偏瘫的病例[11~13],椎管内卵圆形血肿向左或向右移位使脊髓受压,是引起偏瘫的原因[14 ]。有人[15]统计了16例出现类卒中的脊髓硬膜外血肿患者的早期临床表现,10 例(占62.5%)主诉为偏瘫,Horner综合征4 例,1例痛觉缺失,1例由于严重疼痛导致晕厥(似SAH)。有研究证实溶栓药的应用与继发脊髓硬膜外血肿的存在一定的关联性,所以早期鉴别脊髓硬膜外血肿和急性缺血性卒中非常重要。诊断靠病史查体及核磁检查。在急性偏瘫患者出现颈部疼痛或Horner综合征或Brown-Sequard综合征时应考虑到脊髓硬膜外血肿[16]。快速进展的病例是急诊手术的适应证。疾病相关死亡率在6%~8%之间,颈段或颈胸交界、心血管疾病、正在接受抗凝治疗及长节段血肿可能预示更坏的结果[13]。
Todd’s瘫痪是最为常见的类卒中[17]。是一种发生在癫痫患者身上的神经系统的异常,即在癫痫发生后出现的短暂瘫痪。该瘫痪可以是局部的也可以是全身的,但通常只发生在身体的一侧,它最常见于全身强直阵挛发作(大发作)和局灶性发作以后,癫痫发作后除了出现Todd’s瘫痪,也可引起凝视麻痹、失语、感觉障碍、视野缺损等神经系统功能障碍,这些表现可能会持续几个小时到24~36 h,甚至10 d[18,19]。最近的研究显示:癫痫发作后6.4%的患者发生Todd’s瘫痪,老年、痉挛性癫痫发作持续状态、既往卒中史是发生Todd瘫痪的独立危险因素[20]。如果Todd瘫痪发生在这种背景下,患者的神经系统的病情可能会被高估,从而导致溶栓疗法等错误的医疗措施。另一方面,临床工作中也一定要注意伴癫痫发作的缺血性卒中,避免静脉溶栓时间窗内的患者错过时机[21]。早期影像学的检查如 DWI/PWI MRI、MRA有助于鉴别诊断。病例3有癫痫病史,似乎诊断容易,但患者瘫痪对侧大脑中动脉狭窄,瘫痪不能除外急性缺血性脑卒中,经临床观察和2次头部MRI及核磁脑灌注成像才最终明确。
3 结 论
类卒中临床上用于描述类似卒中的非血管疾病。即表现为急性神经功能缺损的情况。仔细的临床评估(临床病史和神经系统检查)与实验室评估相结合对于类卒中是很重要的。脑成像对于急性缺血性脑卒中的正确诊断和排除类卒中至关重要。随着临床资料、实验室资料和磁共振成像(MRI)评估的使用,类卒中的误诊率将下降到较低的程度。医生之间讨论制度或建立卒中溶栓小组有助于减少早期卒中的过度诊治。有人提出了TM评分[22]法和FABS量表[23]来进行鉴别诊断。目前人们在试图寻找鉴别急性卒中和类卒中的生物标记物[24~26],希望未来类卒中与急性脑卒中的鉴别变得简单。
doi:10.1016/j. annemergmed. 2011.09.011.
doi:10.1161/STROKEAHA. 110.609 339.
doi:10.1159/000255975.
doi:10.1161/STROKEAHA. 108.530352.
doi:10.1016/j. jstrokecerebrovasdis. 2011.04.018.
doi:10.4103/2152-7806.166785.
doi:10.4137/JCNSD. S13252.
doi:10.1007/s13760-018-0939-3.
doi:10.1007/s12028-008-9083-x.
doi:10.11477/mf. 1416200652.
doi:10.1016/j. jemermed. 2016.12.001.
doi:10.1016/j. jstrokecerebrovasdis. 2017.04.008.
doi:10.1161/JAHA. 114.000838.
doi:10.1161/ STROKEAHA. 116.0138 42.
doi:10.1161/STROKEAHA 115.011687.
doi:10.1161/STROKEAHA. 115.009877.

