荞麦蛋白酶抑制剂α-螺旋对抗肿瘤活性的影响
崔晓东,范鑫,闫红,王转花,李晨
(1. 化学生物学与分子工程教育部重点实验室,山西大学 生物技术研究所,山西 太原 030006;2. 山西大学 生命科学学院生物工程系,山西 太原 030006)
0 引言
线粒体作为真核细胞不可或缺的供能细胞器,是细胞凋亡的激活系统,还具备合成胆固醇及血红素并调控细胞增殖和代谢的能力[1]。线粒体,拥有自身的遗传物质及遗传体系,但超过99%线粒体蛋白质由核基因编码,在胞质中合成前体蛋白,通过线粒体膜上的转运复合体转运进入线粒体[2-3]。其中,前导肽运输途径是胞内合成的线粒体前体蛋白质向线粒体基质运输的经典途径。线粒体外膜转位酶(translocase of outer mitochondrial membrane,TOM),是镶嵌在线粒体外膜上的转运复合体,负责将细胞质中合成的线粒体前体蛋白转运进线粒体。TOM 系统由一系列复合物组成,其中Tom20 和Tom22 负责识别具有N 端前导肽的线粒体前体蛋白,并传递给Tom40 通道,最终将前体蛋白转运进入线粒体不同区域发挥相应的作用[4-6]。线粒体蛋白转运异常,可以引起一系列的疾病,如丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)前导肽中第216 位氨基酸由精氨酸突变为脯氨酸后,进入线粒体的PDH 含量相对减少,导致丙酮酸脱氢酶缺乏症,是婴儿和儿童原发性乳酸酸中毒的最常见原因[7-8];原发性I 型高草酸尿症是由于谷丙转氨酶(alanine/glyoxylate aminotransferase 1,AGT)第11位脯氨酸突变为亮氨酸,产生弱的线粒体靶向序列,使该酶错误定位到线粒体,AGT 的错误定位破坏了过氧化物酶体功能,导致乙醛酸被氧化成草酸盐,并在肾脏和泌尿系统中沉积草酸钙,最终导致肾功能衰竭[9-10]。在肿瘤细胞中,线粒体功能异常与肿瘤细胞表现出的无限增殖、代谢异常、凋亡抵抗、侵袭及转移等恶性表型关系密切。目前已经发现一些具有线粒体靶向作用的抗肿瘤药物,如紫杉醇,多柔比星,喜树碱等,但这些药物通常是多靶点的,会带来一定的副作用,造成肿瘤的多药耐受[11];二氢叶酸还原酶可以被线粒体细胞色素氧化酶亚基信号序列导入到线粒体中[12],使线粒体功能异常。因此,靶向线粒体TOM 系统,通过改变或影响线粒体蛋白的转运,或引导异源蛋白进入线粒体,抑制线粒体正常功能,也是一种潜在的肿瘤治疗的方式。
重组荞麦胰蛋白酶抑制剂(recombinant buckwheat trypsin inhibitor,rBTI)是一种体外重组获得的分子量为7.9 kD 的Potato I 型蛋白酶抑制剂[13]。将rBTI 的胰蛋白酶抑制活性位点(45 位精氨酸)突变后,失去了对胰蛋白酶活性的抑制,但其对Hep G2 细胞增殖抑制作用未发生显著变化,表明rBTI的抑制活性位点不影响其对肿瘤细胞的增殖抑制作用,可能与rBTI 的其他结构有关[13-14]。随后研究发现,rBTI 可以通过诱导线粒体损伤并通过自噬作用将损伤线粒体清除,并且显著抑制多种肿瘤细胞增殖,免疫共沉淀结果表明,rBTI 可以与Tom20 相互作用[15]。晶体结构及氨基酸序列分析发现,rBTI的三维结构中存在一个α-螺旋(GSKAAKIIENE)[16],其性质与线粒体乙醛脱氢酶(aldehyde dehydrogenase,ALDH)N 端前导肽(pALDH)性质非常相似(如图1),我们推测该α-螺旋可能会介导rBTI 与线粒体的相互作用,是rBTI 抑制肿瘤增殖的活性区域。因此,对rBTI 的α-螺旋结构中的正电荷氨基酸(赖氨酸)在rBTI 抑制肿瘤增殖中的作用进行了研究,明确了该螺旋是rBTI 发挥抗癌活性的区域,并获得了两种对肿瘤细胞杀伤更加高效的突变体。该研究也为明确植物中Potato I 型抑制剂结构与抗肿瘤效应的研究提供新的视角,为靶向线粒体药物的设计及研发提供新的理论基础。

图1 rBTI 的α-螺旋与线粒体乙醛脱氢酶N 端前导肽的比较Fig. 1 Comparison of α-helix in rBTI with presequence peptide of aldehyde dehydrogenase
1 材料和方法
1.1 材料与试剂
pExSec I-BTI质粒为实验室构建保存。人肝癌细胞株Hep G2(实验室保存);DMEM 培养基(Gibico 公司);胎牛血清(杭州四季青公司);TaKa-Ra MutanBEST 突变试剂盒(TaKaRa,中国大连);胰蛋白酶和四甲基偶氮唑蓝(北京索莱宝公司);二甲基亚砜(DMSO),Na-苯甲酰-DL-精氨酸-对硝基酰胺盐酸盐(BApNA),胰蛋白胨,酵母提取物,NaCl,DNA 分子量标准,蛋白分子量标准,SanPrep柱式质粒DNA 小量抽提试剂盒,IPTG,Kana 等(Sangon Biotech,中国上海);E.coliBL21(DE3)实验室保存菌;内切酶BamHI,NdeI,T4 DNA 连接酶等(Thermo Fisher,美国)。其他试剂为国产试剂。
1.2 细胞培养
取出冻存于液氮中的人肝癌Hep G2 细胞株,并快速放入37 ℃水浴中,同时不断摇动加速其融化,接着以1 000 r/min 离心5 min,弃去保存液,加入1 mL 配制好的培养基(含有10%胎牛血清,100 U/L 青霉素、100 mg/L 链霉素),缓慢吹打至均匀。将细胞悬液转移到培养瓶中,加入一定量的培养基,混匀后放置在37 ℃,体积分数5%CO2培养箱进行培养。Hep G2 细胞贴壁生长,每2 天~3 天传代1次,取对数生长期的细胞进行实验。
1.3 rBTI突变体的重组表达及纯化
根据突变试剂盒说明书及rBTI 基因序列,设计BTI 第20 位、23 位赖氨酸单突变以及20/23 位双突变引物(见表1),并以pExSec I-BTI质粒为模板,进行PCR 扩增,扩增产物转化至E.coliDH5α 感受态细胞中,挑取单菌落进行扩增培养。质粒经测序后筛选突变正确的单克隆菌株,提取相应质粒,转化至E.coliBL21(DE3)感受态细胞中表达。将含有上述质粒的表达菌株在含终浓度为25 mg/L 卡那霉素的LB 培养基中培养(37 ℃,180 r/min)至OD 值为0.6 时,加入IPTG(终浓度为0.5 mmol/L)继续培养3.5 h。超声破碎后,离心收取上清液,置于80 ℃恒温水浴锅中加热出去部分杂蛋白,再经阴离子交换层析分离纯化rBTI 及突变体蛋白。

表1 rBTI的突变引物Table 1 Mutation primers for rBTI
1.4 rBTI对胰蛋白酶抑制活性分析
通过胰蛋白酶对底物BApNA 的水解速率测得rBTI 及突变体对胰蛋白酶的抑制活性[13]。测活体系 包 括4.4 mL 缓 冲 液(0.1 mol/L Tris-HCl,pH8.0,含0.01 mol/L CaCl2),加入同浓度20 μL 的rBTI 或突变体样品和1 mg/mL 胰蛋白酶,充分混匀水浴10 min。加入BApNA 底物至其终浓度为0.15 mol/L ,混匀后水浴10 min,加入500 μL 的乙酸(33%)终止反应。405 nm 处检测BApNA 水解产物p-Nitroanilide 的OD 值。测定rBTI 及突变体的抑制常数Ki,rBTI 及突变体的浓度分别为0.05,0.1,0.2,0.3 μmol/L,测得的底物BApNA 浓度分别为1×10-5μmol/L 和2×10-5μmol/L。以rBTI 或突变体浓度为横坐标,1/V为纵坐标作图,交点对应的横坐标即为-Ki。实验中水浴温度均为37 ℃。
1.5 圆二色谱分析
在0.1 cm 的石英比色皿中加入rBTI 及突变体,其浓度为0.2 mg/mL,并通过Chirascan qCD 扫描195 nm~260 nm 区域,扫描重复3 次。3 次扫描的平均值减去试剂本底值(缓冲液PBS)为最终结果。测试不同样品时,用PBS 多次冲洗确保测试准确。
1.6 rBTI中螺旋区多肽的合成
为了进一步确定rBTI 中α-螺旋是否是抑制肿瘤增殖的活性区域,对rBTI 的α-螺旋区的11 个氨基酸进行了人工合成,同时合成了该螺旋区段中赖氨酸分别变为丙氨酸的多肽(表2)。多肽由Sangon Biotech(中国上海)合成N-9-芴甲氧羰基(FMOC)化学的固相方法。质谱鉴定多肽的分子量,最终获得的多肽纯度在95%以上,通过反相高效液相色谱(RP-HPLC)测得。

表2 来源rBTI及突变体中的多肽序列Table 2 Amino acid sequences of the peptides from rBTI and mutants
1.7 MTT实验
取对数生长期Hep G2 细胞,接种于96 孔板(每孔100 μL)约5×103个细胞,37 ℃,体积分数为5%CO2培养箱培养。细胞贴壁后,分别用不同浓度rBTI、rBTI-K20A、rBTI-K23A 和rBTI-K20A/K23A处理(或合成多肽),同时设空白对照组,每孔终体积为200 μL,置于培养箱24 h。取0.5%MTT 溶液于每孔20 μL,置于培养箱4 h,移除孔中液体,将DMSO 加入孔中,每孔150 μL ,室温缓速振至结晶物完全溶解,酶标仪测定490 nm 处的OD 值。实验重复3 次并按照公式计算细胞存活率。实验中未标明温度时,均在37 ℃下进行。细胞存活率(%)=A实验组/A对照组×100%。
1.8 ATP含量测定
按每孔5 000 个细胞,将细胞接种于不透光的96 孔板,待细胞贴壁后,分别用25 μg/mL 和50 μg/mL 的rBTI 及3 种突变体(或合成多肽)处理细胞48 h,弃去培养基,每孔再加入100 μL 新鲜DMEM培养基,室温平衡30 min。加入已混匀好的Cell Titer-Glo®试剂100 μL,摇床震荡培养2 min 充分裂解细胞,再置于室温孵育10 min,用酶标仪进行检测发光信号。实验至少重复3 次。肿瘤细胞存活率计算方法为:细胞ATP 相对含量(%)=A实验组/A对照组×100%。
1.9 细胞转染及线粒体形态分析
接种适量的对数期Hep G2 细胞悬液于6 孔板,每孔补加培养基至2 mL,当细胞生长到约80%时,执行转染程序。4 μg pDsRed2-Mito 质粒和6 μL 转染试剂混合均匀,加入400 μL 无血清培养基,孵育20 min。在不移除原培养基基础上,向每孔分别加400 μL 提前配置的混合液,然后轻摇混匀,并继续培养24 h。6 孔板中加入适量的上述的转染细胞悬液,当Hep G2 贴壁后,分别用处理好的50 μg/mL的rBTI 及其突变体作用于细胞12 h。移除培养基,加入提前放置室温下的PBS,轻晃5 min,漂洗3 次。室温下用Hoechst 33 258(15 μg/mL)染核10 min,再漂洗3 次。滴5 μL 抗荧光猝灭封片剂至载玻片,激光共聚焦显微镜下观察。
1.10 统计学分析
计量数据以平均数±标准差(mean±SD)表示,所有图形结果至少通过3 次独立实验获得。用SPSS 13.0 统计学软件分析各组数据(t 检验),参照各自对照组:*P<0.05 为差异显著,**P<0.01 为差异极显著。
2 结果
2.1 rBTI及突变体的重组制备
按照1.3 的方法,采用定点突变以及大肠杆菌表达系统,分别制备rBTI 及3 种突变体。测序正确的4种菌株,蛋白质均以可溶形式表达。根据rBTI 热稳定性较好的特点[13],将破碎后的菌液,12 000 r/min 离心10 min,上清液放置80 ℃加热30 min,4 ℃冷却20 min,12 000 r/min 离心除去沉淀蛋白,再采用ResourceTMQ阴离子柱对上清液进行纯化,经脱盐后得到所需蛋白。SDS-PAGE 检测纯化的蛋白,结果如图2 所示,rBTI及3 种突变体都得到了较纯的样品。

图2 SDS-PAGE 分析rBTI 及其突变体。M 为蛋白Marker;泳道1 为纯化的rBTI 蛋白;泳道2 为纯化的rBTI-K20A蛋白;泳道3 为纯化的rBTI-K23A 蛋白;泳道4 为纯化的rBTI-K20/23A 蛋白Fig. 2 SDS-PAGE analysis of rBTI and its mutants. M:Molecular markers;lane 1:purified rBTI;lane 2:rBTIK20A;lane 3:rBTI-K23A;lane 4:rBTI-K20A/K23A
2.2 rBTI及其突变体对胰蛋白酶的抑制活性没有发生改变
如图3A 所示,rBTI 及其突变体对胰蛋白酶的抑制活性基本相同,没有显著变化。采用Dixon 作图法,得到rBTI 及突变体的抑制常数Ki。rBTI、rBTI-K20A、rBTI-K23A 和rBTI-K20A/K23A 对胰 蛋 白 酶Ki分 别 为2.89×10-8mol/L,2.17×10-8mol/L,2.14×10-8mol/L 和2.77×10-8mol/L(图3B-E)。突变前后,rBTI 的Ki数量级皆为10-8mol/L,抑制常数Ki并没有发生明显改变,说明rBTI 及突变体均能与胰蛋白酶形成稳定的复合物。同时也说明,该螺旋区域中赖氨酸分别或同时突变为丙氨酸后,并未对rBTI 发挥抑制活性的Loop 环形成影响,因此未影响其抑制活性。

图3 rBTI 及其突变体对胰蛋白酶的抑制活性。(A)比较rBTI 及其突变体的抑制活性;(B-E)rBTI 及其突变体对胰蛋白酶活性抑制的动力学分析结果Fig. 3 Inhibitory activity of rBTI and its mutants to trypsin.(A)Comparison of inhibitory activity of rBTI and mutants.(B-E)Kinetic analysis of trypsin inhibition by rBTI and mutants
2.3 rBTI及其突变体二级结构未发生变化
采用圆二色光谱对rBTI 二级结构进行分析,结果 如 图4 所 示,在208 nm 存 在 一 个 负 峰,rBTI 及 突变体的二级结构特征也并未发生明显变化。丙氨酸(A)也具有形成螺旋的潜力,这说明赖氨酸(K)突变为丙氨酸(A)后并未使其结构发生改变。

图4 rBTI 及其突变体的圆二色光谱分析Fig. 4 Far-UV CD spectras of rBTI and mutants
2.4 rBTI 螺旋区赖氨酸单突变显著增强了其对Hep G2细胞的抑制及ATP含量减少
采用MTT 检测了rBTI 及突变体对Hep G2 细胞增殖的抑制作用(图5A)。如图5A 所示,rBTI 及其突变体分别处理24 h 后,Hep G2 细胞的增殖以浓度梯度增加的方式被抑制。与野生型rBTI 相比,第20 位和23 位赖氨酸单突变的两种突变体均表现出对Hep G2 细胞更强的抑制作用,但第20 位和23 位赖氨酸同时突变的rBTI-K20A/K23A 对细胞的增殖抑制作用并没有增强,与野生型相当。测定了rBTI 及其突变体对Hep G2 的ATP 含量的影响(图5B)。如图5B 所示,与对照组相比,rBTI 及其突变体均引起ATP 含量明显下降。与对照组相比,rBTI-K20A 和rBTI-K23A 对 细 胞 内ATP 含 量 影 响最大,而双赖氨酸突变体rBTI-K20A/K23A 与野生型rBTI 相 似,相 较 于rBTI-K20A 和rBTI-K23A 对ATP 的影响明显减弱。这与MTT 实验结果一致。
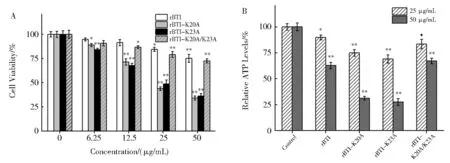
图5 rBTI 及其突变体对Hep G2 细胞活性及ATP 含量的影响。参照各自对照组:*P<0.05 为差别有显著性,**P<0.01 为差别具有极显著Fig. 5 Effect of rBTI and mutants on the cell viability and ATP content of Hep G2 cells. *P <0.05,**P <0.01,versus respective controls
2.5 rBTI赖氨酸单突变体显著减少线粒体数量
之前已经证实,rBTI 可以靶向线粒体引起线粒体自噬,减少线粒体数量。将pDsRed2-Mito 质粒转染Hep G2 细胞,观察rBTI 及突变体作用后,线粒体形态及数量的变化。如图6 所示,对照组中,Hep G2 细胞中线粒体呈网状和点状,数量较多,在胞质中均匀分布。rBTI 及突变体处理Hep G2 细胞后,线粒体形态及数量均发生较大的变化,其中rBTIK20A 和rBTI-K23A 对Hep G2 细胞线粒体形态及数量的影响最为显著。
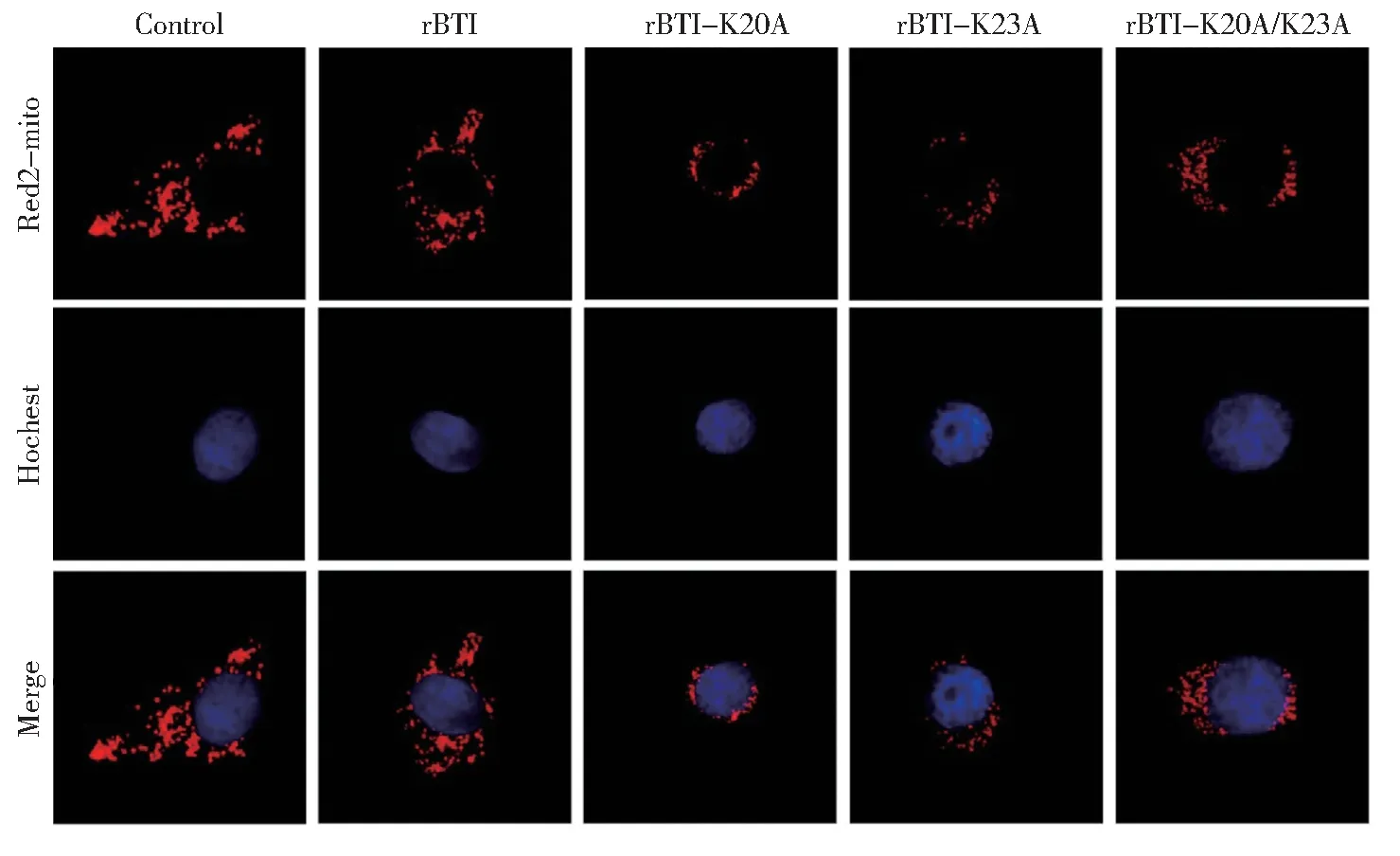
图6 rBTI 和突变体Hep G2 细胞线粒体的形态的影响Fig. 6 Mitochondrial morphology of Hep G2 cells affect by rBTI and mutants
2.6 人工合成的rBTI 及突变体α-螺旋区对细胞增殖也具有显著影响
通过人工合成了rBTI 螺旋区的多肽以及相应位点突变的多肽,采用MTT 的方法,进一步验证是否rBTI 单独的α-螺旋区可以发挥抑制肿瘤增殖的作用。如图7A 所示,多肽P2和P3对Hep G2 细胞增殖表现出与野生型多肽P1相似的抑制作用,但多肽P4对Hep G2 细胞增殖几乎没有抑制作用。ATP 实验结果分析表明,与对照组相比,P1,P2及P3多肽均引起线粒体ATP 含量明显下降;在处理24 h 后,赖氨酸单突变多肽P2和P3对ATP 含量影响与野生型P1基本相当,50 μg/mL 的浓度影响效果最为显著,而赖氨酸双突变多肽P4对ATP 的影响则明显减弱。这与多肽的MTT 结果基本一致,进一步证明了rBTI 的α-螺旋区发挥着抑制肿瘤增殖的作用。

图7 来源于rBTI 及其突变体的螺旋区多肽对Hep G2 细胞活性及ATP 含量的影响。参照各自对照组:*P<0.05 为差别有显著性,**P<0.01 为差别具有极显著Fig.7 Effects of peptides from rBTI and mutants on the cell viability and ATP content of Hep G2 cells. *P <0.05,**P <0.01,versus respective controls
3 讨论
蛋白酶抑制剂广泛存在于植物、动物和微生物中,可与酶结合形成蛋白质复合物,在很多重要的生命活动中发挥着重要作用,如细胞凋亡的调控、调节体内蛋白酶活性等[17-18]。目前,已经成功分离了大量的植物源蛋白酶抑制剂,其中丝氨酸蛋白酶抑制剂居多,它们在植物的营养器官中含量非常丰富。很多学者对蛋白酶抑制剂的抗癌作用及药用价值进行了研究,其中荞麦蛋白酶抑制剂具有显著的生物学功能,不仅可以调节体内蛋白酶的活性以保护机体,还具有明显的抑制肿瘤细胞增殖的作用[19-20]。
rBTI 的α-螺旋区(GSKAAKIIENE)的氨基酸组成和性质与线粒体蛋白N 端前导肽相似,该螺旋呈两亲性,在亲水面存在正电荷氨基酸,满足Tom 20 与Tom 22 的识别条件。Tom 20 可识别线粒体蛋白前导肽的疏水侧面,而Tom22 识别前导肽亲水侧正电荷氨基酸,随后TOM 其他复合物将含前导序列的线粒体蛋白转运进入细胞[21]。为了了解rBTI 的α-螺旋区正电荷对其抑制肿瘤增殖的影响,我们在不影响rBTI 结构及抑制活性的情况下,将rBTI 螺旋区中20 位和23 位的氨基酸进行单点突变与多点突变,均突变为丙氨酸Ala,得到3 种不同的突变体。与野生型相比,单突变体rBTI-K20A 和rBTI-K23A 可以大大增强对Hep G2 细胞增殖抑制率,并大大减少了线粒体的数量。rBTI-K20A/K23A 这一突变体对Hep G2 抑制肿瘤增殖效应仅与野生型rBTI 相当。同时,采用人工合成的方法得到相应的野生型rBTI 及突变型的α-螺旋的多肽,进一步证实了单独的α-螺旋区多肽可以显著抑制肿瘤细胞增殖。因此确认α-螺旋是rBTI 发挥抗肿瘤活性的区域,可以显著影响肿瘤细胞的线粒体形态。采用等温滴定的方法研究了rBTI 中α-螺旋区多肽与Tom20 的相互作用,发现将rBTI 中α-螺旋区中的赖氨酸分别突变为丙氨酸后(rBTI-K20A 和rBTI-K23A),会增加多肽与Tom20 的结合常数,而将两个赖氨酸都变为丙氨酸后(rBTI-K20A/K23A),其结合常数与野生型相似,这一结果与MTT 结果和ATP 含量的结果一致,即α-螺旋与Tom20 的结合常数越大,其对肿瘤细胞的抑制作用也越强。但rBTI 及突变体是否定位于线粒体的不同区域,我们还无法通过实验进行验证,也是下一步要解决的关键问题。人工合成多肽P4 抑制细胞增殖的作用几乎消失,可能与其正电荷的完全消失,不能由胞外进入胞内,阻断其发挥抗肿瘤功能有 关[22-24]。Tom 20 和Tom 22 与 线 粒 体 前 导 肽 的不同部位结合,但二者识别部位会不会存在相互影响还未知[25],因此在后续研究中应系统探究这一问题。
4 结论
rBTI 的α-螺旋区具有线粒体前导肽的性质和功能,尤其是螺旋区正电荷对其发挥抗肿瘤活性起着非常重要的作用。
rBTI 的α-螺旋区正电荷赖氨酸的单突变(rBTI-K20A 和rBTI-K23A),可以引起更大的线粒体损伤,最终抑制肿瘤细胞的增殖。

