骨形态发生蛋白-6对转化生长因子-β2所致视网膜色素上皮细胞迁移的影响△
吉梦 刘明 马波 刘轩 裴澄 陈丽
增生性玻璃体视网膜病变(PVR)是各种细胞在视网膜前、后表面及玻璃体内增生蔓延形成纤维细胞膜,继而引起视网膜的收缩、牵拉,进一步导致牵拉性或复发性视网膜脱离(RD)的复杂眼科疾病[1]。其中视网膜色素上皮 (RPE)在玻璃体内生长因子和细胞因子的作用下,发生上皮间充质转化(EMT)和细胞外基质 (ECM )合成是PVR形成的关键环节[2-3]。由于PVR 的最终预后极差,对其早期防治是目前研究的主旨,而药物干预更是近年来研究的热点。药物防治PVR一直都受到广泛的关注,主要集中在抗炎、抗增殖、抑制EMT、拮抗细胞因子、信号通路抑制剂等,大多局限在基础研究阶段,且目前临床试验暂未发现有药物能够有效防治PVR。
转化生长因子-β2(TGF-β2)在PVR患者的视网膜前膜中异常高表达,并被标记为EMT的诱导因子,目前已作为RPE细胞纤维化模型的主要诱导因子[4]。我们课题组前期研究发现,骨形态发生蛋白(BMP)-6可以减轻氧化应激损伤[5]。氧化应激可以导致RPE细胞的损伤,也可以加剧TGF-β2所致的RPE细胞纤维化[6]。所以本研究拟在既往研究的基础上,运用siRNA干扰BMP-6的表达,构建BMP-6过表达质粒,进一步从正反两方面观察BMP-6对 RPE细胞迁移的影响,为PVR的防治提供理论基础。
1 材料与方法
1.1 主要试剂与仪器RPE细胞株(美国ATCC公司),DMEM培养基/F12 、胎牛血清(FBS) (Gibco公司,美国),BMP-6(NM_001718)克隆质粒(优宝生物,重庆),TGF-β2 (PeproTech公司,美国),兔多克隆抗体GAPDH(杭州贤至生物科技有限公司),兔多克隆抗体BMP-6(Affinity公司,美国),HRP标记的羊抗兔二抗(武汉博士德生物工程有限公司),恒温培养箱(MCO-15AC,三洋生物有限公司,北京),Transwell小室(8 μm,美国康宁),倒置显微镜[IX51,奥林巴斯(中国)有限公司],PCR仪(EDC-810,东胜创新生物有限公司,北京)。
1.2 方法
1.2.1 细胞培养及分组生长状态良好的RPE细胞使用常规DMEM/F12培养基(含体积分数10%胎牛血清、0.1 U·L-1青霉素和链霉素)在37 ℃、含体积分数5%CO2饱和湿度条件下培养,次日贴壁生长后更换为无血清培养液培养24 h。取处于对数生长期的细胞消化,无血清培养基重悬细胞,细胞计数板计数,用无血清培养基稀释细胞浓度至5×105个·mL-1备用。细胞分组:(1)对照组:加入正常培养基培养48 h;(2)TGF-β2组:培养基中加入5 μg·L-1TGF-β2培养48 h;(3)BMP-6 siRNA组:转染BMP-6-homo-1087后培养48 h;(4)BMP-6过表达组:转染BMP-6过表达质粒后培养48 h;(5)TGF-β2+BMP-6过表达组:转染BMP-6过表达质粒24 h后,加入5 μg·L-1TGF-β2继续培养48 h。
1.2.2 BMP-6 siRNA的构建及筛选取处于对数生长期的RPE细胞用培养基制成单细胞悬液,按每孔5×105个细胞均匀接种到6孔板中,37 ℃、含体积分数5%CO2饱和湿度条件下培养至60%密度,换成无血清相应培养基饥饿2 h后分别转染小片段BMP-6-homo-1087、BMP-6-homo-1634、BMP-6-homo-885(基因序列见表1),同时设置对照组,培养48 h后,RT-PCR 检测BMP-6 mRNA 的表达水平,具体为:Trizol法提取所有转染基因组和对照组细胞的RNA,逆转录成cDNA,反应条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 30 s,60 ℃ 30 s,40 个循环。最终数据以2-△△Ct进行分析。引物序列:BMP-6上游引物为5’-CTTACGACAAGCAGCCCTTC-3’,下游引物为5’- ATCTGAAGCACTGGAGACCC-3’;GAPDH上游引物为5’-TCAAGAAGGTGGTGAAGCAGG-3’,下游引物为5’- TCAAAGGTGGAGGAGTGGGT-3’。选取抑制效果最好的片段用于后续实验。

表1 BMP-6 siRNA的基因序列
1.2.3 BMP-6过表达质粒的构建及鉴定质粒pIRES2-ZsGreen1和目的片段homo BMP-6(BamHI/Xho1)用BamHI和Xho1进行双酶切,凝胶回收纯化,将回收纯化的目的片段homo BMP-6(BamHI/Xho1)与回收纯化的载体pIRES2-ZsGreen1(BamHI/Xho1)连接,连接产物命名为pIRES2-ZsGreen1-homo BMP-6。鉴定引物为测序的通用引物,上游引物在CMV区,距离MCS区74 bp,下游引物在IRES区,距离MCS区101 bp,目的序列1542 bp, PCR产物大小约1700 bp。引物及序列:CMV-F:5’-CGCAAATGGGCGGTAGGCGTG-3’; IRES-R:3’-CCTCACATTGCCAAAAGACG-5’。鉴定合格后,大规模提取质粒pIRES2-ZsGreen1-homo BMP-6,用于后续实验。
1.2.4 Transwell 迁移实验检测细胞的迁移无血清培养基重悬细胞,细胞计数板计数,用无血清培养基稀释细胞浓度至5×105个·mL-1备用;600 μL完全培养基加入下室,在Transwell小室上室分别加入200 μL上述无血清细胞悬液,分组处理后,于37 ℃、含体积分数5% CO2培养箱中培养48 h;取出Transwell小室,PBS小心清洗小室一遍,体积分数70%冰乙醇溶液固定细胞1 h;用5 g·L-1结晶紫染液染色,室温下放置20 min,PBS清洗,用干净的棉球将上室一侧的未迁移的细胞擦干净,显微镜下观察拍照。
1.2.5 Western blot 测定蛋白的表达对照组和5 μg·L-1TGF-β2组RPE细胞培养48 h后,RIPA细胞裂解液裂解各组RPE 细胞后,于4 ℃、12 000 r·min-1离心 15 min,收集上清液。 BCA定量试剂盒检测蛋白浓度,取20 μg蛋白样品,在聚丙烯酰胺凝胶中电泳,将蛋白转移至PVDF膜上,50 g·L-1脱脂奶粉于室温下封闭1 h,以相应一抗BMP-6于4 ℃孵育过夜,并进行化学发光。采用ImageJ 软件检测条带灰度值,以GAPDH为内参,分别计算各目的蛋白的相对表达量。

2 结果
2.1 RT-PCR检测验证BMP-6 siRNA 转染 RPE细胞后BMP-6 mRNA的水平变化RT-PCR 检测不同小片段BMP-6 siRNA 转染 RPE 细胞后BMP-6 mRNA 的表达情况,结果显示,对照组RPE细胞中BMP-6 mRNA的表达水平为1.00±0.00,转染BMP-6-homo-1087、BMP-6-homo-1634、BMP-6-homo-885后,RPE细胞中BMP-6 mRNA相对表达水平均显著降低,分别为0.29±0.03、0.73±0.13和0.59±0.06,与对照组相比差异均具有统计学意义(均为P<0.05),且转染BMP-6-homo-1087后对BMP-6 mRNA表达的抑制率最高,所以选择BMP-6-homo-1087用于后续实验。
2.2 TGF-β2对RPE细胞迁移的影响显微镜下可以看到,对照组RPE细胞呈多角形,生长比较规则,TGF-β2组RPE细胞形态发生改变,呈现典型的纺锤形变化(图1A、图1B)。
Transwell法检测细胞迁移结果显示,对照组迁移细胞数为(63.67±4.04)个,TGF-β2组迁移细胞数明显增多,为(122.00±5.57)个,两组迁移细胞数相比差异有统计学意义(t=14.69,P=0.000)(图1C、图1D)。

图1 TGF-β2对RPE细胞形态及迁移能力的影响 A:显微镜下观察对照组RPE细胞形态(×100);B:显微镜下观察TGF-β2组RPE细胞形态(×100);C:Transwell 法检测对照组细胞迁移情况(×200);D:Transwell 法检测TGF-β2组细胞迁移情况(×200)。
2.3 TGF-β2对BMP-6蛋白表达的影响Western blot检测结果见图2。对照组RPE细胞BMP-6的蛋白表达水平为0.70±0.08,TGF-β2组BMP-6蛋白表达水平显著降低,为0.41±0.13,两组相比差异有统计学意义(t=3.249,P=0.031)。由此可见,TGF-β2作用后RPE细胞中BMP-6蛋白表达水平明显下降。

图2 Western blot检测TGF-β2对RPE细胞BMP-6蛋白表达的影响
2.4 BMP-6 siRNA作用后对RPE细胞迁移的影响对照组RPE细胞形态正常,而经过 BMP-6 siRNA作用后RPE细胞形态发生改变,亦呈现典型的纺锤形变化(图3A、图3B),与TGF-β2作用后变化相似。
Transwell法检测细胞迁移结果显示,对照组迁移细胞数为(57.00±7.00)个,而BMP-6 siRNA组迁移细胞数明显增加,为(115.67±1.53)个,两组相比差异具有统计学意义(t=14.18,P=0.000)(图3C、图3D)。

图3 BMP-6 siRNA对RPE细胞形态及迁移力的影响 A:显微镜下观察对照组RPE细胞形态(×100);B:显微镜下观察BMP-6 siRNA组RPE细胞形态(×100);C:Transwell 法检测对照组细胞迁移情况(×200);D:Transwell 法检测BMP-6 siRNA组细胞迁移情况(×200)。
2.5 BMP-6过表达对TGF-β2所致RPE细胞迁移的影响对照组、TGF-β2组、BMP-6过表达组、TGF-β2+BMP-6过表达组细胞迁移数分别为(60.00±6.25)个、(112.00±9.64)个、(44.33±5.51)个、(90.33±3.51)个。与对照组相比,TGF-β2组细胞迁移数增加,差异具有统计学意义(P<0.001);与对照组相比,BMP-6过表达组细胞迁移数略有减少,但差异无统计学意义 (P=0.076);与TGF-β2组相比,TGF-β2+BMP-6过表达组细胞迁移数减少,差异具有统计学意义(P=0.016)(图4)。
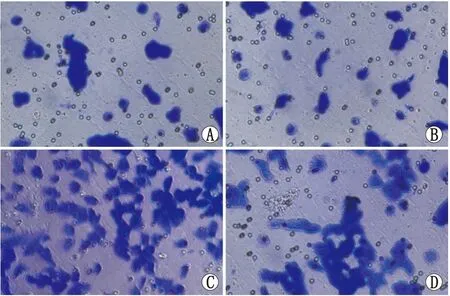
图4 Transwell 法检测BMP-6过表达对TGF-β2所致RPE细胞迁移能力的影响(×200) A:对照组;B:BMP-6过表达组;C:TGF-β2组;D:TGF-β2+BMP-6过表达组。
3 讨论
本研究首次发现BMP-6可以阻止TGF-β2诱导的RPE细胞的迁移。本研究结果证实了BMP-6过表达可以抑制TGF-β2所致的RPE细胞的迁移,而且在体外,BMP-6 siRNA干扰BMP-6后可以促进RPE细胞的迁移。
本研究结果显示,TGF-β2作用后RPE细胞形态发生改变,呈现典型的纺锤形变化;RPE细胞经过 BMP-6 siRNA作用后,细胞形态发生改变,亦呈现典型的纺锤形变化。正常情况下,RPE细胞呈六边形,整齐排列,即所谓的铺路石样,在相差显微镜的亮视野下可观察到明显的色素形成,并且在细胞表面表达钙黏附蛋白E(E-cadherin) 等上皮的特征性蛋白;当发生EMT时,细胞逐渐丢失了上皮的特征,形状呈梭形,排列松散,这种细胞稳定性差,极易迁移至玻璃体并改变细胞周围基质的环境,促进视网膜前膜的形成,而前膜的收缩导致牵拉性RD,这是PVR的发病机制,也是影响内眼手术治疗效果的重要因素[7]。
TGF-β2在视网膜纤维化进程中的 RPE 细胞去分化、ECM 合成和视网膜收缩过程中发挥重要作用[8],且视网膜和玻璃体中TGF-β2 的表达水平与PVR的严重程度相关。TGF-β在诱导RPE细胞向肌成纤维细胞表型转化中起作用,这与纤维化并发症,如PVR有关[9]。
BMP信号通路不仅参与正常组织的生长和发育,还与多种肿瘤的发展有关,与肿瘤及肾脏组织的增殖及纤维化密切相关[10],但有关 BMP信号通路在PVR发病中扮演的角色还有待阐明。我们既往研究发现,氧化应激可以明显地抑制BMP-6的表达,且在体外,BMP-6可以通过MAPK及Smad信号通路对抗氧化应激所致的细胞凋亡,起到保护RPE细胞的作用[11-12]。
在很多研究中发现,BMP可以对抗TGF所致的细胞的EMT。Shu等[13]研究发现,BMP-7可以抑制TGF-β2所致的晶状体上皮细胞的纤维化。在癌细胞侵袭方面,有学者也证实了BMP信号通路与 TGF-β 所起的作用是相互对抗的[14]。Song等[15]最新研究发现,过表达BMP-7可以通过Wnt3/β-catenin信号通路逆转TGF-β所致的EMT。
Dendooven等[16]研究发现,内源性BMP-6的丢失可以加重肾脏的纤维化;Liu等[17]研究也发现,降低BMP-6表达可以促进乳腺癌细胞的EMT,进而导致乳腺癌细胞耐药性的产生;但目前没有见到BMP-6对RPE细胞EMT抑制作用的相关研究。在针对RPE细胞的研究中,Yao等[18]发现,在11比例培养的 ARPE-19和原代人RPE细胞中加用BMP-4可以抑制TGF-β诱导的EMT。BMP抑制剂Gremlin可以促进RPE的增殖及新生血管的形成[19]。但在RPE细胞中,BMP-6可否逆转RPE细胞的纤维化的研究尚未见报道。本研究结果显示,通过正向即BMP-6过表达,反向即BMP-6干扰后均证实了BMP-6可以起到影响RPE细胞迁移的相关作用,而且BMP-6过表达可以对抗TGF-β2所致RPE细胞的迁移。
总之,我们的研究首次在RPE细胞中发现BMP-6可以逆转TGF-β2所致RPE细胞的迁移,具体是通过什么样的信号通路起作用的有待进一步研究。本研究结果强调了一种潜在的新机制来预防RPE细胞的纤维化,为PVR的防治提供新的视角。
——一道江苏高考题的奥秘解读和拓展

