奶油栓孔菌的鉴定及其生物学特性
郝金斌,孟国良,吴龙月,叶丽云,吴小平
(福建农林大学 菌物研究中心,福建 福州 350002)
奶油栓孔菌(Trameteslactinea)是一种白色腐生菌,隶属于担子菌门(Basidiomycota)蘑菇纲(Agaricomycetes)多孔菌目(Polyporales)多孔菌科(Polyporaceae)栓孔菌属(Trametes),主要分布在中国、马来西亚、印度尼西亚、菲律宾、巴基斯坦、印度、澳大利亚等国家[1-2]。奶油栓孔菌喜生长于阔叶树木材上,利用其菌丝分泌的胞外酶降解木材中的木质素、纤维素及半纤维素等形成养分,参与生态系统的再循环过程,对维持生态系统平衡起着关键作用[3]。同时,奶油栓孔菌能增强天麻等兰科植物种子的萌发能力,具有一定的经济价值[4]。研究表明,奶油栓孔菌含有肽、甾体、萜类、黄酮、酚类和糖类化合物[5-6]等,具有丰富的营养成分。在生物活性方面,奶油栓孔菌具有提高免疫力[7]、降血糖[8-9]和抗癌[10]能力,且其子实体多糖对酒精性肝损伤具有一定的预防效果[11]。大型真菌主要依靠外观形态学观察和分子生物学方法来进行分类鉴定,但真菌表观形态易受环境影响,同一物种的形态可能呈现较大差异。分子生物学技术受环境影响较小,准确性高,目前用于真菌分类鉴定的分子生物学技术主要有ITS[12-13]、AFLP[14]、RFLT[15]、RAPD[16]等,其中ITS序列分析技术已广泛应用于微生物菌种的分类鉴定及亲缘关系分析等方面[17-19]。
目前,国内外关于奶油栓孔菌遗传多样性以及其菌丝体提取物的抗氧化能力、抑菌活性等方面的研究尚未见报道,并且奶油栓孔菌野生资源较少,对其培养条件方面的探究也鲜见报道,人工培养技术的不成熟,导致出菇困难,故其资源利用程度很低。为此,本研究对采自福建省南平市浦城县的一株奶油栓孔菌进行分类鉴定和遗传多样性分析,并在此基础上开展生物学特性试验,进一步探究其生长的最适条件,并对不同时期奶油栓孔菌提取物的抗氧化活性和抑菌活性进行探究,以期为奶油栓孔菌资源的进一步开发利用提供依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 奶油栓孔菌菌株DKJ子实体,采自福建省南平市浦城县(118°54′E,28°02′N),将其分离纯化培养的菌丝保存于福建农林大学生命科学学院菌物研究中心。
1.1.2 主要仪器、试剂与培养基 PCR扩增仪(Mycycler型),美国Bio-Rad公司;高速冷冻离心机(ST16R型),美国Thermo公司;电热恒温水浴锅 (HWS12型),上海一恒科技仪器有限公司;恒温培养箱(SPX-250B-Z型),上海博迅实业有限公司;真空冷冻干燥机(松源LGJ-12)、超净工作台(SW-CJ-2F型),苏州净化设备有限公司;显微镜(BX51型),日本Olympus Opto-Technology有限公司。
十六烷基三甲基溴化铵(CTAB)、乙二胺四乙酸(EDTA),购自国药集团化学试剂有限公司;抗坏血酸(VC),购自Solarbio公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、2,4,6-三吡啶基三嗪(TPTZ),购自Sigma公司;果糖、葡萄糖、酵母浸粉、蛋白胨等作为碳源、氮源的试剂,均为国产分析纯。
马铃薯葡萄糖液体培养基(PDB):新鲜土豆(削皮)200 g,加水煮沸30 min,4层纱布过滤,滤液加入葡萄糖20 g充分溶解,加水定容至1 000 mL,pH自然。马铃薯葡萄糖固体培养基(PDA):新鲜土豆(削皮)200 g,加水煮沸30 min,4层纱布过滤,滤液加入葡萄糖20 g,琼脂20 g,充分溶解后加水定容至1 000 mL,pH自然。碳源试验培养基、氮源试验培养基、pH试验培养基、温度试验培养基和正交试验培养基,均参照张峰等[20]和鲁铁等[21]的方法配制。
1.2 奶油栓孔菌的鉴定
1.2.1 形态学鉴定 参照李海蛟[1]的方法对供试菌株DKJ及其子实体进行形态学鉴定。挑取试管保藏菌株的菌块置于PDA平板上活化,待菌丝长满平板后,用直径0.5 cm的打孔器打孔,将菌块接种到PDA平板正中央,于25 ℃恒温培养箱中培养,定期观察菌落特征。用插片法[22]观察菌丝的显微结构,将灭菌盖玻片倾斜45°插入距离菌块2 cm的培养基中,培养8 d后取出盖玻片,于显微镜下观察菌丝形态特征。用Melzer试剂、棉兰试剂和质量分数5%的KOH试剂处理菌丝体,观察菌丝体有无变化。待产孢后收集孢子,在显微镜下观察孢子形态,并拍照记录。观察子实体的形状、大小、颜色、菌盖表面特征(即是否有绒毛、环纹环沟、疣和凸起等),以及是否有特殊气味和味道等。
1.2.2 ITS序列分析 (1)ITS序列扩增与测序。采用CTAB法提取供试菌株基因组DNA,使用真菌ITS引物对待测菌株DNA进行PCR序列扩增, 真菌ITS引物ITS1的序列为:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4的序列为:5′-TCCTCCGCTTATTGATATGC-3′。PCR反应体系为:ITS1和ITS2引物各1 μL,2×TaqMaster Mix(含有10×TaqBuffer、dNTP和TaqDNA聚合酶)12.5 μL,模板DNA 1 μL,加ddH2O补足至25 μL。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min,4 ℃保存。将PCR扩增产物送至福州擎科生物有限公司测序。
(2)ITS序列分析。在GenBank(http://www.ncbi.nlm.nih.gov)上对测序菌株的rDNA ITS序列进行同源比较,筛选同源性较高的rDNA ITS序列和其他种属真菌的rDNA ITS序列[23],采用MEGA 6.0软件Neighbor-Joining法构建系统进化树,运行1 000次以bootstrap检验系统发育树的可靠性[24-25],并根据 Kimura 2-parameter模型[26]计算各菌种rDNA ITS序列之间的进化距离,判断供试菌株的分类地位。最后对供试菌株和NCBI数据库中收录的来自全球不同地区的21个奶油栓孔菌的rDNA ITS序列进行界定,除去5′端18S rDNA序列和3′端28S rDNA序列后保留ITS1-5.8S-ITS2序列,对所有ITS1-5.8S-ITS2序列进行多重比对,并对比对结果进行人工修正处理。
1.3 奶油栓孔菌的生物学特性研究
1.3.1 碳源试验 分别以葡萄糖、果糖、蔗糖、可溶性淀粉、糊精粉和麦芽糖为碳源制作碳源培养基,将活化的DKJ菌株接种于各种碳源培养基中,置25 ℃恒温培养箱中培养,每处理4个重复。接种后,每隔24 h观察1次菌落特征和菌丝长势(菌丝长势根据菌落特征和菌丝生长速率综合判断),利用十字交叉法测量并记录菌落直径。
1.3.2 氮源试验 分别以蛋白胨、酵母浸粉、磷酸氢二铵、硝酸铵、尿素和牛肉膏为氮源制作氮源培养基,将活化的DKJ菌株接种在各种氮源培养基中,置25 ℃恒温培养箱中培养,每处理4个重复。观察和测量方法同1.3.1节。
1.3.3 pH试验 配制pH值分别为4.0,5.0,6.0,7.0和8.0的pH试验培养基(培养基灭菌后用1 mol/L NaOH和1 mol/L HCl调节pH值),将活化的DKJ菌株接种于不同pH值的培养基中,置25 ℃恒温培养箱中培养,每处理4个重复。观察和测量方法同1.3.1节。
1.3.4 温度试验 将活化的DKJ菌株接种于温度培养基中,分别置20,25,30,35和40 ℃恒温培养箱中培养,每处理4个重复。观察和测量方法同1.3.1节。
1.3.5 正交试验 依据碳源、氮源、温度和pH的单因素试验结果,选择各因素最优的3个水平设计4因素3水平的正交试验,正交试验设计方案如表1所示,试验观察和测量方法同1.3.1节。

表1 奶油栓孔菌菌丝生长影响因素的正交试验设计方案Table 1 Orthogonal experimental design of factors affecting mycelium growth of Trametes lactinea
1.4 奶油栓孔菌的生物活性研究
1.4.1 菌丝体和子实体获取 将活化的奶油栓孔菌DKJ菌株接种于PDB培养基中,28 ℃、160 r/min恒温振荡培养8 d,收集菌丝体冷冻干燥后得菌丝体干品,子实体由本实验室驯化栽培,经烘箱干燥后,所有样品粉碎过孔径为0.9 mm的筛备用。
1.4.2 抗氧化活性测定 (1)水提物制备。分别称取奶油栓孔菌菌丝体和子实体粉末,按照料液比1∶15(g∶mL)加去离子水,90 ℃提取4 h,8 000 r/min离心5 min,收集提取液,冷冻干燥得菌丝体水提物(TLMWE)和子实体水提物(TLFWE)干品,用于抗氧化活性测定。
(2)抗氧化活性测定。分别配制质量浓度为4 mg/mL的奶油栓孔菌菌丝体和子实体水提物溶液,用于抗氧化活性测定试验,同时以抗坏血酸为阳性对照。其中羟基自由基清除活性参照金珊珊等[22]的方法测定,DPPH自由基、ABTS自由基清除活性以及铁离子还原能力参照郝金斌等[11]的方法测定。
1.4.3 抑菌活性测定 (1)乙酸乙酯提取物的制备。分别称取奶油栓孔菌菌丝体和子实体粉末,按照料液比1∶15(g∶mL)加乙酸乙酯,在超声功率150 W和室温条件下提取30 min,8 000 r/min离心5 min,收集提取液,提取2次后浓缩得乙酸乙酯提取物,用于抑菌活性测定。
(2)抑菌活性测定。采用滤纸片法[22],将圆形灭菌滤纸片(直径6 mm)放入质量浓度15 mg/mL的乙酸乙酯提取物溶液(加二甲基亚砜助溶于水)中,浸泡0.5 h备用。分别取100 μL 1×106CFU/mL的金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌菌悬液,撒在固体琼脂平板上,用涂布棒涂匀,将浸泡在提取物溶液中的滤纸片平铺于涂菌平板上,37 ℃培养24 h,测定抑菌圈直径。试验重复3次,结果取平均值,以2 mg/mL卡那霉素水溶液为阳性对照,二甲基亚砜水溶液为阴性对照。
1.5 数据统计与分析
试验数据以“平均值±标准差”表示,采用SPSS 20.0软件对试验数据进行分析,以P<0.05和P<0.01分别表示不同处理间的显著差异和极显著差异。
2 结果与分析
2.1 奶油栓孔菌的形态学特征
奶油栓孔菌的形态学特征如图1所示。
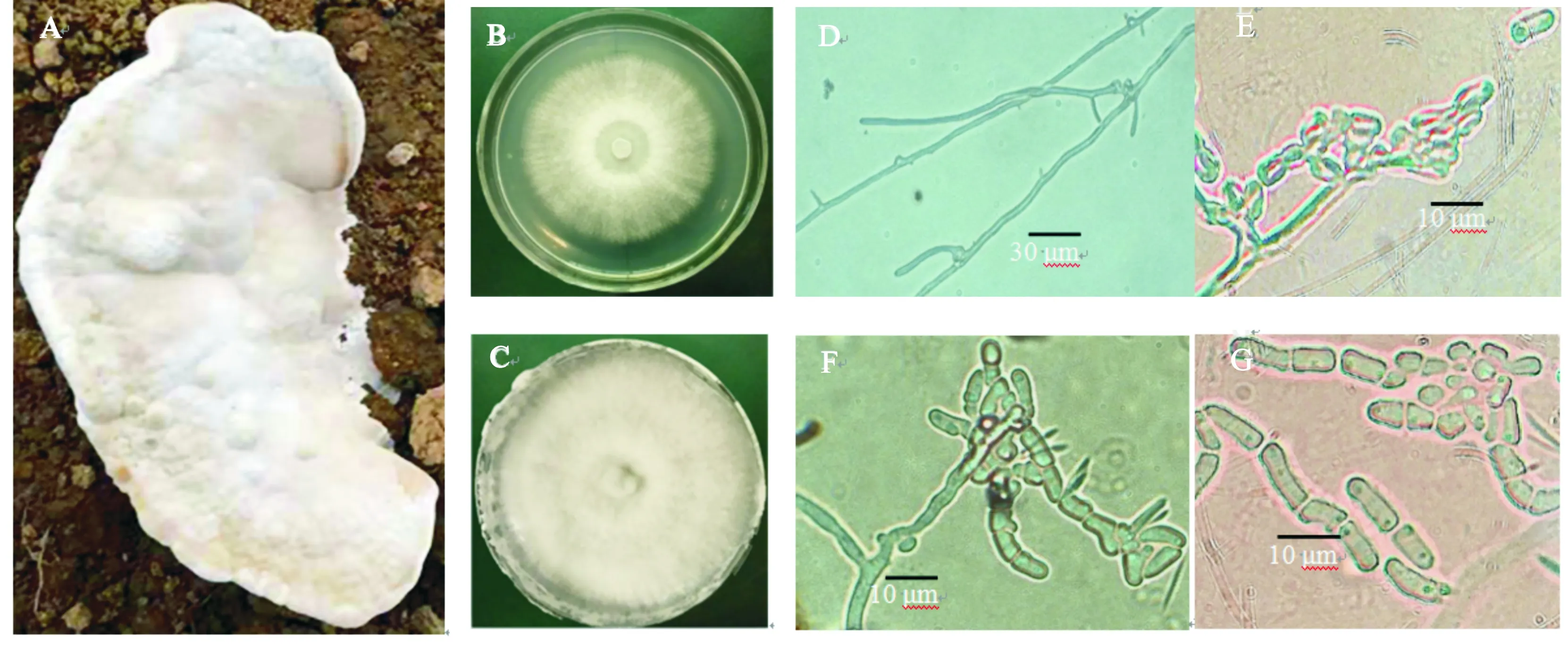
A.野生子实体;B、C.菌落形态;D.菌丝体特征;E、F.产孢结构;G.孢子形态 A.Wild fruiting body;B,C.Colonial morphology;D.Feature of mycelia;E,F.Conidiogenous structures;G.Conidiophores
由图1-A可知,DKJ子实体比较厚大,菌盖圆形或贝壳形,表面颜色为奶油色至灰色、黄褐色,表面光滑或有瘤状物,无致密绒毛,菌盖直径为4.0~6.5 cm,厚0.4~0.8 cm;菌柄较短且粗壮,光滑有白色微绒毛,有或无不规则突起。所有子实体新鲜时表皮湿润,呈水浸状,有折光;干燥后质量明显减轻,并且无臭无味。DKJ菌株菌落为圆形,菌丝生长前期为白色,呈现绒毛状,以接种块为中心向外呈辐射状延伸生长(图1-B);生长后期菌落为乳白色,无明显环纹(图1-C),有大量分生孢子产生。在整个生长过程中,菌丝在Melzer、棉蓝和质量分数5% KOH试剂中均无变色反应。显微镜下观察菌丝无色壁薄,无明显隔膜,分枝较多,且多见锁状联合(图1-D),产孢结构基部拟椭圆形(图1-E)或弯月形(图1-F),单个分生孢子呈椭球形、腊肠形或圆柱形,大小为(1.7~3.5) μm×(5~12) μm,孢子多呈长链状(图1-G)。经查阅,DKJ菌株的以上特征与李海蛟[1]和《中国真菌志》[2]所描述的奶油栓孔菌的形态特征基本吻合,初步判定DKJ菌株为奶油栓孔菌。
2.2 奶油栓孔菌的分子鉴定与系统发育分析
对菌株DKJ的rDNA ITS区段进行PCR扩增和测序,获得618 bp的DNA片段,将获得的ITS序列(NCBI登录号:MT982697)在NCBI (http://www.ncbi.nlm.nih.gov)核酸数据库中进行BLAST在线比对,发现其与奶油栓孔菌MH910526的rDNA ITS序列最为接近,相似度超过99%。以茯苓(KT693239)为外群,引入其他8株同源性较高的栓孔菌属真菌的rDNA ITS序列,用Neighbor-Joining法构建系统发育进化树,结果见图2。由图2可知,菌株DKJ和奶油栓孔菌(Trameteslactinea)的亲缘关系极其相近,以99%的bootstrap值聚为一族,遗传距离仅为0.006,而与其他栓孔菌属真菌的遗传距离较远。结合形态学鉴定结果,确定DKJ菌株为奶油栓孔菌(Trameteslactinea)。
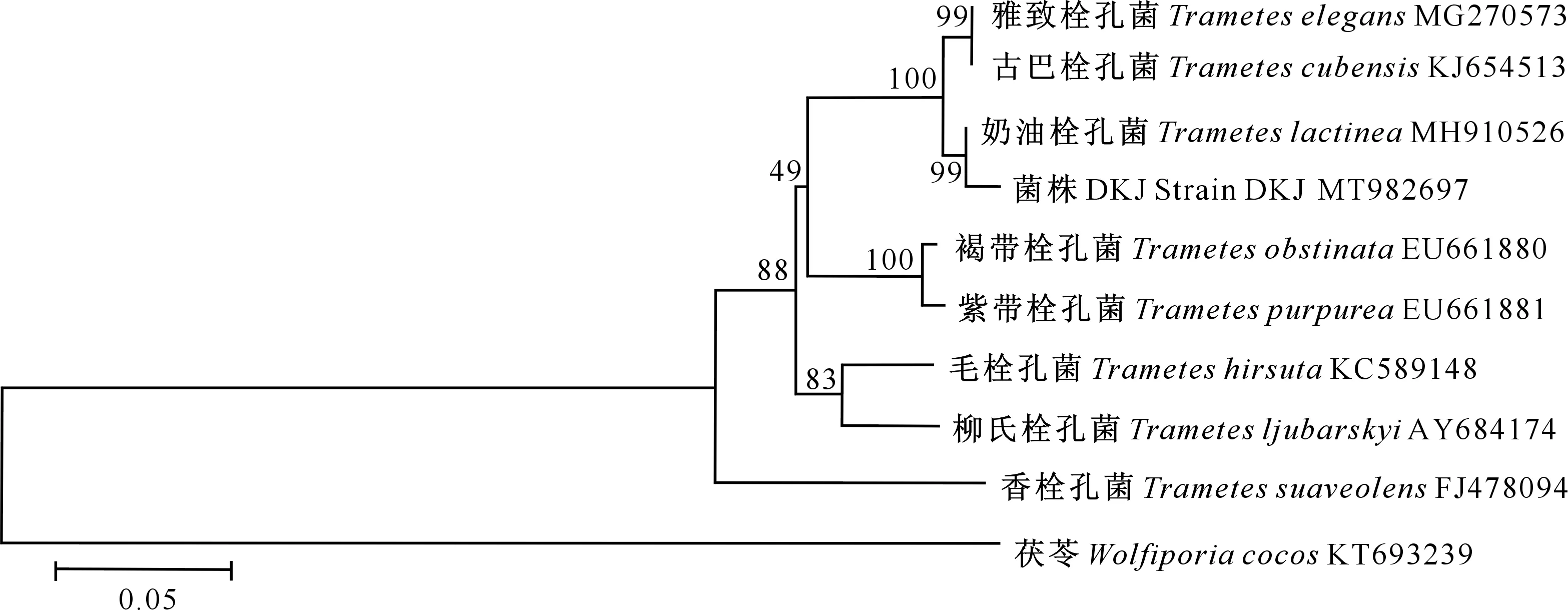
图2 9株栓孔菌rDNA ITS序列的系统发育树Fig.2 Phylogenetic tree of 9 Trametes strains based on rDNA ITS sequence
2.3 奶油栓孔菌的遗传多样性
为了探究奶油栓孔菌在自然界中的进化水平,本研究从NCBI数据库中下载不同地域的奶油栓孔菌ITS序列(不同地域奶油栓孔菌的ITS序列总长度为521~589 bp),基于ITS1-5.8S-ITS2序列进一步对包括DKJ菌株在内的22株奶油栓孔菌进行遗传多样性分析,结果见表2。由表2可知,各菌株ITS1序列长度变化较大,ITS1序列长度为165~233 bp;所有菌株5.8S序列长度均为158 bp;ITS2序列长度为187~198 bp,且仅有菌株9V7/2和DPS-9的ITS2序列长度分别为197和187 bp,其他菌株均为198 bp。对ITS1-5.8S-ITS2序列碱基组成的分析发现,ITS1、5.8S 和ITS2的GC含量分别为46.77%~52.00%,46.20%~47.47%,50.76%~53.48%,其中ITS1和ITS2序列GC含量的变化稍大,5.8S序列GC含量的变化较小,表现相对稳定。本研究还发现,22株奶油栓孔菌ITS1-5.8S-ITS2序列共测得590个碱基位点,其中保守位点549个、变异位点38个、自裔位点27个、简约信息位点8个,序列变异率达到6.44%。综上可知,不同地域的奶油栓孔菌存在较明显的遗传分化,说明奶油栓孔菌在自然界具有一定的遗传多样性。
2.4 奶油栓孔菌的生物学特性
2.4.1 碳 源 由表3可知,奶油栓孔菌菌丝体在6种碳源培养基中均能较好生长,其中在以果糖为碳源的培养基中菌丝体生长速度最快,长势最好;其次是以蔗糖、葡萄糖和麦芽糖为碳源的培养基。与其他碳源培养基相比,在以葡萄糖和蔗糖为碳源的培养基中,奶油栓孔菌菌丝生长最为浓密厚实;而在以麦芽糖为碳源的培养基中,菌丝生长较密集,但长势一般;在以糊精粉、可溶性淀粉为碳源的培养基中,奶油栓孔菌菌丝长势较弱且生长稀疏,生长速度较为缓慢。因此最终选择以果糖、葡萄糖和蔗糖为碳源进行下一步试验。

表3 不同碳源对奶油栓孔菌菌丝生长的影响 Table 3 Effects of different incubation carbon sources on mycelial growth of Trametes lactinea
2.4.2 氮 源 氮源主要用于机体内含氮化合物的合成。由表4可知,不同氮源培养基对奶油栓孔菌菌丝体生长的影响不同,其中在以酵母浸粉作为氮源时,奶油栓孔菌菌丝浓密,生长速度最快,长势最好;在以蛋白胨和牛肉膏为氮源的培养基上,菌丝长势一般,生长速度无显著差异;以硝酸铵和磷酸氢二铵为氮源的培养基上,菌丝生长缓慢,长势较差;在以尿素为氮源的培养基中,菌丝几乎不能生长,这可能是尿素在菌丝体生长过程中产生了一定的毒害作用,导致机体生命活动不能正常进行。因此,最终选择以酵母浸粉、牛肉膏和蛋白胨为氮源进行下一步试验。
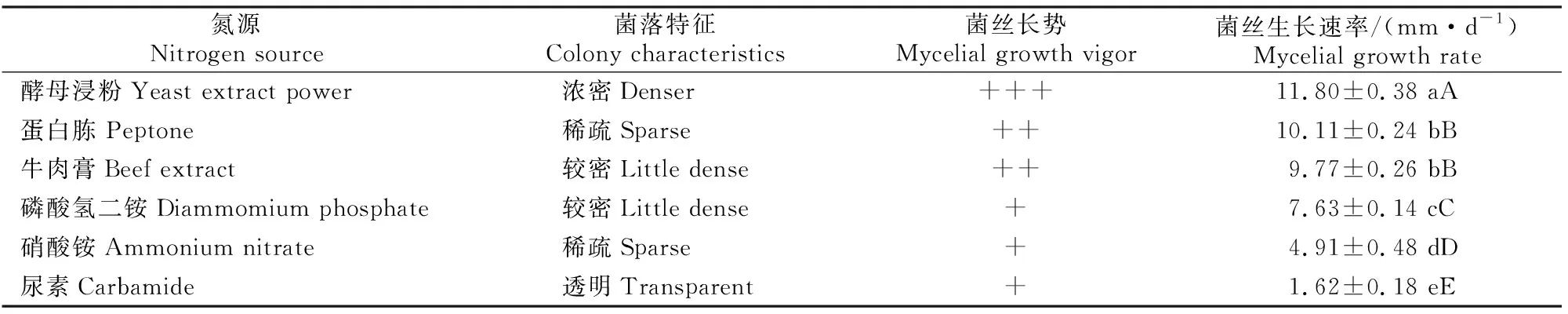
表4 不同氮源对奶油栓孔菌菌丝生长的影响 Table 4 Effects of different incubation nitrogen sources on mycelial growth of Trametes lactinea
2.4.3 pH 由表5可以看出,奶油栓孔菌菌丝体生长速率在pH为4.0~8.0时具有极显著差异,随着pH值逐渐升高,菌丝生长速率呈先升高后下降趋势;当pH为8.0时,奶油栓孔菌菌丝生长速率最小(4.07 mm/d),菌丝长势最弱; pH值为7.0时,菌丝较密但菌丝长势一般; pH值为4.0和5.0时,菌丝长势强,菌丝浓密,且以pH为5.0时的菌丝生长速率最快,达到10.42 mm/d。由此可见,奶油栓孔菌菌丝生长偏好于酸性环境,因此选择以pH值为4.0,5.0和6.0进行下一步试验。

表5 不同pH对奶油栓孔菌菌丝生长的影响Table 5 Effects of incubation pH on mycelial growth of Trametes lactinea
2.4.4 温 度 由表6可知,奶油栓孔菌菌丝体对温度的适应范围较广,在20~40 ℃的温度条件下均能生长。随着培养温度升高,菌丝生长速度呈先增加后降低的趋势; 20 ℃时菌丝生长速度最慢,为2.79 mm/d,菌丝稀疏,长势弱;在30 ℃培养时,菌丝浓密,长势强,生长速度较快;在35 ℃培养时,菌丝生长速率达到峰值(10.79 mm/d),菌丝密,长势强;在40 ℃培养时,菌丝生长速率可能受到过高温度的影响而开始下降,菌丝较密,但长势变弱。由此可见,培养温度对奶油栓孔菌菌丝生长有很大影响,最终选择以培养温度为30,35和40 ℃进行下一步试验。

表6 不同温度对奶油栓孔菌菌丝生长的影响 Table 6 Effects of different incubation temperatures on mycelial growth of Trametes lactinea
2.4.5 奶油栓孔菌培养条件优化的正交试验 基于上述单因素试验结果,从4个因素中各选取效果较好的3个水平进行正交试验,通过正交设计助手Ⅱv3.1设计试验方案进行试验,从各试验方案及其结果(表7)可以看出,极差(R)最大的是温度,为2.58;极差从大到小依次表现为温度、氮源、pH、碳源,说明4因素对奶油栓孔菌菌丝生长的影响大小依次为温度>氮源>pH>碳源。从均值(k)来看,碳源k3、氮源k1、温度k2和pHk2均大于各自其他水平,所以奶油栓孔菌菌丝生长的最适培养条件组合为以蔗糖为碳源、酵母浸粉为氮源,pH为5,培养温度为35 ℃。

表7 奶油栓孔菌菌丝生长影响因素的正交试验结果Table 7 Orthogonal experimental results of factors affecting mycelium growth of Trametes lactinea
对正交试验结果进行方差分析,结果(表8)表明,各因素对奶油栓孔菌菌丝生长速率均有显著影响,其差异显著性大小依次表现为温度>氮源>pH>碳源,与直观分析结果一致。

表8 奶油栓孔菌菌丝生长影响因素正交试验结果的方差分析Table 8 Variance analysis of orthogonal test of factors affecting mycelium growth of Trametes lactinea
2.5 奶油栓孔菌的抗氧化活性
奶油栓孔菌子实体和菌丝体水提物的抗氧化活性如图3所示。由图3可知,奶油栓孔菌子实体和菌丝体水提物对羟基自由基、DPPH自由基和ABTS自由基均有一定的清除能力,对铁离子也具有一定的还原能力;菌丝体水提物的抗氧化活性显著强于子实体时期(P<0.05),特别是其菌丝体水提物对ABTS自由基的清除率高达99.05%,与阳性对照无显著差异(P>0.05)。
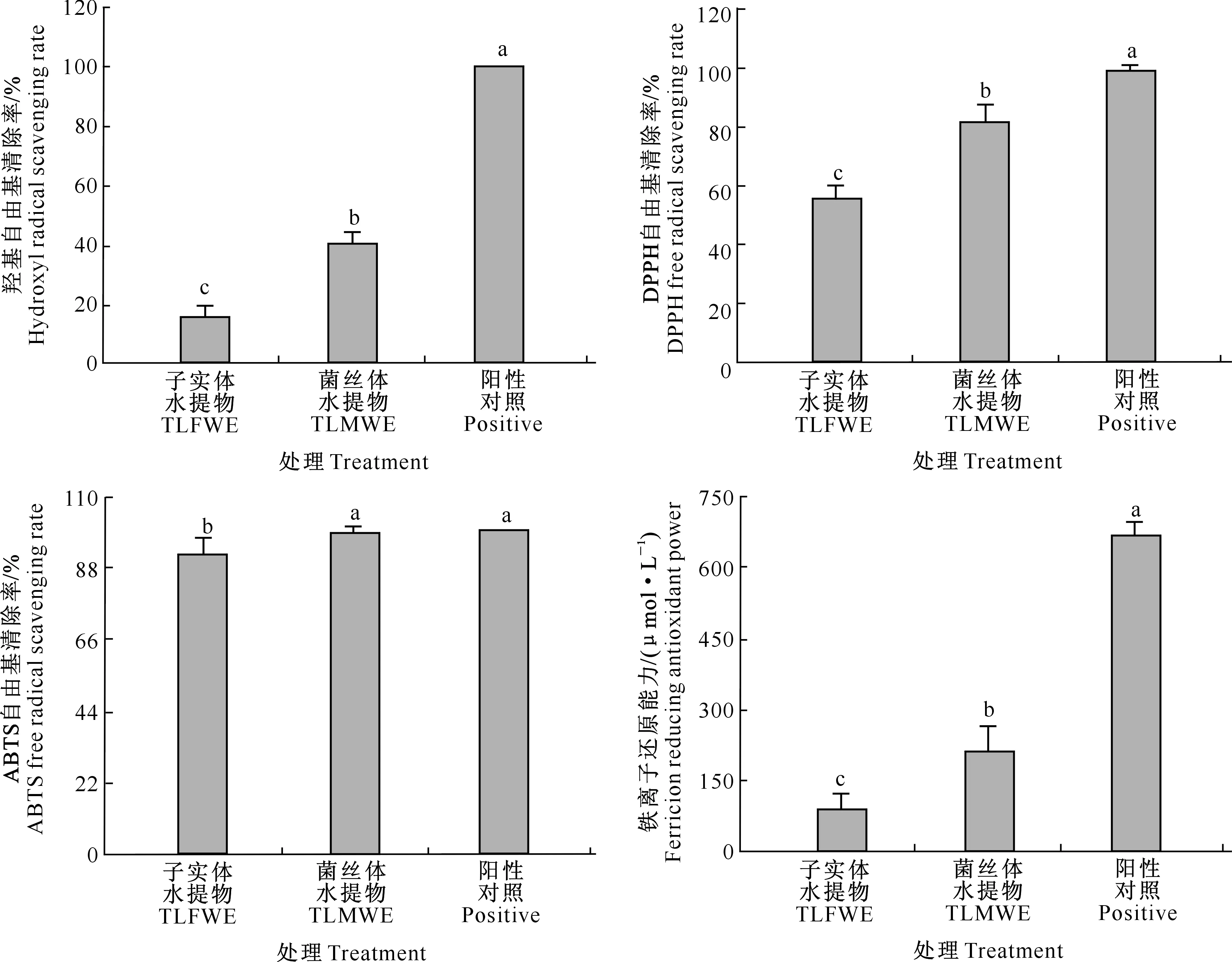
图柱上标不同小写字母表示不同处理间差异显著(P<0.05)Different lowercase letters indicate significant differences among treatments(P<0.05)
2.6 奶油栓孔菌的抑菌活性
由表9可知,奶油栓孔菌子实体和菌丝体乙酸乙酯提取物对金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌均具有一定的抑制作用,并且对革兰氏阳性菌(金黄色葡萄球菌、枯草芽孢杆菌)的抑制效果略优于革兰氏阴性菌(铜绿假单胞菌)。与菌丝体提取物相比,奶油栓孔菌子实体提取物的抑菌活性显著升高(P<0.05),其对金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌的抑菌圈直径分别为14.71,11.48和11.49 mm,但该提取物抑菌活性物质的组成还有待进一步研究。

表9 奶油栓孔菌乙酸乙酯提取物的抑菌活性Table 9 Antibacterial activity of ethyl acetate extracts from Trametes lactinea
3 讨 论
真菌的形态分类易受外界环境影响,单纯利用形态鉴定真菌类别还存在一定的局限性[27]。随着分子生物学技术的发展,从分子水平对物种进行鉴定被越来越多的研究所应用[26-30],其中ITS(internally transcribed spacer)序列对大型真菌的鉴定有更高的准确度和灵敏度,因此在物种鉴定方面得到了广泛应用[31]。本研究通过形态学观察并结合ITS序列分析,鉴定该株采自福建省南平市浦城县的白色多孔菌DKJ菌株为奶油栓孔菌。李海蛟[1]在对中国栓孔菌属进行分类和系统发育研究时,将奶油栓孔菌归入栓孔菌属,而栓孔菌属内所有种可以形成11个分枝,奶油栓孔菌位于第8分枝,其中包括奶油栓孔菌(Trameteslactinea)、马尼拉栓孔菌(Trametesmanilaensis)、东方栓孔菌(Trametesorientalis)、古巴栓孔菌(Trametescubescens)、粉灰栓孔菌(Trametesmenziesii)。
遗传多样性是指种内基因的变化,包括种内显著不同于种群间和同一种群内的遗传变异[32]。遗传多样性可反映物种的遗传背景和潜在利用价值。遗传多样性越高,其遗传变异就越丰富,说明物种适应环境的能力也就越强。因此,针对遗传多样性的研究对物种保护以及确定优先保护种、筛选优良种质具有重要的理论意义和实际价值[33-34]。本研究基于ITS1-5.8S-ITS2序列,对菌株DKJ与NCBI数据库收录的来自不同地域的21株奶油栓孔菌进行了遗传多样性分析,结果显示不同地域的奶油栓孔菌ITS1-5.8S-ITS2序列长度为521~589 bp,GC含量为48.76%~50.60%,有变异位点38个,自裔位点27个,简约信息位点8个,序列总变异率为6.44%,表明不同地域的奶油栓孔菌ITS1-5.8S-ITS2序列长度、碱基构成和变异程度均具有一定差异。说明奶油栓孔菌在自然界中存在一定的遗传分化,具有较高的遗传多样性,表明奶油栓孔菌对环境的适应能力较强。
碳源试验表明,奶油栓孔菌DKJ在碳源为单糖或双糖时更适合菌丝体生长,其对多糖的适应性较差,这一特性与黄毛黄侧耳的生物学特性[35]相一致。在氮源为酵母浸粉、蛋白胨和牛肉膏等有机氮源时,奶油栓孔菌菌丝体生长更快,而在磷酸氢二铵、硝酸铵和尿素等无机氮源条件下其生长缓慢甚至不能生长,这可能与有机氮源中含有维生素、微量元素等可以促进菌丝生长的物质有关[36]。随着pH值增大,奶油栓孔菌菌丝体生长速率先增大后减小,在pH值为5.0时生长最快,说明奶油栓孔菌偏好在弱酸性环境中生长,这与迷宫栓孔菌 ZT-055菌丝体的生物学特性[20]一致。培养温度试验表明,35 ℃时奶油栓孔菌菌丝长势最好,生长最快,正交试验结果也表明,温度对奶油栓孔菌菌丝生长的影响最大。由于该菌株于夏季在福建南平采集,根据对采集时间和气候的分析,证明其是一个中高温性菌。单因素试验和正交试验研究表明,奶油栓孔菌DKJ菌丝体的最适生长条件组合为:以蔗糖为碳源,酵母浸粉为氮源,pH为5,培养温度为35 ℃。
本研究发现,不同时期的奶油栓孔菌水提物和乙酸乙酯提取物均具有一定的抗氧化活性和抑菌活性,但其子实体和菌丝体时期的抗氧化活性和抑菌活性均存在显著差异。该研究结果对奶油栓孔菌人工培养以及该菌种资源的开发利用和保护提供了一定的数据支撑。

