食线虫性真菌Duddingtonia flagrans F088的生长和产孢特性
常凡凡,黄海岩,蔺国珍,刘新宇,赵天宇,李凤迪,蔡葵蒸
(西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
食线虫真菌是线虫的天敌,广泛分布于土壤、动物粪便及堆肥等各种基质中。根据食线虫真菌杀虫机制的不同,将其划分为捕食线虫性真菌(nematode-trapping fungi)、机会性真菌(opportunistic fungi)、内寄生性真菌(endoparasitic fungi)和产毒性真菌(toxin-producing fungi)4种类型[1]。其中捕食线虫性真菌是食线虫真菌中最常见且研究最多的一类,其以形成各种捕食器为特征,如三维黏性网、黏性球、收缩性环以及非收缩性环等;其他类型食线虫真菌通过内寄生性孢子进入线虫体内或粘附在线虫卵上等方式发挥杀线虫作用。大多数食线虫真菌在有机物质存在的情况下营腐生生活,一旦有线虫出现,它们即通过杀死线虫来提供自身生长和繁殖所需营养,因而食线虫真菌在调节土壤线虫动态中发挥着重要的生态作用[2-3]。
Linford[4]于1937年首次利用食线虫真菌对植物根结线虫进行了生物防治研究。此后随着农药的大量使用,农业线虫对药物的耐药性日益严重,人们对食线虫真菌的分离、筛选和培育进行了大量研究,并应用于植物寄生线虫的防治。目前,已有食线虫真菌厚垣孢普可尼亚菌(Pochoniachlamydosporia)和淡紫拟青霉(Paecilomyceslilacinus)等菌株的商品化制剂用于植物寄生线虫的防治[5]。在动物寄生线虫方面,曾将食线虫真菌制剂施用于牧场,但由于需用大量的生防制剂,极大地提高了应用成本,使得食线虫真菌在动物寄生线虫防治中的应用远迟滞于农业线虫。若能将食线虫真菌制剂作为动物饲料添加剂使用,真菌则可通过动物的消化道随粪便排出,在粪便中萌发并杀死粪便中的幼虫,从而达到在生产中应用的目标。然而动物消化道中蛋白质酶和胃酸的存在,使得多数食线虫真菌孢子或菌丝体在通过消化道时被灭活,从而失去杀虫活性。Larsen等[6]发现,食线虫真菌Duddingtoniaflagrans能够通过动物消化道而不丧失活性。该菌的特征是能够产生大量的双层厚壁厚垣孢子,这种孢子是菌丝发育老化后由细胞内的原生质体浓缩所形成,对外界逆性环境及动物的消化道有较强的抵抗力[7]。因此,厚垣孢子作为生防制剂的有效成分而使用在动物饲料添加剂中。众多研究表明,D.flagrans为动物寄生线虫生物防治的菌种,无论是在实验室还是田间条件下,均能有效减少线虫感染性幼虫(L3)的数量[8-10]。用含有D.flagrans的制剂饲喂家养动物(绵羊、山羊、牛、马等)后,消化道线虫L3在牧场上的散播显著减弱[11-12];以高剂量制剂饲喂试验动物,不但未见任何副作用,且有促进生长和增加体质量的效果[13]。近年来,Healey等[14-15]注册了用澳大利亚D.flagrans分离株(IAH1297)研制成的颗粒制剂,并对放牧动物(绵羊、山羊、马、牛)寄生线虫的防治效果分别进行田间跟踪,同时对牧场L3的减少进行了田间评估。此外,人们对其他食线虫真菌,如奇妙节丛孢(Arthrobotrysthaumasia,同物异名Monacrosporiumthaumasium)亦进行了较多的研究[16],但与D.flagrans相比,其他真菌产生的厚垣孢子较少而难以进行生产应用。本课题组于2012年在国内首次分离得到13株D.flagrans,对分离株进行了形态学、体内外杀虫试验[7,10],在此基础上研制了海藻酸钠包埋颗粒和粉剂,这些制剂在常温下可以有较长的货架期[17],且在3个地区的田间试验均表明,其对绵羊粪便和牧场上L3的减少是有效的[18]。
D.flagrans作为家养动物寄生线虫生物防治中最有应用前景的候选菌种,在固体培养基(如玉米、大麦)中能够产生大量的厚垣孢子,但在实践中难以大规模生产。液体发酵由于成本较低且易于操作,是生产生物制剂的主要方式之一,但该菌通过液体培养后产生厚垣孢子量少且不成熟,因此有必要对培养过程中的相关指标进行研究。有研究表明,温度、pH及营养要素对D.flagrans的生长均有一定的影响[19-20],但到目前为止,有关不同营养要素及其比例对D.flagrans生长和厚垣孢子形成的影响研究很少。为此,本研究通过监测D.flagrans在液体培养中pH值、产孢量、菌丝干质量及OD值的动态变化,以及生产中常用的几种碳源、氮源、维生素、无机盐以及不同碳氮比对菌丝平均生长速率和厚垣孢子产量的影响,以期确定最佳的菌丝生长和厚垣孢子产量的营养成分组合,为将来D.flagrans菌丝体和厚垣孢子的规模化生产提供依据。
1 材料与方法
1.1 供试菌种
D.flagransF088菌株(基因库登录号:KU881774.1),分离自黑龙江省某羊群粪便,保存于玉米粉琼脂(CMA)斜面培养基中,由西北民族大学生命科学与工程学院寄生虫学实验室保藏。
1.2 试验设计
1.2.1D.flagransF088的液体培养及相关指标检测 称取红糖30 g、蛋白胨2.5 g、KH2PO45 g、MgSO40.5 g,去离子水定容至1 000 mL,pH调至6.5,分装入500 mL三角锥形瓶(100 mL/瓶)中,于121 ℃灭菌。待培养液温度降至室温后,将在马铃薯葡萄糖琼脂(PDA)培养皿上活化的D.flagransF088菌株,用直径6 mm打孔器取末端菌块8块至每瓶培养液中,置于28 ℃、200 r/min摇床中培养,培养2 d后,每天取样1次,检测各指标,共测7次。设置3次重复。
pH采用pHS-3C数显酸度计(上海宇隆仪器有限公司生产)测定;厚垣孢子产量采用血球计数板计数法测定;OD600采用紫外可见分光光度计测定,波长600 nm;测定菌丝干质量时,每天每瓶取10 mL液体于5 000 r/min离心20 min,弃上清用滤纸过滤,无菌水清洗4次,置鼓风干燥箱中于75 ℃干燥至恒质量。
1.2.2 不同碳源对D.flagransF088厚垣孢子产量与菌丝平均生长速率的影响 称取琼脂粉20 g,蛋白胨4 g,加去离子水定容至1 000 mL,分别加入碳源葡萄糖、蔗糖、肌醇、可溶性淀粉、甘油、白糖、红糖20 g(pH 6.5),以不加碳源为对照,121 ℃ 灭菌后倒培养皿备用。试验时取在PDA培养皿中生长时间和长势一致的菌种,用打孔器从菌落边缘切下直径6 mm的接种物,接种于各培养皿中央,置于28 ℃恒温培养箱中培养,相对湿度保持在95%。从接种后的第2 天起,每天定时用游标卡尺从培养皿的背面十字交叉法测量菌落直径,连续测定4 d(因第5 天时部分培养皿已铺满菌丝),记录和计算每个培养皿中菌丝的平均生长速率,菌丝平均生长速率=菌落半径(mm)/生长时间(d)。待菌生长15 d后,将培养皿中的菌丝体轻轻用1 mL体积分数0.05%吐温-80洗下,移到1.5 mL塑料管中,在涡流混合器上振荡15 min,使孢子充分分散在悬浮液中。将孢子悬液适当稀释后取1 μL滴入血球计数板凹槽中,400倍显微镜下对5个方格内的厚垣孢子进行计数,每个培养皿取3次计数平均值,计算厚垣孢子产量(厚垣孢子产量=每个培养皿中孢子总数/菌丝生长面积)。每个处理设置3组重复。
1.2.3 不同氮源对D.flagransF088厚垣孢子产量与菌丝平均生长速率的影响 称取琼脂粉20 g,葡萄糖20 g,加去离子水定容至1 000 mL,分别加入氮源尿素、蛋白胨、大豆蛋白胨、干酪素、氯化铵、硝酸钾4 g(pH 6.5),以不加氮源为对照,按照1.2.2节方法测定各培养基中的菌丝平均生长速率和厚垣孢子产量。每个处理设置3组重复。
1.2.4 不同碳氮比对D.flagransF088厚垣孢子产量与菌丝平均生长速率的影响 称取琼脂粉20 g,加去离子水定容至1 000 mL,加入葡萄糖作为唯一碳源,硝酸钾为唯一氮源。在硝酸钾(4 g/L)不变的基础上,通过添加葡萄糖的量调整碳氮比分别为1∶40,1∶20,1∶10,1∶5,1∶1,5∶1,10∶1,20∶1和40∶1,按照1.2.2节方法测定菌丝平均生长速率和厚垣孢子产量。每个处理设置3组重复。
1.2.5 不同维生素和无机盐对D.flagransF088厚垣孢子产量与菌丝平均生长速率的影响 称取琼脂粉20 g,蛋白胨4 g,葡萄糖20 g,加去离子水定容至1 000 mL,分别添加 VB1、VB6、VB1210 mg,进行维生素试验;分别添加无机盐MgSO4、CaCl2、NaCl、KH2PO41 g,进行无机盐试验,以不加维生素和无机盐为对照,按照1.2.2节方法测定菌丝平均生长速率和厚垣孢子产量。每个处理设置3组重复。
1.2.6 不同营养元素对D.flagransF088厚垣孢子产量与菌丝平均生长速率的正交试验 在上述单因素试验的基础上,选取最佳碳源(白糖)、氮源(大豆蛋白胨)、维生素(VB1)、无机盐(MgSO4)作为自变量,设计4因素3水平的正交试验(表1),以厚垣孢子产量和菌丝平均生长速率为主要指标,筛选各因子之间的最优组合。按照1.2.2节方法测定厚垣孢子产量和菌丝平均生长速率。每个处理设置3组重复。

表1 不同营养元素对D.flagrans F088厚垣孢子产量和菌丝平均生长速率影响的正交试验方案Table 1 Orthogonal test for effects of different nutritional factors on chlamydospores production and mycelial average growth rate of D. flagrans F088
1.3 数据处理
采用SPSS 22.0软件对试验数据进行比较分析,用Excel 2010和GraphPad Prism 5进行数据统计和制图。
2 结果与分析
2.1 D.flagrans F088液体培养过程中相关指标的变化
图1-A显示,在培养前4 d,D.flagransF088菌液pH值明显下降,之后pH相对趋于稳定并维持在4.4~4.5。图1-B显示,培养过程中菌液OD600值随培养时间的延长不断升高,接种2 d后OD600值为0.577,培养结束后OD600值升高为11.928,上升95.16%。在整个培养过程中,OD600值在2~4 d时属于跃升期,在5~8 d时升高逐渐趋于平缓。图1-C显示,在菌丝培养过程中,前2 d之内处于迟滞期,菌丝几乎不生长,2 d时仅有少量菌丝形成。4 d时处于对数生长期,此时菌丝干质量达到最大,为12.07 g/L。培养5~8 d时菌丝生长处于平稳期,菌丝干质量相对稳定。

图1 D. flagrans F088菌株液体培养过程中相关指标的变化Fig.1 Changes of indexes related to D. flagrans F088 in liquid culture
由图1-D可知,处在生长迟滞期的前2 d无厚垣孢子形成,3 d时开始有少量厚垣孢子出现,4 d时达到爆发期,此时厚垣孢子量明显增多,之后又逐渐下降;6 d后又有一个爆发期,培养8 d时厚垣孢子产量可达5.82×105mL-1。
上述4个指标与培养时间之间的相关性分析结果(表2)显示,培养时间与各指标均极显著相关,其中与OD600值和厚垣孢子产量的相关性最强,与pH值呈极显著负相关。表明OD600值和厚垣孢子产量均随着培养时间的延长而增大,pH则不断变小。与pH值相关性较强的因子为OD600值和菌丝干质量,且均呈极显著负相关。厚垣孢子产量与OD600值和菌丝干质量的相关系数较高,且均呈极显著正相关,而菌丝干质量与OD600值也呈极显著正相关。

表2 D.flagrans F088菌株液体培养过程中各指标间的相关性分析Table 2 Correlation analysis of indexes in culture process of D.flagrans F088
2.2 不同碳源、氮源对D.flagrans F088厚垣孢子产量与菌丝平均生长速率的影响
不同碳源、氮源对捕食线虫真菌D.flagransF088厚垣孢子产量和菌丝平均生长速率的影响分别如图2和表3,4所示。由图2-A可见,除甘油外,添加其他碳源对厚垣孢子产量的影响效果均明显优于不加碳源。其中以白糖为碳源时厚垣孢子产量最多,可达3.19×104cm-2;其次为蔗糖,与白糖差异不显著(P>0.05),以甘油为碳源时产生的孢子量最少。由表3的菌丝平均生长速率可知,与对照相比,除甘油外添加其他碳源均可促进菌丝生长,其中以红糖效果最好,而甘油则对菌丝生长表现出一定的抑制作用。
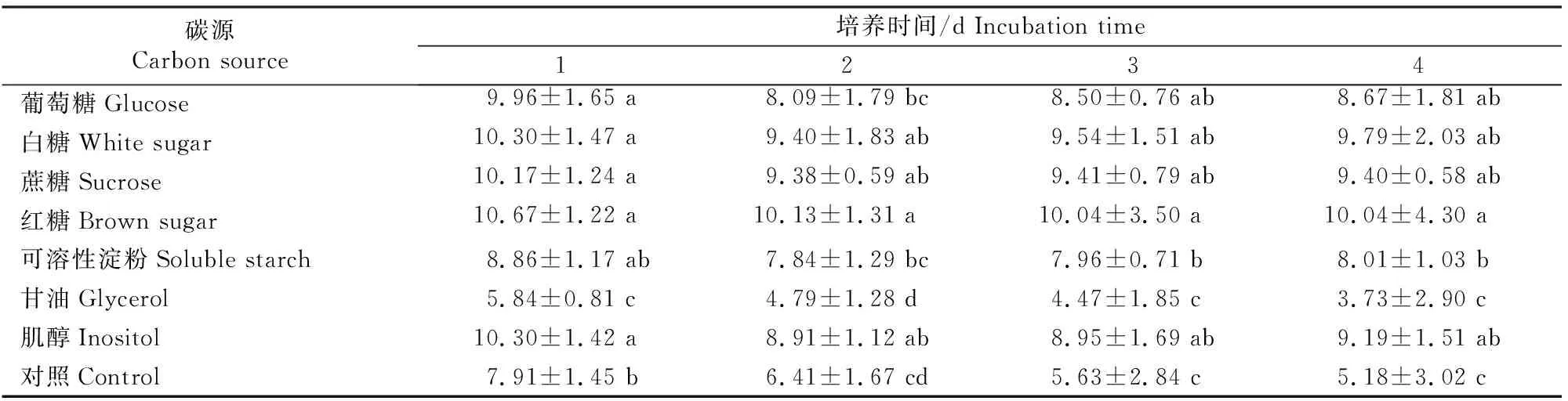
表3 不同碳源对D.flagrans F088菌丝平均生长速率的影响Table 3 Mycelial average growth rate of D.flagrans F088 under different carbon sources mm/d
图2-B显示,以大豆蛋白胨作为氮源时,厚垣孢子产量最多,达6.15×104cm-2,且显著高于其他处理(P<0.05);蛋白胨和干酪素次之。而以氯化铵、尿素、硝酸钾为氮源时,与对照相比,其厚垣孢子产量差异不显著,且尿素、硝酸钾对厚垣孢子的产生表现出一定的抑制作用。由表4可知,大豆蛋白胨是促进菌丝生长的最佳氮源,蛋白胨次之;与对照相比,尿素、干酪素、氯化铵会抑制菌丝生长,硝酸钾的影响不显著。

图柱上标不同小写字母表示各处理间差异显著(P<0.05)。下同Different lowercase letters mean significant difference among treatments (P<0.05). The same below

表4 不同氮源对D.flagrans F088菌丝平均生长速率的影响Table 4 Mycelial average growth rate of D.flagrans F088 under different nitrogen sources mm/d
2.3 不同碳氮比对D.flagrans F088厚垣孢子产量与菌丝平均生长速率的影响
不同碳氮比对D.flagransF088厚垣孢子产量与菌丝平均生长速率的影响如图3和表5所示。图3显示,产孢量最高的碳氮比为40∶1,孢子产量可达0.34×104cm-2,且与其他处理差异显著(P<0.05)。由表5可知,碳氮比为40∶1时菌丝平均生长速率最小,而其余碳氮比之间菌丝平均生长速率无显著差异。

图3 不同碳氮比对D.flagrans厚垣孢子产量的影响 Fig.3 Effect of different C∶N ratios on chlamydospores production of D.flagrans F088

表5 不同碳氮比对D.flagrans F088菌丝平均生长速率的影响

表5(续) Continued table 5
2.4 不同维生素和无机盐对D.flagrans F088厚垣孢子产量与菌丝平均生长速率的影响
不同维生素和无机盐对D.flagransF088厚垣孢子产量和菌丝平均生长速率的影响如图4和表6所示。由图4-A可知,与对照相比加入维生素后,D.flagransF088厚垣孢子产量均有所提高,其中以VB1最佳(3.93×104cm-2)(P<0.05)。由表6可知,与对照相比,3种维生素对D.flagransF088菌丝平均生长速率无明显促进效果(P>0.05)。
图4-B显示,加入无机盐MgSO4有利于厚垣孢子产量的提高(1.78×104cm-2),且与其他处理差异显著(P<0.05)。与对照相比,加入NaCl、KH2PO4对厚垣孢子的产生存在一定的抑制作用。表6显示,与对照相比,加入MgSO4、NaCl、CaCl2对菌丝平均生长速率均无显著促进作用(P>0.05),而KH2PO4甚至延缓了菌丝的生长。
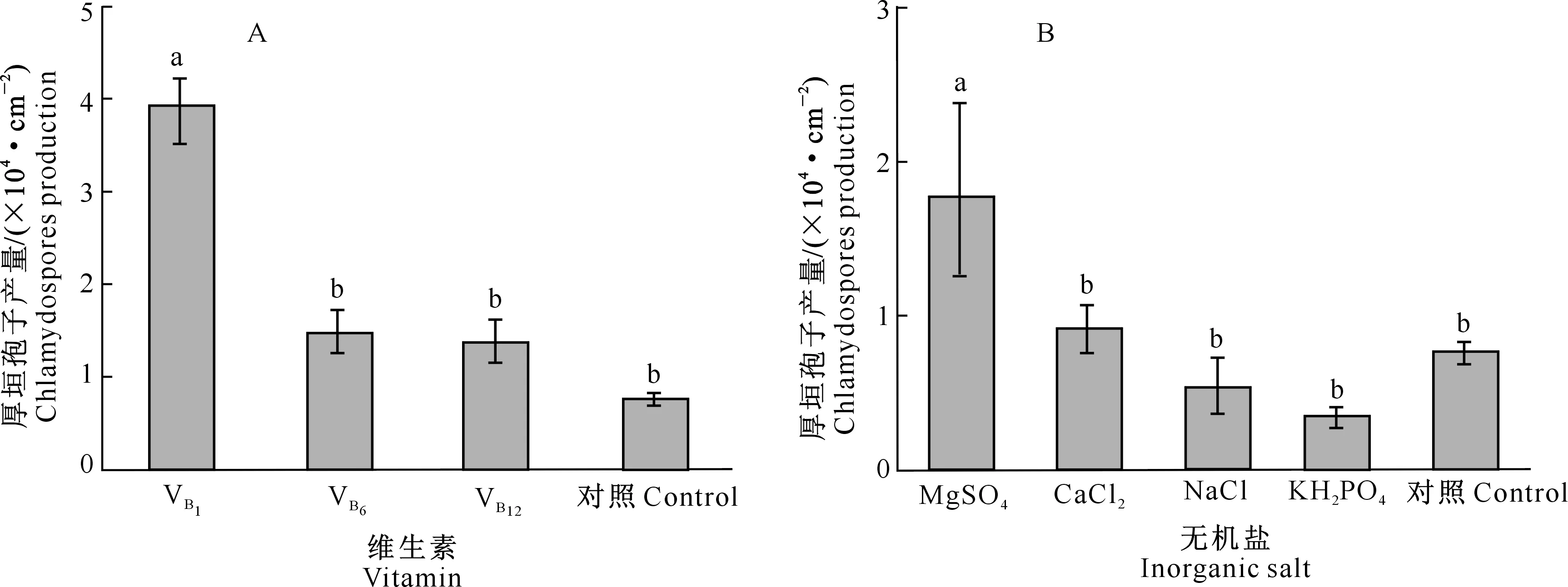
图4 不同维生素(A)和无机盐(B)对D.flagrans F088厚垣孢子产量的影响

表6 不同维生素和无机盐对D.flagrans F088菌丝平均生长速率的影响Table 6 Mycelial average growth rate of D.flagrans F088 under different vitamins and inorganic salts mm/d
2.5 D.flagrans F088厚垣孢子产量和菌丝平均生长速率培养配方的优化
正交试验结果(表7)显示,4个因子对D.flagransF088产孢量影响的大小排序为白糖>大豆蛋白胨>VB1>MgSO4。厚垣孢子产量的最佳培养条件为A3B2C1D3,即白糖30 g/L、大豆蛋白胨4 g/L、MgSO41 g/L、VB130 mg/L,在此条件下厚垣孢子产量可达8.64×104cm-2。
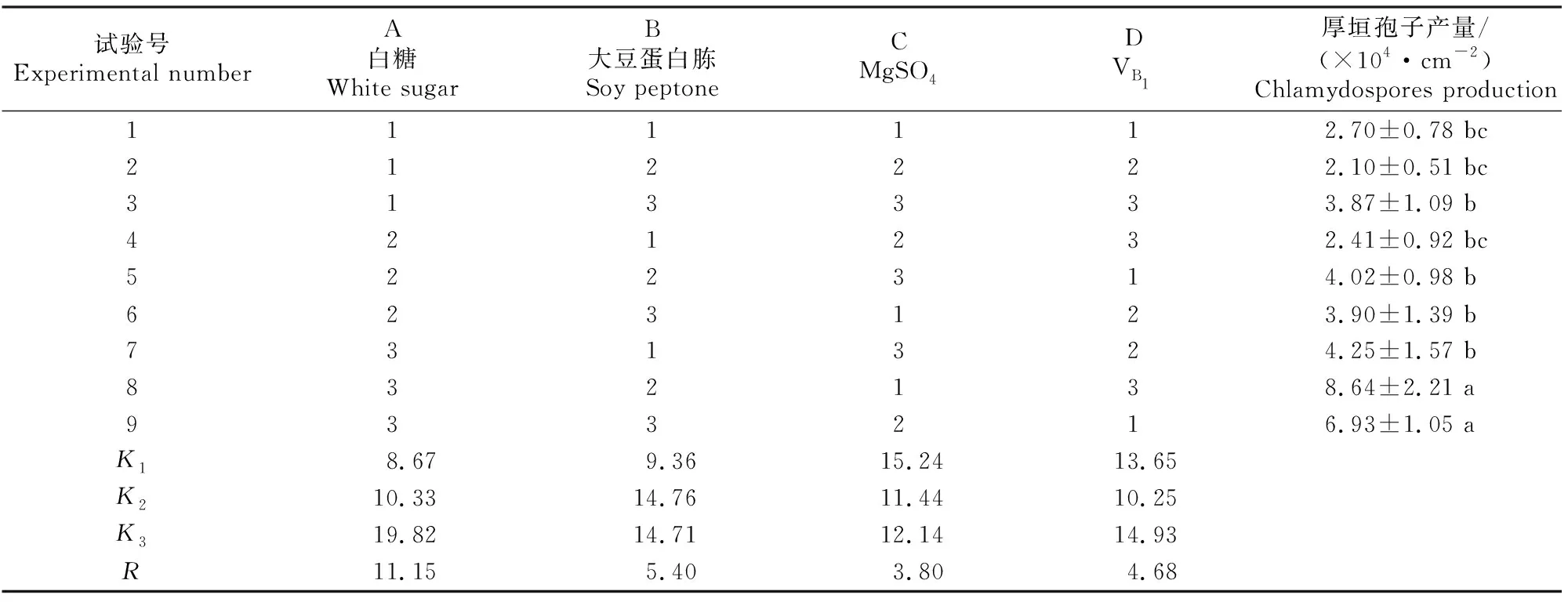
表7 基于D.flagrans F088厚垣孢子产量的正交试验结果Table 7 Orthogonal test results for chlamydospores production of D.flagrans F088
菌丝平均生长速率的测定结果(表8)显示,各试验组中的菌丝均生长良好,相对而言,其中试验8(30 g/L白糖、4 g/L大豆蛋白胨、1 g/L MgSO4、30 mg/L VB1)的菌丝平均生长速率最快,但与其他试验组并无显著差异(P>0.05)。
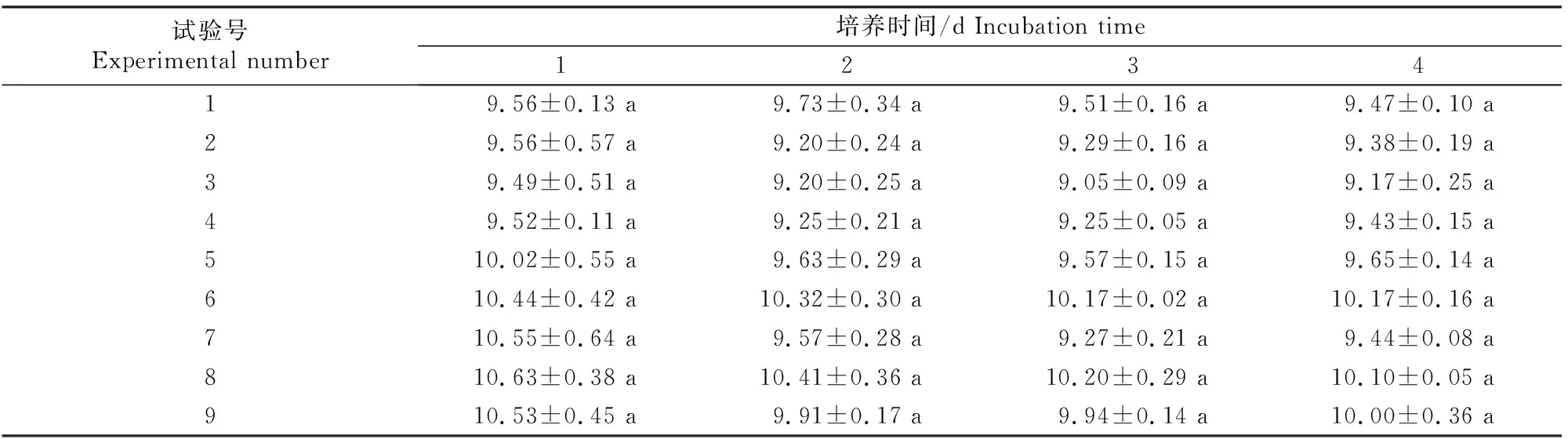
表8 基于D.flagrans F088菌丝平均生长速率的正交试验结果Table 8 Orthogonal test results for mycelial average growth rate of D.flagrans F088
综合以上结果,确定D.flagransF088厚垣孢子产量和菌丝生长的最佳培养组合配方为白糖30 g/L、大豆蛋白胨4 g/L、MgSO41 g/L、VB130 mg/L。
3 讨 论
环境pH是评价微生物活跃程度的一个重要参数。有研究表明,跟踪分析发酵过程,监测培养物中pH及菌体密度的变化,对其发酵工艺的制定非常重要[21-22]。本研究显示,D.flagransF088的pH值与OD600值、菌丝干质量及厚垣孢子产量均呈负相关,pH值在接种4 d内急剧下降,之后趋于平缓;OD600在接种4 d内急剧上升,之后缓慢增加;菌丝干质量则在4 d内急剧上升,而后趋于平缓;厚垣孢子产量在4 d时呈爆发式增加,此后仍一直缓慢增加。在菌体培养过程中,接种后4 d处于对数生长期,由于菌体生长快速、能量消耗迅速,导致pH快速下降,同时OD600值、菌丝干质量、厚垣孢子产量快速上升。随着培养时间的延长、次生代谢产物的形成影响了菌体的生长,菌丝干质量变化平稳。由于厚垣孢子是在菌丝不断老化的过程中形成的,因而在培养后期厚垣孢子产量仍然增加,OD600值也在缓慢上升。
许多微生物包括真菌的生长发育都与碳源种类有关。本研究表明,D.flagransF088菌株可利用几种常见的碳源,但培养基中不同种类的碳源,对厚垣孢子产量和菌丝生长的影响也存在一定差异。白糖可促进厚垣孢子的形成,红糖则有利于菌丝的生长。Liu等[23]报道,糖原可促进食线虫真菌洛斯里被毛孢(Hirsutellarhossiliensis)的菌丝生长,但其并不是产孢的最佳碳源,且该菌不同分离株间存在差异,如D-(+)-海藻糖有利于菌株ATCC46487产孢,而D-山梨醇和D-(+)-纤维二糖分别有助于菌株OWVT-1和菌株JA16-1产孢。Federica等[24]报道,向沙氏葡萄糖琼脂中添加体积分数0.5%的内消旋肌醇能够提高D.flagrans厚垣孢子的产量。然而本研究显示,白糖、蔗糖、葡萄糖、红糖较肌醇的产孢效果更好。Gardner等[25]报道,在Vogel’s mineral salt medium(VMSM) 培养基中加入淀粉或者甘油能够显著促进D.flagrans产孢,而本研究中添加甘油不能增加产孢量。另有研究表明,3株厚垣孢普可尼亚菌在-10 MPa含有甘油的CMA中不能生长,但将菌块移至无甘油的CMA中则有厚垣孢子产生[26],这与本研究结果相似。关于氮源对食线虫真菌生长的影响,Jokar等[27]报道,不同食线虫真菌菌株对氮源的利用存在差异,硝酸铵能促进所有测试菌株的生长,其次是硝酸钠和硝酸钾,L-脯氨酸表现最差。本试验中,硝酸钾对菌丝生长无明显促进效果。Li[3]观察发现,在少孢节丛孢(Arthrobotrysoligospora)培养基中加入氯化铵、硫酸铵、硝酸铵、尿素后,菌丝产量降低。本研究发现,添加尿素、氯化铵会抑制菌丝的生长,而氯化铵、尿素和硝酸钾对厚垣孢子产量的影响与对照相比差异不显著。Silva等[28]发现,在大豆葡萄糖培养基 (pH 6~7)中D.flagrans菌丝生长最佳。本试验也表明,大豆蛋白胨可以促进菌丝生长,且对厚垣孢子产量有明显的促进作用。
Elson等[29]研究表明,当碳源质量浓度为1.25~2.5 g/L、碳氮比为10∶1时,菌株马铃薯银屑病菌(Helminthosporiumsolani)产生的分生孢子量最大,高碳氮比会抑制分生孢子的产生。Mo等[30]发现,厚垣普可尼亚菌在碳氮比为10∶1、pH为3.7时,分生孢子产量最高;碳氮比为40∶1、pH为6.8时,菌体生物量最高。Gao[31]的研究表明,食线虫真菌厚垣孢普可尼亚菌菌丝量达到最高时的碳氮比为160∶1,碳氮源组合为果糖+大豆蛋白胨。本试验中,碳氮比为40∶1时厚垣孢子产量最大,而菌丝生长速度却最慢,表明厚垣孢子产生和菌丝生长的最佳碳氮比并不一致。此外,维生素可明显促进洛斯里被毛孢的产孢与菌丝生长,且以VB1效果最好[24]。本研究也显示,VB1可显著提高厚垣孢子的产量。
Arias等[32]报道,线虫、吸虫及其抽提物能够明显促进D.flagrans厚垣孢子的产生。Anank’ko等[33]报道,与不平衡培养基相比,营养平衡的培养基能够提高D.flagrans厚垣孢子产量;在液体培养基中加入400~1 600条全冠复活线虫(Panagrellusredivivus)后,厚垣孢子的数量达到1.02×105mL-1,与不加线虫相比增加了3倍。然而加线虫的方法在工业生产中难以施行。Gardner等[25]使用两阶段培养法,首先将菌种接种至MYPG(含有麦芽提取物、酵母抽提物、蛋白胨和葡萄糖)培养基中培养,待菌丝生长至对数期后,再将菌丝转接至含10 g/L淀粉的VMSM液体培养基中连续培养,如此可使厚垣孢子数量提高到6.2×105mL-1。Santurio等[34]使用液固双相培养法,先将D.flagrans接种到沙保氏肉汤中培养作为液体种子液,然后将液体培养物接种到以玉米、大米等谷粒为基础的培养基中,发现与单相培养相比孢子产量有所提高。本研究在单因素试验基础上,通过正交试验得到D.flagransF088产厚垣孢子和菌丝生长的最佳配方为:白糖30 g、大豆蛋白胨4 g、MgSO41 g、VB130 mg,去离子水1 000 mL,在此条件下,厚垣孢子产量可达8.64×104cm-2,这为该菌液体发酵工艺的确定提供了参考,后续将对该菌厚垣孢子形成的影响因素和机理进行进一步研究,以建立可工业化应用的培养工艺条件。

