Lung-RADS分级、CT对孤立性肺结节的定性诊断价值
三峡大学人民医院放射科(湖北 宜昌 443000)
孟 瑜 陈爱华 江 龙 段启勇 冷佰桦*
孤立性肺结节(solitary pulmonary nodule,SPN)是肺部良性肿瘤、恶性肿瘤的早期组织形式,由于结节常在30mm以下,对肺功能影响小,临床患者多无明显症状,故检出率低[1]。低剂量CT的广泛运用使得肺癌、肺硬化性血管瘤等肺疾病检出率明显提高,但我国癌症中心2018年的调查显示全国恶性肿瘤新增例数近400万,其中肺癌占20.55%,每年新发病例约78.1万,病情发展的控制依然十分严峻[2]。单文莉等[3]指出这与SPN性质的早期诊断有关,CT检查假阳性率或假阴性率直接影响了筛查结果和后续的治疗是否及时有效。近年来的临床研究发现,通过肺部影像报告和数据系统(lung Imaging reporting and data system,Lung-RADS)分级将结节的分类和处理进行规范、标准化,为结节的良性或恶性诊断提供更多切实可靠的信息,或可更直观地展现结节特征[4]。为明确Lung-RADS分级、CT的诊断价值,本研究对SPN患者资料进行回顾性分析。
1 资料与方法
1.1 临床资料回顾性分析本院2016年7月到2018年4月90例SPN患者资料。其中男67例,女23例;年龄31~76岁,平均年龄(58.3±7.9)岁。纳入标准:所有患者均签署知情同意书;经影像学、手术或经皮穿刺病理等检查,确诊为良恶性SPN[5];结节直径≤3cm,且均为单发;病变均为实质性密度。排除标准:合并心脑血管、肝肾等组织器官严重疾病;存在恶性肿瘤既往史;有肺部手术史或结节治疗史;临床资料不全者。
1.2 CT检查患者均采取GE医疗公司的Revolution GSI CT机行胸部扫描,管电压120kV,管电流80~160mA,球管转速0.5s/rot,螺距1.20∶1,层厚5mm,层间距5mm,矩阵320×320。嘱患者仰卧在检查床上,保持情绪平稳,在深吸气末屏气时开始扫描,扫描范围从肺尖到肺底;病灶数据采集后以1mm标准算法重建,再传到Syngo Via工作站进行多平面重建、容积再现、最大密度投影、表面遮盖法等方法组建图像,以突出病灶的影像特征及与邻近支气管的关系。
1.3 图像分析患者的影像资料均由2位内科临床经验10年以上的主治医师共同进行分析,观察病灶的类型[纯磨玻璃病灶(pGGO)、部分实性结节(mGGO)、实性结节(SSN)]、病灶形态(表面呈分叶、棘突、触须状的团块为Ⅰ型,表面光滑近似规则的团块或小团块为Ⅱ型),病灶的大小(病灶最大层面的最长径和最短径的平均值)、边界、胸膜牵拉、支气管截断、支气管充气、结节与周围血管的关系(有2支以上的粗大血管被结节完全或部分包绕为Ⅰ型,1支粗大血管被结节完全或部分包绕为Ⅱ型,仅有细小血管穿过结节或粗大血管靠近结节为Ⅲ型)。
1.4 Lung-RADS分级[6]Lung-RADS分为基线筛查和基线后筛查,分级标准根据患者的结节大小,分级后结合影像学诊断和病理学检查结果电话、门诊随访2年。0级:不定类别,需增加肺癌CT筛查或比较二次的胸部CT检查;1级:阴性,无结节和确定为良性的结节,恶性概率<1%;2级:良性,实性结节<6mm,非实性结节<20mm或非实性结节≥20mm但3个月以上无明显增长,恶性概率<1%;3级:良性可能,实性结节≥6mm但<8mm或新发结节总直径<6mm,非实性结节≥20mm或新发,恶性概率1%~2%;4A级:可疑,实性结节≥6mm,新发或增长结节的实性成分<4mm,存在支气管充气、截断等表现,恶性概率5%~15%;4B级:可疑,实性结节≥15mm或新发结节≥8mm,恶性概率>15%;4X:具有额外特征的3级或4级结节,或存在恶性倾向的结节。
1.5 统计学方法全部数据初步以EpiData3.1软件校正,处理采用SPSS 22.0软件;“n(%)”形式录入计数资料,并以χ2检验;用ROC曲线分析Lung-RADS分级、CT预测SPN性质的价值;通过约登指数计算Lung-RADS分级、CT的最佳界值;检验水准:P<0.05为比较结果差异有统计学意义。
2 结 果
2.1 90例患者的CT征象结合病理检查结果,90例患者中,26例为良性病灶,64例为恶性病灶。良性组的pGGO病灶率、≤10mm的病灶率显著高于恶性组,病灶形态Ⅰ型、胸膜牵拉、支气管截断、结节与周围血管Ⅰ型率显著低于恶性组,差异均有统计学意义(P<0.05);两组的边界不光整、支气管充气率比较,差异均无统计学意义(P>0.05),见表1。

表1 90例患者的CT征象分析[n(%)]
2.2 Lung-RADS分级90例患者中,Lung-RADS 1级3例,Lung-RADS 2级17例,Lung-RADS 3级23例,Lung-RADS 4A级11例,Lung-RADS 4B级8例,Lung-RADS 4X级2例。
2.3 Lung-RADS分级、CT及联合诊断对SPN的定性分析Lung-RADS分级、CT及联合诊断预测SPN性质的ROC曲线下面积分别为0.678、0.896、0.957(图1)。通过约登指数计算方法,Lung-RADS分级的敏感度66.87%、特异度75.50%、符合度67.03%,CT征象的敏感度81.56%、特异度91.12%、符合度82.78%,联合诊断的敏感度97.25%、特异度96.24%、符合度97.12%。
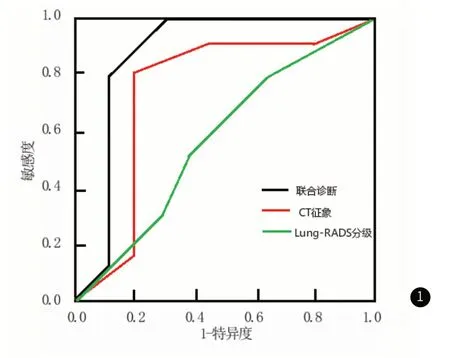
图1 Lung-RADS分级、CT及联合诊断对SPN的定性分析ROC曲线

图2~4 女,45岁,左肺上叶前段存在实性结节,初次检查1mm(图2),三个月后复查6mm(图3),6个月后复查13mm(图4),Lung-RADS 3级。图5 男,57岁,右肺下叶存在12mm实性结节、支气管截断,左侧胸廓容积缩小,Lung-RADS 4A级。图6 女,64岁,左肺下叶背段存在18mm磨玻璃结节,实性部分12mm,双侧胸廓容积缩小,肺门淋巴结肿大,有2支以上的粗大血管被结节部分包绕,Lung-RADS 4X级。图7 男,45岁,右肺下叶存在21mm纯磨玻璃结节。
3 讨 论
随着医疗科技的不断提高,部分晚期肺癌患者的生存率已能达到7年,但肺癌的平均发病率及死亡率在我国仍居第一,胸部CT虽然将SPN的检出率提高了30%以上,但SPN的假阳性率及过度诊断也造成了临床诊疗的难点[7]。SPN的恶性病变主要见于肺腺癌、肺鳞状细胞癌等,良性病变主要见于肺结核球等,但在疾病早期,结节的性质不会有明显特征,且3~6个月后再次进行检查,也可无明显增大,但经手术病理证实又属癌症[8]。这提示还需正确把握CT的作用,重视扫描后处理,联合使用窗技术,来分析病灶的影像特征。本研究结果显示,良性组的病灶类型以pGGO为主,病灶多≤10mm,无粗大血管被结节包绕或仅有少量结节包绕血管。相比mGGO、SSN,pGGO内的支气管不会受到太大影响,而结节的实性成分越多,出现支气管截断的几率就越高,且包绕的粗大血管数量也随之增加[9]。由此可见结节形态与血管分型对提高CT对结节性质的判断准确率有重要意义。同时,曹琪琪等[10]指出在胸膜牵拉CT征象中,恶性结节与胸膜通常呈非宽基底接触,周围胸膜呈牵拉内聚或向中心聚集的皱褶状改变。良性结节则与胸膜呈宽基底接触,且周围胸膜较为平坦或有少数呈非向中心的皱褶改变[11]。
国内外均有报道称,恶性SPN的进展过程通常表现为病灶内实性成分的增加,当病灶达到Lung-RADS 3级以上时,其恶性几率相对较大,此时附加胸部CT筛查或结合组织标本检查结果,可最大程度地提高肺癌早期检出率;当病灶分级≤Lung-RADS 3级时,还可减少低风险结节不必要的筛查,从而降低过度诊断率[12-13]。但这也会在一定程度上使得SPN筛查的敏感度下降。SPN>20mm时,形态、边界、有无毛刺或分叶等特性都会相对清晰地反映在影像学图像上,但SPN≤20mm时,其形态结构常难以准确地显示在常规影像上,若还按照Lung-RADS分级进行基线筛查,就会导致一些恶性结节的漏诊[4]。Lung-RADS分级预测SPN性质的ROC曲线下面积基敏感度、特异度、符合度均低于CT和联合诊断,说明对于pGGO、mGGO、SSN这三种结节,Lung-RADS分级筛查还存在相当的局限性,需结合CT征象进行分析。并且在发现高风险结节或结节影像特征不明确时,适当地增强胸部CT扫描或平扫,使得小结节的细微特征更加三维立体、全面直观,可减少恶性倾向结节的出现[14]。
综上所述,Lung-RADS分级、CT在SPN的定性诊断中均有一定的价值,但CT的诊断价值较Lung-RADS分级更高,临床可将二者进行联合应用,针对结节的实性成分、胸膜牵拉情况、周围血管关系等进行详细分析,进而降低SPN筛查的假阳性率,为临床防治肺癌及其他肺部疾病的发生发展提供依据。

