糖皮质激素治疗对ITP患者外周血趋化因子受体CCR3、CCR5、CXCR3表达的影响
赵霞 杨倩 刘志何 高燕 肖淑欣(青岛大学附属医院血液内科,青岛266000)
原发免疫性血小板减少症(primary immune thrombocytopenia,ITP)是临床最常见的自身免疫性出血性疾病[1-2]。研究证明,慢性ITP是一种以Th1细胞异常聚集为特征的Th1优势性自身免疫性疾病[3-4]。Th1和Th2细胞分别表达不同的趋化因子受体,并与不同的趋化因子结合,其中Th1细胞优势性表达CXCR3、CCR5,Th2细胞优势性表达CCR3,从而调控Th1和Th2细胞活化与极化[5]。在CD4+T淋巴细胞表面,以上趋化因子受体可作为区分Th1和Th2细胞的标志物[6]。尽管目前ITP发病机制的研究较多,但多数是基于混合淋巴细胞培养的研究,本 文 旨 在 研 究CCR3、CCR5、CXCR3在ITP患 者CD4+T淋巴细胞表面的表达情况及其临床意义。
1 资料与方法
1.1 资料
1.1.1 研究对象选取2017年7月至2019年6月我院新诊断ITP患者40例,其中男性18例,女性22例,中位年龄[35(18~60)]岁,中位血小板计数(PLT)为[18(5~29)]×109L-1,诊断标准参考文献[1]。以20名健康志愿者为对照,其中男性8例,女性12例,中位年龄[33(21~48)]岁,中位PLT[180(135~280)]×109L-1。所有研究对象知情同意。
1.1.2 主要试剂与仪器RPMI1640培养液(美国Gibco公司);Ficoll分离液(天津灏洋化学试剂有限公司);植物血凝素(PHA,终浓度50 mg/L,Sigma公司);TRIzol试剂(美国Invitrogen公司);SYBR Green PCR试剂盒(大连宝生物工程有限公司);细胞总蛋白抽提试剂盒(DBI-1017,Ⅳ型,美国DBI公司);Bradford试剂盒(P0006,碧云天);硝酸纤维素膜(NC膜,武汉博士德公司);丽春红染色液(武汉博士德公司);Western blot-抗稀释液(碧云天);CD4-FITC(Dyclone);α-Tublin抗体(美国DBI公司);抗FITC免疫磁珠(Miltenyi Biotec);磁性细胞分离柱(Milte‑nyi Biotec);VarioMACS磁性分离器(Miltenyi Bio‑tec);FACScan流式细胞仪(美国Becton-Diskinson公司);荧光定量PCR仪(ABI PRISM 7500,美国Ap‑plied Biosytems公司);多功能凝胶图像成像仪(Al‑pha Innotec公司)。
1.2 方法
1.2.1 临床治疗方案给予40例ITP患者泼尼松治疗,起始剂量为1.0 mg/(kg·d),对初始PLT<10×109L-1或有明显出血患者同时给予人免疫球蛋白0.4 g/(kg·d),连续3~5 d,病情稳定后快速减至最小维持量(<15 mg/d),如治疗4周PLT<30×109L-1或PLT增加<基础值的2倍或有出血,说明泼尼松治疗无效,迅速减量至停用。治疗过程中给予止血药物防治出血以及输注血小板等对症治疗。34例患者接受激素治疗后,PLT1周左右上升至正常水平(5~14 d),为激素治疗有效;6例患者激素治疗无效,迅速减量至停用,采用二线或其他治疗方案。
1.2.2 外周血单个核细胞分离、冻存及复苏肝素抗凝管采集晨起健康志愿者及治疗前后2周ITP患者外周血,Ficoll分离液密度梯度分离外周血单个核细胞,重悬于含10%FBS的RPMI1640培养液,调整细胞浓度为1×107个/ml,冻存,含20%DMSO的RPMI1640培养液与等体积外周血单个核细胞悬液混合,快速分装于低温保存管中,4℃放置15 min,降温仪程序控制降温。复苏细胞时以1℃/min速度降至-20℃,再以4℃/min降至-80℃,投入-196℃液氮中。自液氮取出细胞标本后立即于37℃水浴箱中快速复温,待标本即将溶化时,加入RPMI1640培养液洗涤细胞1次,调整细胞浓度至1×107个/ml,0.2%台盼蓝染色,计算细胞拒染率。
1.2.3 外周血CD4+T淋巴细胞分选复苏后的单个核细胞悬液4℃孵育15 min,加入CD4-FITC 4℃孵育60 min,PBS冲洗,去上清,加入抗FITC免疫磁珠4℃孵育60 min,轻轻振荡,10 min/次,PBS冲洗并稀释,过磁性细胞分离柱,VarioMACS磁性分离器分离细胞,调整细胞密度至1×106个/ml,FACScan流式细胞仪检测其表面标志物,调整细胞密度至1×106个/ml,重悬于含10%FBS的RPMI1640培养液,同时加入植物血凝素培养备用。
1.2.4 RT-PCR检测CCR3、CCR5、CXCR3基因表达TRIzol试剂提取CD4+T淋巴细胞总RNA,采用荧光定量PCR仪进行PCR检测,以β-actin为内参;CCR3、CCR5、CXCR3上下游引物由TaKaRa公司设计,上海生物工程有限公司合成(表1)。采用两步法PCR扩增标准程序:95℃30 s,95℃5 s,60℃30 s,40个循环。各样本设3个复孔,2-ΔΔCt法计算。

表1 RT-PCR引物序列Tab.1 RT-PCR primer sequences
1.2.5 Western blot检测CCR3、CXCR3、CCR5蛋白表达细胞总蛋白抽提试剂盒抽提分离得到CD4+T淋巴细胞细胞总蛋白,Bradford试剂盒测定蛋白浓度,加入上样缓冲液,100℃煮沸10 min,将等量ITP患者组与对照组蛋白加入SDS-PAGE上样孔内,进行SDS-PAGE电泳,转至NC膜,丽春红染色液染色观察转膜效果。加入50 g/L脱脂奶粉摇床室温封闭60 min,Western blot-抗稀释液稀释兔抗CCR3抗体(1∶1 000)、兔抗CCR5抗体(1∶500)、兔抗CXCR3抗体(1∶1 000),以α-Tublin抗体为内参,4℃封闭过夜,TBS-T缓冲液(含20%Tween20的TBS缓冲液)洗膜3次,10 min/次,加入稀释的(1∶5 000)辣根过氧化物酶标记的山羊抗兔二抗室温孵育90 min,TBST缓冲液洗膜,ECL显色定影,多功能凝胶图像成像仪获取蛋白扫描图片,ScnImage软件调整图片并进行相对定量分析。
1.3 统计学处理采用SPSS19.0软件进行统计学分析,CCR3、CCR5、CXCR3蛋白及mRNA表达以±s表示,两组均数比较采用t检验,多组间均数比较采用单因素方差分析进行SNK⁃q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 外周血T淋巴细胞分选、鉴定健康志愿者及ITP患者外周血单个核细胞冻存复苏后细胞仍有较高活性,细胞回收率约为75%,采用免疫磁珠法分选出CD4+T淋巴细胞后,流式细胞仪测定其纯度高达93%以上(表2)。

表2 免疫磁珠分选前后CD4+T淋巴细胞纯度(xˉ±s,%)Tab.2 CD4+T lymphocyte purity before and after immunomagnetic bead sorting(xˉ±s,%)
2.2 ITP患者治疗前后及健康志愿者CCR3、CCR5、CXCR3 mRNA表达RT-PCR结果显示,ITP患者治疗前CD4+T淋巴细胞Th1细胞趋化因子受体CCR5、CXCR3 mRNA表达显著高于正常对照组(P<0.05),ITP患者治疗后CD4+T淋巴细胞Th1细胞趋化因子受体CCR5、CXCR3 mRNA表达显著低于治疗前(P<0.05),而ITP患者治疗前CD4+T淋巴细胞Th2细胞趋化因子受体CCR3 mRNA表达显著低于正常对照组(P<0.05),ITP患者治疗后CD4+T淋巴细胞Th2细胞趋化因子受体CCR3 mRNA表达显著高于治疗前(P<0.05,表3)。
表3 ITP患者及正常对照CXCR3、CCR5、CCR3 mRNA表达(±s)Tab.3 CXCR3,CCR5 and CCR3 mRNA expressions of patients with ITP and normal controls(±s)
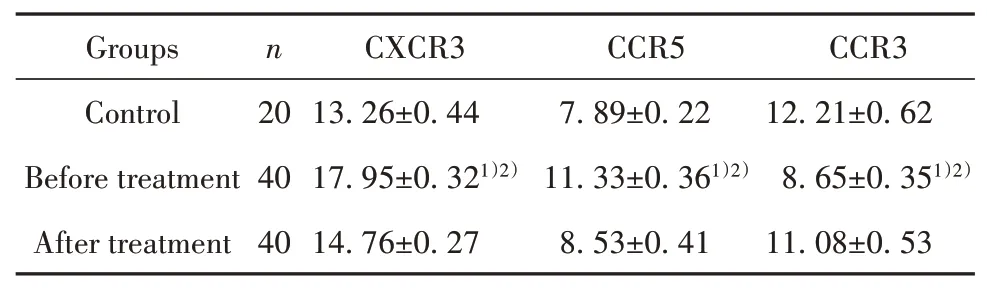
表3 ITP患者及正常对照CXCR3、CCR5、CCR3 mRNA表达(±s)Tab.3 CXCR3,CCR5 and CCR3 mRNA expressions of patients with ITP and normal controls(±s)
Note:1)P<0.05 vs Control;2)P<0.05 vs After treatment.
?
2.3 ITP患者激素治疗后不同疗效组CCR3、CCR5、CXCR3 mRNA表达RT-PCR结果显示,ITP患者治疗有效组治疗后CD4+T淋巴细胞Th1细胞趋化因子受体CCR5、CXCR3 mRNA表达与正常对照组差异无统计学意义(P>0.05),治疗无效组患者治疗后CCR5、CXCR3 mRNA表达显著高于对照组和有效组(P<0.05);而ITP患者治疗有效组治疗后CD4+T淋巴细胞Th2细胞趋化因子受体CCR3 mRNA表达与正常对照组差异无统计学意义(P>0.05),治疗无效组患者治疗后CD4+T淋巴细胞Th2细胞趋化因子受体CCR3 mRNA表达显著低于对照组和有效组(P<0.05,表4)。
表4 糖皮质激素治疗后不同疗效组ITP患者CXCR3、CCR5、CCR3 mRNA表达(±s)Tab.4 CXCR3,CCR5 and CCR3 mRNA expressions of patients with ITP treated with different therapeu⁃tic effects after glucocorticoid therapy(±s)
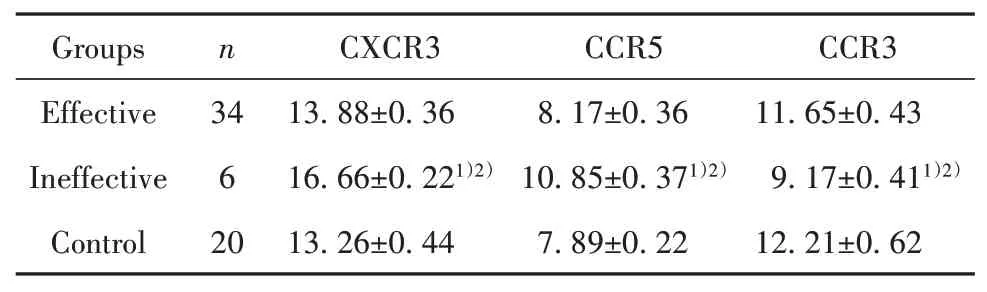
表4 糖皮质激素治疗后不同疗效组ITP患者CXCR3、CCR5、CCR3 mRNA表达(±s)Tab.4 CXCR3,CCR5 and CCR3 mRNA expressions of patients with ITP treated with different therapeu⁃tic effects after glucocorticoid therapy(±s)
Note:1)P<0.05 vs Control;2)P<0.05 vs Effective.
?
2.4 ITP患者治疗前后及正常对照细胞趋化因子受体CCR3、CCR5、CXCR3蛋白表达ITP患者治疗前CD4+T淋巴细胞Th1细胞趋化因子受体CCR5、CXCR3膜蛋白表达较健康志愿者显著升高(P<0.05),ITP患者治疗后CD4+T淋巴细胞Th1细胞趋化因子受体CCR5、CXCR3膜蛋白表达较治疗前显著降低(P<0.05);ITP患者治疗前CD4+T淋巴细胞Th2细胞趋化因子受体CCR3蛋白表达较健康志愿者显著降低(P<0.05),ITP患者治疗后CD4+T淋巴细胞Th2细胞趋化因子受体CCR3蛋白表达较治疗前显著升高(P<0.05,表5)。
表5 ITP患者治疗前后及正常对照组外周血CD4+T淋巴细胞CCR3、CCR5、CXCR3蛋白表达(±s)Tab.5 Protein expressions of CCR3,CCR5 and CXCR3 in CD4+T lymphocyte of patients with ITP and normal controls(±s)
Note:1)P<0.05 vs Control;2)P<0.05 vs After treatment.
?
3 讨论
ITP是一种获得性自身免疫性疾病,目前认为其发病机制与免疫系统相关,即自身抗体对抗自身血小板,导致网状内皮系统(尤其是脾内巨噬细胞)通过Fc受体介导的吞噬作用增强,血小板破坏增加[7]。尽管其病理过程由自身抗体介导,但研究表明ITP患者抗血小板自身抗体受辅助性T细胞和细胞因子调控[8]。细胞免疫异常在ITP病理生理过程中起关键作用。
ITP患者体内存在T细胞亚群、细胞因子及细胞趋化因子受体等异常。T淋巴细胞是一种重要的免疫活性细胞,在免疫反应中起重要作用,是细胞免疫和体液免疫的重要环节。按功能可分为辅助性T细胞(Th)、诱导性T细胞(Ti)、抑制性T细胞(Ts)和杀伤性T细胞(Tc)。按所分泌的细胞因子不同,Th细胞可分为Th1和Th2细胞2个亚群。Th细胞向免疫发生部位迁移是多细胞因子参与的复杂过程,趋化因子是一种具有趋化作用的细胞因子,在调控免疫细胞定向迁移方面具有重要作用。趋化因子受体是一类介导趋化因子行使功能的GTP蛋白偶联的跨膜受体(GPCRs),通常表达于免疫细胞和内皮细胞膜上。根据配体不同可将趋化因子受体分为4个亚家族:CXC类受体(CXCR)、CC类受体(CCR)、C类受体(CR)和CX3C类受体(CX3CR)[9]。研究表明,细胞趋化因子及其受体在Th细胞极化方面具有重要作用[10]。T淋巴细胞极化为Th1或Th2细胞是细胞应答的重要特征,趋化因子可通过诱导Th0细胞定向分化为Th1细胞或Th2细胞,Th1细胞特征性表 达CCR5、CXCR3,受 趋化 因子 如CCL3、CCL5(RANTES)、CCL9(MIG)和CXCL10(IP210)趋化至病变组织,并分泌多种趋化因子以募集更多淋巴细胞,引发Th1型炎症反应[11-12]。Th2细胞特征表达CCR3、CCR4、CCR8,在趋化因子CCL11、24、26(eo‑taxin21、2、3)、CCL8、7、13(MCP22、3、4)作用下进入损伤组织,引发Th2型炎症反应[13]。
研究证实,多种自身免疫性疾病及淋巴造血系统等疾病发生均与细胞趋化因子及其受体异常有关[14-17]。Th1型趋化因子受体CXCR3和CCR5在ITP患者脾脏中高表达,提示Th1型趋化因子受体CX‑CR3和CCR5参与ITP脾脏免疫反应[18]。但ITP患者外周血CD4+T淋巴细胞膜趋化因子受体异常及在治疗过程的变化等情况鲜有报道。
本研究采用免疫磁珠分选CD4+T淋巴细胞,RTPCR检测ITP患者治疗前后与正常对照组外周血CD4+T淋巴细胞CCR3、CCR5、CXCR3表达,Western blot法检测ITP患者治疗前后与正常对照组外周血CD4+T淋巴细胞CCR3、CCR5、CXCR3蛋白表达,结果发现,ITP患者治疗前CD4+T淋巴细胞CCR5、CX‑CR3 mRNA水平较健康志愿者显著升高,治疗后较治疗前显著降低;而ITP患者治疗前CCR3 mRNA水平较健康志愿者显著降低,治疗后较治疗前显著升高,Western blot检测结果与RT-PCR检测结果一致。对比激素治疗有效和无效ITP患者及正常对照组RT-PCR结果发现,ITP患者治疗有效组治疗后CD4+T淋巴细胞Th1细胞趋化因子受体CCR5 mRNA、CXCR3 mRNA可降低至正常水平,但治疗无效组治疗后CCR5、CXCR3 mRNA水平显著高于正常对照组;ITP患者治疗有效组治疗后CD4+T淋巴细胞Th2细胞趋化因子受体CCR3 mRNA水平可上升至正常水平,但治疗无效组治疗后仍显著低于正常对照组,因此推测当免疫反应受到调节异常时,ITP患者Th1细胞趋化因子受体CCR5、CXCR3表达上调,而Th2细胞趋化因子受体CCR3表达下调,通过与机体内部异常的细胞因子及细胞趋化因子相互作用,使ITP进一步极化为Th1细胞,导致疾病进展。
多个动物模型已证实CXCR3、CCR5、CCR3趋化因子受体可相互作用,因此,针对趋化因子受体的靶向治疗有望成为自身免疫性疾病靶向治疗的新方法[14,19-20]。在体外实验的基础上,课题组将进一步进行动物模型实验,为临床应用针对趋化因子受体相关的靶向药物治疗ITP提供实验依据。

