银屑病患者血清对真皮间充质干细胞基因表达及功能的影响①
王方迪 侯瑞霞 赵新程 李俊琴 张开明 李新华
(山西医科大学第二临床医学院,太原030009)
间充质干细胞(mesenchymal stem cells,MSCs)是一群中胚层来源的多能干细胞,可通过释放细胞因子等对微环境中的T细胞、B细胞、自然杀伤细胞(NK细胞)、树突状细胞(DC细胞)等免疫细胞的活化、增殖和炎症因子的释放等发挥抑制作用,因而被认为是一种免疫抑制细胞[1]。近年来研究发现,银屑病患者的皮损MSCs具有特殊的细胞因子表达特点和功能,可能参与银屑病的发生发展,本实验室从银屑病患者皮损处分离出的真皮间充质干细胞(dermal mesenchymal stem cells,DMSCs)的炎症相关基因如白细胞介素1β(IL-1β)、趋化因子14(CXCL14)等表达异常,对T细胞增殖的抑制作用减弱[2-4],另外CAMPANATI等[5]也发现银屑病皮损中分离出的MSCs的Th1、Th17型 炎 症 因 子 高 表 达 如IFN-γ、IL-17、IL-23、TNF-α等,ORCIANI等[6]同样研究发现银屑病皮损处MSCs的血管内皮生成因子(VEGF)及NO分泌增多。MSCs的功能可受到IFN-γ、TNF-α等炎症因子的影响[7],因此推测银屑病患者皮损异常表达的Th1/Th17炎症因子可能诱导了局部DMSCs功能的异常。为探讨银屑病皮损处DMSCs异常的原因,进一步明确DMSCs在银屑病发病过程中的作用,本研究拟用银屑病患者血清作用于正常DMSCs,观察其对DMSCs免疫功能相关细胞因子表达水平的影响以及其对PHA诱导的T细胞增殖的抑制作用。
1 资料与方法
1.1 资料
1.1.1 标本来源收集银屑病患者20例,均经临床和病理确诊为寻常型银屑病,男13例,女7例,年龄18~60岁,病程10~20年,选择20例同期在我院体检正常的志愿者作为对照组及5例在我院泌尿外科、整形外科进行手术的健康志愿者的多余皮肤组织,年龄、性别与银屑病患者相匹配,所有志愿者均排除银屑病等免疫相关性疾病。本研究已通过太原市中心医院伦理委员会批准,所有样本取材前均征得本人同意,并签署知情同意书。所有对象均排除其他慢性炎症性疾病以及自身免疫疾病,取材前1个月内未系统使用过糖皮质激素、生物制剂及免疫抑制剂等。
1.1.2 主要试剂与仪器DMEM/F12培养基、胎牛血清(FBS)购自美国HyClone公司;碱性成纤维细胞生长因子(bFGF)、Dispase酶、淋巴细胞分离液及胰蛋白酶购自美国Sigma公司;Transwell小室购自美国Corning公司;倒置相差显微镜购自日本Olym‑pus公司;MACS CD3磁珠、LS分选柱和Vario MACS分选器购自德国Miltenyi Biotec公司;37℃恒温培养箱购自美国Sheldon Manufactuing Inc公司;实时荧光定量PCR仪购自美国ABI公司;SYBR premix EX‑TaqⅡ荧光定量PCR试剂盒购自日本TaKaRa公司。
1.2 方法
1.2.1 DMSCs的分离和培养用本实验室之前研究描述的方法进行5例皮肤组织的DMSCs的分离和培养[8],无菌条件下切取皮肤组织1 mm3大小,去除皮下组织及角质层,加入0.25% Dispase酶37℃消化2~4 h,分离真、表皮,收集真皮部分,进一步将组织块剪碎,吸管吹打,筛网过滤,滤过液离心弃上清,沉淀中加含10%胎牛血清的DMEM/F12培养基,以1.0×105个/cm2密度接种于T25培养瓶内,置于37℃、5%CO2饱和湿度培养箱中孵育。72 h后弃去未贴壁细胞,每3~4 d半量换液1次。待细胞融合90%以上时,用0.25%胰酶消化传代。细胞传至第三代后收获计数,用流式细胞仪分析细胞表面标记物如CD29、CD44、CD34、CD105、CD45及HLA-DR,体外成骨和成脂分化实验也如之前研究所述[8]。
1.2.2 血清采集及DMSCs培养40例研究对象(20例银屑病、20例正常对照)均清晨空腹采集静脉血液5 ml,置于添加了促凝剂的采血管中,4 000 r/min离心5 min后吸取血清,过滤后放置于低温冰箱-80℃冷冻保存备用。待DMSCs传至第三代并有70%以上贴壁后,弃原培养基,将含50%人血清(预实验摸索确定)的DMEM/F12培养基加入细胞中,置于37℃、5%CO2、饱和湿度培养箱中培养24 h后胰酶消化,收获细胞。
1.2.3 实时荧光定量PCR采用Trizol法提取DMSCs的总RNA,将RNA反转录成cDNA,PCR反应体积为20µl,包括SYBR premix EX TaqⅡ10µl,ROX Reference Dye 0.4 µl,上下游引物各0.4 µl,cDNA模板2 µl,ddH2O 6.8 µl。扩增条件为95℃10 min,95℃30 s,退火30 s,72℃延伸30 s,共40个循环。以β-actin为内参进行扩增,每个样品重复2次,得到每个样品的Ct值,采用2-ΔΔCt法进行结果分析。荧光定量引物及序列见表1。

表1 各基因引物序列Tab.1 Primer sequences of genes
1.2.4 T细胞分离及共培养采集3例正常对照者(取自上述20例体检者)外周血5 ml,EDTA抗凝,采用密度梯度离心法分离外周血单个核细胞(periph‑eral blood mononuclear cells,PBMCs)[4],分 离 出 的PBMCs用PBS洗2次,根据说明书用MACS CD3磁珠,LS分选柱和VarioMACS分选器分选出T细胞,调 整 细 胞 浓 度 为6.7×105个/ml,血 清 刺 激 后 的DMSCs为4×105个/ml待用。用PHA(植物凝集素)刺激T细胞诱导其活化,PHA加入细胞悬液的浓度为50µg/ml。
本实验分为3组:①正常血清组:正常血清作用的DMSCs(HD-tr-DMSCs)+T细胞;②银屑病血清组:银屑病血清作用的DMSCs(Pso-tr-DMSCs)+T细胞;③单独T细胞培养为对照。所有培养组均用12孔Transwell板共培养,DMSCs种于上室(500 µl/孔),T细胞种于下室(1.5 ml/孔)(DMSCs∶T=1∶5),并置于37℃、5%CO2饱和湿度培养箱中孵育72 h,收集悬浮细胞以备后续检测。
1.2.5 CCK-8检测T细胞的增殖率T细胞与不同刺激作用的DMSCs共培养72 h后收获,用相同的稀释倍数将细胞按每孔100µl接种于96孔板中,置于37℃、5%CO2饱和湿度培养箱中孵育24 h后,每孔加入10µl CCK-8,继续孵育4 h,酶标仪检测450 nm处的吸光度值(即OD值),用OD值反映T细胞的增殖情况。
1.3 统计学处理采用SPSS19.0软件进行统计学分析,数据用±s表示,两组间比较采用t检验,大于两组时组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 皮肤间充质干细胞的形态在倒置显微镜下观察,细胞早期未贴壁,呈小圆形,培养2 d后可见长梭形细胞贴壁,随着培养时间延长,贴壁细胞增多,细胞逐渐增大,基本为梭形成纤维细胞形态且互相连接,培养14 d左右,细胞90%融合,梭形排列,呈漩涡状。血清加入细胞后,细胞生长速度加快,形态未发生明显变化,银屑病组与正常血清组无差别。见图1。
图1 血清作用后的DMSCs形态(×100)Fig.1 Morphology of DMSCs after serum action(×100)
2.2 血清作用后DMSCs的IL-10、PGE2、TLR4表达水平荧光定量PCR检测结果见表2,与HD-tr-DMSCs表达水平相比,Pso-tr-DMSCs的IL-10、前列腺素E2(PGE2)、Toll样受体4(TLR4)低表达,分别为对照组的0.48倍、0.11倍、0.37倍,差异有统计学意义(P<0.05)。
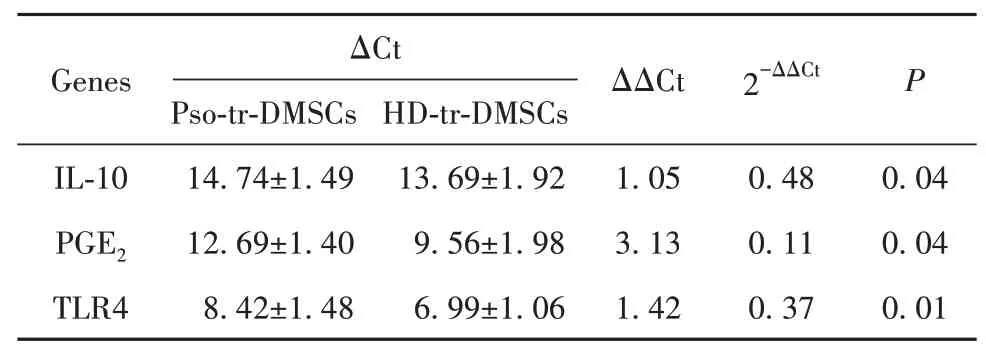
表2 血清作用后各基因mRNA表达水平Tab.2 mRNA expression levels of genes treated with serum
2.3 不同血清刺激后的DMSCs对PHA活化的T细胞增殖能力的影响为明确银屑病患者血清对DMSCs免疫功能的影响,将Pso-tr-DMSCs与PHA活化后的T细胞共培养,同时以HD-tr-DMSCs以及T细胞单独培养作为对照。共培养结束后采用CCK-8法检测各组T细胞的增殖能力。结果如图2所示,相比活化的T细胞单独培养组,与Pso-tr-DMSCs及HD-tr-DMSCs共培养的T细胞的增殖能力均显著降低,且Pso-tr-DMSCs组的T细胞增殖能力较HD-tr-DMSCs组高,说明不管是正常血清还是银屑病血清作用于正常DMSCs后,均可发挥抑制活化T细胞增殖的作用,且银屑病血清可使DMSCs的免疫抑制能力减弱,各组差异均具有统计学意义(P<0.01)。
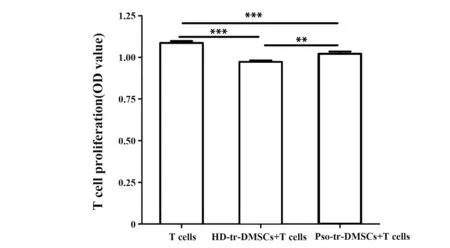
图2 与不同组DMSCs共培养后的T细胞增殖情况Fig.2 Proliferation of T cells co-cultured with different DMSCs
3 讨论
银屑病目前被认为是一种以T细胞为主介导,多种免疫细胞共同参与的自身免疫性疾病[9]。众多研究发现,银屑病患者血清中IL-1、IL-6、TNF-α、IL-8、IL-22、IL-17等炎症性细胞因子高表达,且部分炎症因子的表达水平与皮损严重程度呈正相关[10]。此外BOEHNCKE等[11]认为,银屑病的斑块是由皮损处的细胞与免疫系统的作用紊乱引起的,树突状细胞和T细胞是关键的效应细胞,皮损处活化的树突状细胞释放TNF-α及IL-23,诱导T细胞活化,Th1、Th17、Th22细胞增殖同时释放了IFN-γ、TNF-α、IL-17、IL-22等炎症因子,炎症因子协同作用刺激角质形成细胞分泌TNF-α、IL-20、IL-8等炎症趋化因子,各种细胞的功能紊乱及炎症因子的相互作用在银屑病皮损局部形成了炎症性微环境[6]。
间充质干细胞几乎存在于所有组织中,具有多向分化潜能和免疫调节特性,可通过细胞间直接接触或者释放细胞因子、趋化因子等方式发挥其免疫调节功能[1]。MSCs的免疫调节机制尚不完全清楚,据报道其可能的机制有:①MSCs通过吲哚胺2,3-双加氧酶(IDO)、PGE2、转化生长因子β(TGF-β)、IFNγ、TLR4等抑制NK细胞的增殖及杀伤功能[12-14];②分泌PGE2促使巨噬细胞向抗炎表型分化[15-16];③通过分泌IL-6、PGE2等抑制抗原提呈细胞如树突状细胞的分化成熟[17];④分泌IDO、TGF-β、IL-10等抑制Th1、Th17的产生及其细胞因子的分泌,促进Th2产生,诱导Treg产生[18-19];⑤通过细胞间接触抑制B细胞的增殖及功能[19]。
本研究前期及国内外研究均发现,银屑病患者皮损中分离的DMSCs在基因表达模式、促血管生成功能及免疫调节功能等方面均存在一定异常[2-6]。XU等[7]用炎症因子TNF-α、IFN-γ刺激骨髓MSCs后,发现miR-155显著高表达,且miR-155可通过靶向TAB2抑制诱导型一氧化氮合酶(iNOS)的产生,从而削弱了MSCs的免疫抑制能力,降低对活化T细胞增殖的抑制作用。因此推测,银屑病皮损MSCs功能的异常可能由皮损处升高的多种炎症因子诱导。
MSCs的免疫调节功能主要通过PGE2、IL-10、IDO、TLR4等细胞因子实现。因此,本实验在体外用银屑病患者的血清模拟其体内的炎症环境,观察其对正常DMSCs的IL-10、PGE2、TLR4表达水平的影响,并将不同血清处理过的DMSCs与PHA活化的T细胞共培养,观察其对T细胞增殖抑制功能的变化。结果发现,患者血清处理可引起正常DMSCs低表达抗炎因子TLR4、IL-10、PGE2,且在体外抑制活化T细胞增殖的能力降低,这种异常与银屑病患者皮损处的DMSCs相似。以上结果提示,银屑病患者血清中的炎症因子确实可以抑制DMSCs抗炎因子的表达,进而降低DMSCs的免疫抑制功能。
研究表明,MSCs的免疫调节功能可受多种因素的影响[20-23],如前所述,炎症因子刺激MSCs后高表达的miR-155可通过靶向TAB2降低MSCs的免疫抑制功能,但是,关于炎症因子对MSCs免疫调节功能的影响也有不同的报道,如在炎症早期,促炎细胞因子如IFN-γ、TNF-α、IL-1等水平较低,MSCs会产生大量的促炎因子及趋化因子促进炎症及免疫反应,而在炎症的晚期,促炎细胞因子水平较高,MSCs则会获得免疫抑制表型,产生大量的IDO、NO及趋化因子,协同作用抑制免疫反应[20-22],MSCs表型的变化也与TLR的激活有关,但目前关于TLR4活化后会促进免疫还是抑制免疫暂时没有定论[23]。
综上所述,银屑病血清中升高的炎症因子可能引起其作用的MSCs表型变化,进而引起其细胞因子表达及功能的变化。当然,尚需进一步更详细的研究来明确患者的血清中引起DMSCs发生了什么样的变化,以及这些变化所涉及的分子机制。

