TNF-α与系统性硬化病关系的研究进展①
陶志清 赵铖(广西医科大学第一附属医院风湿免疫科,南宁530021)
系统性硬化病(systemic sclerosis,SSc)是一种多系统结缔组织疾病,其主要病理特征包括异常免疫激活、血管病变和组织纤维化,病因不明,较多认为是血管病变和免疫系统的活化与炎症介质的产生导致不受控制的成纤维细胞活化[1]。SSc的典型表现是皮肤紧绷和雷诺现象,通常开始于四肢,尤其是手指和足趾的皮肤。根据皮肤受累程度,SSc可分为两大类:局限性全身硬化(lcSSc)和弥漫性全身硬化(dcSSc)。在dcSSc中,纤维化遍及皮肤和内脏器官,而在lcSSc中,纤维化主要局限于手、手臂和面部。鉴于临床症状和体征的异质性,美国风湿病学会/欧洲风湿病联盟于2013年制定了新的分类标准[2]。SSc相关的肺间质疾病和肺动脉高压的发展,是SSc中最常见的致残和死亡原因[3]。TNF-α是一种多效细胞因子,参与诱导细胞凋亡、诱导炎症、抑制病毒复制和纤维化过程中兴奋性白细胞介素的信号传导。TNF-α在感染的初始宿主反应和各种免疫介导的疾病发病机制中具有重要作用。研究发现,在SSc患者血清中TNF-α水平升高,并有利于肺纤维化和肺动脉高压的发展[4]。TNF-α通过调节纤维增生功能参与炎症、纤维化、血管内皮的激活以及免疫反应的调节。因此,它被认为是SSc进展的主要因素。
1 系统性硬化病发病机制
1.1 遗传相关因素流行病学研究表明,SSc患者的一级亲属患SSc的风险显著增加:风险为1.6%,而在普通人群中,患SSc的风险为0.026%[5]。在这些集群中,亲属往往具有相同的疾病相关的自身抗体。这些数据表明SSc在亲属关系的人群中的遗传易感性[5-6]。
1.2 内分泌相关因素有研究表明,内分泌可能参与了疾病状态的启动或传播。女性性激素雌二醇增加了某些重要的SSc介质(干扰素-γ、白细胞介素-1和肿瘤坏死因子)的促纤维化作用[7]。
1.3 感染相关因素关于硬皮病感染触发的一个假说是关于潜伏性巨细胞病毒(CMV)感染的作用,在SSc中发现的潜在致病的自体抗原与巨细胞病毒(CMV)上的UL94蛋白结合,也与人内皮细胞表面结合,从而引起内皮细胞凋亡(内皮细胞损伤通常被认为是SSc疾病过程中的早期事件)[8]。
1.4 肿瘤相关因素研究发现,硬皮病和ARA抗体患者的恶性肿瘤发生率较高,且在这一亚群中,结缔组织病的发生与癌症的诊断有密切的时间关系[9-10]。JOSEPH等[11]从这一亚组患者提取的肿瘤细胞中发现了RNA聚合酶Ⅲ多肽A基因(POL3RA)的改变,但在来自相同患者的对照组织或来自其他硬皮病亚组患者的肿瘤组织中没有发现。
1.5 免疫相关因素在细胞黏附分子活性增加的情况下,SSc中CD4阳性T细胞的迁移和活化增强[12],这种细胞类型主要见于皮肤和肺组织的淋巴细胞浸润[13-14]。辅助性T细胞17(Th17)亚群的分化可能是SSc的一个重要过程,这些细胞具有促纤维化作用[15]。
1.6 环境相关因素职业和工业接触氯乙烯、二氧化硅粉尘和有机溶剂被认为是导致SSc的原因[16]。
2 TNF-α信号通路概述
2.1 TNF-α形成和家族TNF按其结构分为两型:TNF-α和TNF-β,其中TNF-α的生物学活性占TNF总活性的70%~95%。TNF-α是一种多效细胞因子,主要由单核细胞和巨噬细胞产生,也由淋巴细胞和NK细胞产生。TNF-α以可溶性和膜结合形式存在。可溶性血浆形式的TNF-α被金属蛋白酶从膜形式上切割下来,该金属蛋白酶称为TNF-α转化酶(TNF-α-converting enzyme,TACE),属于ADAMs家族。可溶性TNF-α是分子量为17 kD的蛋白质,由157个氨基酸组成,形成受体激活的同源三聚体。目前已有19个TNF家族成员和29个受体被鉴定[17]。
2.2 TNF-α受体1和TNF-α受体2 TNF-α的活性是通过其两种受体TNF-R1(p55)和TNF-R2(p75)介导的,它们的信号传导活性不同。TNF-R1通常是促凋亡的,而TNF-R2通常是抗细胞凋亡的[18]。TNF-R1和TNF-R2具有相似的细胞外TNF结合结构,其特征在于四个重复的富含半胱氨酸的结构域,但具有不同的细胞内结构域[19]。TNF-R1和TNF-R2之间的主要结构差异导致其生物活性的差异,其主要原因在于TNF-R2缺乏细胞内死亡域。在许多系统中,TNF-α通过激活TNF-R1促进细胞凋亡,通过TNF-R2引起促存活信号传导[20]。在结合TNF-α后,TNF-R1募集衔接蛋白TNF-R1相关死亡结构域蛋白(TRADD)及其下游半胱天冬酶(即胱天蛋白酶8),引起细胞凋亡[21],相反,当TNF-α激活TNF-R2时,TNF受体相关因子(TRAF2)募集,从而刺激具有抗凋亡特性的核因子κB(nuclear factorκB,NF-κB),与可溶性TNF-α相比,已知TNF-R2对膜结合TNF-α具有更高的亲和力。TNF-R2的激活与Treg细胞的扩增和免疫抑制有关[20]。有研究推测TNFR2参与了纤维形成,TNFR2的过量表达,随后蛋白酶脱落,与灭活的可溶性TNF相结合而产生抗炎作用。
3 TNF-α的生理功能
TNF-α具有多效性,TNF-α已被证实可调节多种炎症和自身免疫过程。低水平的TNF-α可调节机体免疫反应起到抗感染的作用,高水平的TNF-α又会诱导其他炎症因子如IL-1、IL-6、IL-8、IL-10、IL-12等的分泌,促进体内炎症反应[22-23]。TNF-α可通过促进T细胞增殖、损伤血管内皮细胞等作用杀伤肿瘤,也可通过募集免疫细胞、诱导产生前列腺素和环氧合酶、诱导氧化应激等途径促进细胞变性与炎症进展[24]。
4 TNF-α在系统性硬化病中的作用及异常表现
4.1 TNF-α促炎作用TNF-α是最重要的促炎细胞因子,它直接参与细胞凋亡,诱导其他细胞因子和炎症介质的表达。TNF-α在SSc患者皮肤颗粒层的表达增加,特别是在SSc早期,提示TNF-α可能在SSc早期炎症阶段起作用,研究发现,系统性硬化真皮成纤维细胞对TNF-α反应过度,细胞间黏附分子1(ICAM-1)的表达在TNF-α刺激作用下增加到更大程度。TNF-α刺激活性氧(ROS)和活性氮物质(RNS)的释放,消耗细胞谷胱甘肽,诱导炎症细胞和上皮细胞增殖、细胞毒性和凋亡,并促进肺纤维化。TNF-α通过与受体相结合进而激活其下游的NFκB信号通路,促进了一系列的炎症细胞因子IL-1、IL-6、IFN-γ等的分泌,放大了炎症反应。TNF-α通过激活NF-κB信号通路促进肺间充质干细胞的肌成纤维细胞分化,这些结果表明,富含TNF-α的促炎微环境可能通过激活NF-κB信号传导在间质炎症和纤维化的发展中起重要作用[25]。
4.2 TNF-α促纤维化作用细胞因子在调节成纤维细胞功能(如增殖、迁移和基质合成)方面发挥重要作用,而这些介质的平衡可能在调节任何纤维化疾病、瘢痕形成和进展方面发挥着关键作用,体外实验发现TNF-α可促进成纤维细胞增殖。TNF-α在胶原蛋白和胶原酶的转录调控中具有重要作用。它导致成纤维细胞增殖增加、胶原合成增加、胶原酶产量增加和蛋白酶产量增加等[26]。PIGUET等[27]发现皮内注射TNF-α刺激成纤维细胞和胶原蛋白的积累。HU等[28]发现TNF-α在体外促进成纤维细胞生长活性。
转化生长因子β(TGF-β)是SSc纤维化病变的关键因子,参与细胞的生长、凋亡、分化以及细胞外基质的合成。TNF-α是一种具有纤维性质的细胞因子,能刺激胶原蛋白合成,诱导TGF-β并促进成纤维细胞的增殖[26]。TNF-α可加速上皮细胞向间充质细胞转化(EMT)并上调原代小鼠肺成纤维细胞中TGF-β1的表达。TNF-α上调TGF-β1的表达,激活NF-κB,促进成纤维细胞的增殖、分化,最终导致肺纤维化[29]。
4.3 TNF-α促进血管内皮的激活TNF-α可能在SSc发病早期即血管改变中发挥重要作用。由于缺血再灌注是肺内皮损伤的主要决定因素,因此,TNF-α可能通过增强血小板活化因子诱导的肺循环血管收缩在SSc中发挥重要作用。TNF-α血清水平的升高可能促进内皮功能障碍,血管内皮生长因子(VEGF)是慢性免疫介导性和变应性疾病炎症的重要介质,是一种改变微血管网络的促血管生成因子,促进内皮功能障碍和肺动脉高压的发生和进展[30-31]。此外,TNF-α增加了低密度脂蛋白受体1的基因表达,这种受体可以支持革兰氏阴性和革兰氏阳性细菌对血管内皮细胞和巨噬细胞的黏附,表明其在炎症和血管损伤中的作用。TNF-α还诱导血管黏附分子1(VCAM-1)的基因表达,VCAM-1在损伤和平滑肌细胞增殖的情况下,在单核细胞黏附和新内膜形成中起基本作用。TNF-α参与血管内皮的活化,通过调节成纤维细胞的功能来调节免疫反应和结缔组织的代谢,在系统性硬化症的发病机制中起重要作用[30]。
4.4 TNF-α免疫调节作用在SSc早期,T细胞产生干扰素和TNF-α。TNF-α是一种多效细胞因子,主要以其促炎特性而为人所知,然而TNF-α也具有免疫抑制反馈作用[32]。HUGLE等[33]首次采用多色流式细胞术研究了SSc患者真皮层不同白细胞亚群的TNFR的表达水平,结果表明TNFR1、TNFR2在弥漫性SSc患者真皮T淋巴细胞表达中上调,TNFR2的表达与皮肤增厚有关。用CD3/CD28抗体活化后,SSc患者外周血淋巴细胞较健康淋巴细胞产生更多的IL-6、可溶性IL-6受体(sIL-6R)和IL-13,TNFR1选择性配体和可溶性TNF的共刺激进一步增加IL-6的表达,而TNFR2的刺激导致更高的sIL-6R的释放。这说明膜结合TNF能有效激活TNFR1和TNFR2,对IL-6和sIL-6R表达有较强的影响,可能诱导IL-6信号传导[33]。肺纤维化患者中相关IL-6和TNFR2的多态性报道支持膜结合TNF-α诱导的IL-6/sIL-6R相互作用触发纤维化[34]。可溶性TNF主要通过TNFR1发出信号,是IL-6的强诱导剂。健康对照组和SSc患者在CD3/CD28刺激后,促纤维化细胞因子IL-13的产生差异较小,而TNF刺激后IL-13的产生增加。CD3/CD28与TNF共刺激SSc患者真皮T淋巴细胞上清液诱导成纤维细胞中1型胶原表达增高。因此,SSc组织中的T淋巴细胞过度表达TNFR2,而来自SSc患者的预先激活的外周血来源淋巴细胞是促纤维化的。通过两种TNF-α受体,尤其是TNFR2共同刺激T细胞,进一步触发胶原蛋白的生成[33]。TNF-α通过免疫调节参与纤维化机制如图1所示。
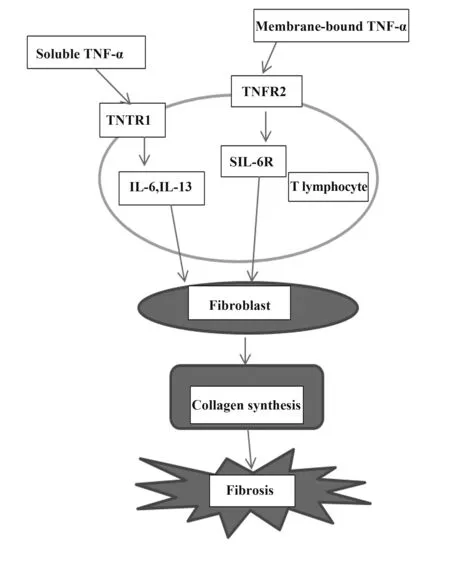
图1 TNF-α参与纤维化的作用机制Fig.1 Involvement mechanism of TNF-α in fibrosis
4.5 TNF-α在SSc中的表达PEHLIVAN等[35]证实了SSc患者血清中TNF-α水平升高,另一方面,SSc患者的TNF-α mRNA表达比正常对照组高2.66倍[36]。与其研究结果相同的是,还有其他研究显示SSc患者的TNF-α mRNA表达和血清中TNF-α水平更高[35]。在美国SSc患者中进行的一项研究发现肾脏危象患者的血清TNF-α水平较高[37]。
4.6 TNF-α基因多态性与SSc易感性的关系在TNF-α基因(编码TNF-α)的启动子区,基因-308G>A(rs1800629)和-238G>A(rs361525)多态性与TNF-α的转录增加有关。一些关于TNF-α多态性的研究发现不同人群中-308G>A和-238G>A多态性与SSc风险之间的关系。在墨西哥人口研究中评估了TNF-α-308G>A和-238G>A多态性与SSc易感性、TNF-α mRNA表达、TNF-α水平和SSc患者临床变量之间的关系。根据共显性遗传模型,发现-308G>A多态性的遗传基因型是SSc易感性的遗传标记,而且与皮肤厚度和抗纤维蛋白原抗体水平有关,这些数据表明TNF-α通过自身抗体和纤维化的产生在SSc易感性中起着重要作用,但是没有发现-238G>A多态性与疾病之间的关联风险[36]。这些结果与土耳其人口研究的结果一致[38];然而,这与日本人群研究结果不同,在日本人群中没有发现这两种TNFα多态性与SSc风险之间的关联。一项在意大利进行的研究发现了-238G>A基因型多态性与SSc易感性,特别是与dSSc表型之间的关联[39]。TNF-α基因多态性和SSc风险之间的这些异质性关联可以通过每个被评估人群的遗传结构来解释,众所周知,这是导致人群之间疾病发病率差异的原因。
5 TNF-α抑制剂在SSc中的治疗作用
TNF-α抑制剂用于治疗慢性免疫疾病或炎症性疾病,其无论是作为单一药物治疗,还是与其他抗炎药物或改善疾病的抗风湿药物联合治疗,已经在大型随机对照临床试验中证明有效。临床上应用得较多的TNF-α抑制剂有:英夫利昔单抗、阿达木单抗、戈利木单抗、赛妥珠单抗和依那西普,这些药物均可阻断TNF-α的生物学作用;但他们在结构、药代动力和作用机制上存在一定的差异。
TNF-α抑制剂在治疗SSc中的潜在作用是由于这种慢性免疫介导的疾病中TNF-α的过度表达。PHUMETHUM等[40]发现英夫利昔单抗和依那西普可改善SSc患者的炎性关节炎和残疾现象。PIGUET等[41]用英夫利昔单抗治疗16例dcSSc,治疗第26周时皮肤成纤维细胞的Ⅲ型胶原水平的血清氨基末端前肽和Ⅰ型胶原的分泌减少,表明新胶原形成减少,血清血管性血友病因子水平显著下降。值得注意的是,血管性血友病因子水平升高与疾病严重程度增加有关。BOSELLO等[42]研究发现SSc和糜烂性多发性关节炎的患者对皮质类固醇或甲氨蝶呤治疗没有反应,而用依那西普治疗却可以减少关节肿胀和压痛,延缓纤维化的进展,改善指尖溃疡。LAM等[43]证实了依那西普治疗SSc患者的疗效和安全性。值得注意的是,用TNF-α抑制剂治疗的患者发生全身性自身免疫性疾病的风险很低,目前没有建议在抗TNF-α治疗期间监测自身抗体滴度。TNF-α抑制剂用于硬皮病肺纤维化和肺动脉高压的基本原理是由于TNF-α水平的升高有利于肺间质和血管损伤。SZEKANECZ等[44]提示依那西普和阿达木单抗可能对脂质谱发挥有益作用,从而改善内皮功能障碍。依那西普可以降低血清TNF-α水平,增加内皮型一氧化氮合酶的组织表达和缓激肽的血管舒张反应。TNF-α抑制剂能够降低VEGF、一氧化氮和诱导型一氧化氮合成酶的表达和产生[45]。英夫利昔单抗和依那西普可改善SSc中的炎性关节炎和残疾。此外,TNF-α抑制剂通过降低PAH进展和急性心血管和/或脑血管事件的风险来改善内皮功能。综上所述,TNF-α抑制剂可以改善SSc患者症状和延缓纤维化进展,然而,还需要对SSc患者进行TNF-α抑制剂随机对照试验,以确认TNF-α抑制剂在SSc相关关节炎治疗中的潜在作用,并研究其在SSc患者的治疗中对于皮肤和肺潜在的有益作用。SSc中使用TNF-α抑制剂的潜在有益作用和支持文献见表1。

表1 SSc中使用的TNF-α抑制剂的潜在有益作用和支持参考文献Tab.1 Potential beneficial effects and supporting refer⁃ences of each TNF-α inhibitor used in SSc
6 小结
SSc是一种复杂的自身免疫性疾病,其发病机理和治疗方法仍需进行广泛深入的研究。TNF-α通过调节纤维增生功能参与炎症、纤维化、血管内皮的激活以及免疫炎症反应的调节,与SSc的发病机制存在一定的相关性。并且,通过对相关研究进行总结表明TNF-α抑制剂可以改善SSc患者症状和延缓纤维化进展。为了提高SSc的治疗水平,尚需对TNF-α抑制剂的治疗作用进行进一步的研究。

