哮喘患儿呼吸道病毒感染特征及其与α-干扰素治疗前后Th1、Th2细胞因子平衡的相关性研究
吴建刚 陈玉梅 陈美元 沈燕 黄丽珍(苏州市第九人民医院儿科,苏州215200)
哮喘是一种以喘息、咳嗽、胸闷为主的慢性气道炎症,哮喘发病率高,特别是儿童患者发病率逐年上升。研究表明,国内每十年哮喘患儿的发病率升高20%~50%,这消耗了巨大的医疗资源,严重影响了患儿的身心健康[1]。过去一直认为过敏是导致哮喘的主要因素;近年来研究发现,病毒可能是引起儿童哮喘急性发作的重要病原体,包括呼吸道合胞病毒(respiratory syncytial virus,RSV)、鼻病毒(rhinovirus,RV)、腺病毒(adenovirus,ADV)、流感病毒(influenza,IF)、副流感病毒(parainfluenza vi‑rus,HPIV)、肠病毒(enterovirus,EV)、人偏肺病毒(human meta lung virus,hMPV)、博卡病毒(Boka vi‑rus,BOCA)等[2],但目前关于哮喘儿童呼吸道相关病毒感染特征的研究还较少。患儿在感染病毒后,机体产生T细胞活化触发相关免疫反应,T细胞活化后被分化成Th1和Th2细胞,分别分泌对应的Th1型细胞因子和Th2型细胞因子,分别促进Th1型免疫反应和Th2型免疫反应。目前临床已有研究证实,哮喘急性发作及其进程与其体内Th1/Th2型免疫失衡密切相关[3]。干扰素是一种光谱抗病毒制剂,可以通过作用于细胞表面受体产生抗病毒蛋白发挥抗病毒作用。本研究拟分析哮喘儿童病毒感染的特征,并探讨其在经过干扰素治疗后体内的Th1/Th2型细胞因子平衡的变化及其相关性,以期为临床治疗提供理论参考。
1 资料与方法
1.1 资料
1.1.1 一般资料本研究为前瞻性研究,选择2017年1月至2020年1月在我院就诊的220例哮喘患儿和同期的100例健康儿童为研究对象。对所有研究对象进行病原体检查,并进一步纳入其中的病毒性哮喘患儿进行干扰素治疗。本研究已通过医院伦理委员会批准。
1.1.2 纳入标准①年龄<14岁;②临床症状主要为突然发生喘息、气促、咳嗽、胸闷等,符合支气管哮喘相关诊断标准[4];③急性发作期;④发病时间72 h内;⑤获得患儿监护人知情同意书。
1.1.3 排除标准①排除肝肾功能不全者;②哮喘慢性持续期及临床缓解期;③合并其他先天性肺部疾病以及气道畸形等呼吸系统疾病;④就诊前2周内使用过免疫制剂者。
1.1.4 药品与试剂布地奈德混悬液(普米克令舒,批准文号:H20140475,2 ml);异丙托溴铵溶液(爱全乐,批准文号:H20150159,500 µg∶2 ml);重组人干扰素α-2b注射液(北京凯因科技股份有限公司提供,批准文号201601018,3 mU/0.3 ml);RTPCR检测试剂盒购自江莱生物;Th1、Th2检测试剂盒购自美国BD公司;流式细胞仪(赛默飞Attune NxT流式细胞仪);ELISA检测试剂盒购自上海江莱生物科技有限公司。
1.2 方法
1.2.1 分组及治疗纳入病毒检测为阳性的患儿进一步研究,根据随机数字表法分为对照组和观察组,其余患儿进行常规对症处理。病毒感染患儿首先进行止咳、平喘、祛痰常规治疗,对照组进行布地奈德混悬液、异丙托溴铵溶液雾化治疗,观察组在此基础上增加1.2 ml重组人干扰素α-2b注射液雾化治疗,2次/d,连续治疗7 d,观察不良反应。分别于就诊当日和治疗7 d后采用肺功能仪检测患儿肺功能,包括第1秒用力呼气容积(forced expiratory volume in first second,FEV1)、呼气流量峰值(peak expiratory flow,PEF)及用力肺活量(forced vital ca‑pacity,FVC)。
1.2.2 观察指标
1.2.2.1 病毒检测采集所有受试者的鼻咽拭子,使用2 ml样本保存液斡旋离心后取上清进行病毒检测。病毒检测操作采用荧光定量RT-PCR,检测的病毒包RSV、RV、ADV、IF、HPIV、EV、hMPV、Boka virus、BOCA等,所有操作严格按照说明书进行,结果根据荧光信号曲线进行判定,以Ct值>40为阴性,≤40为阳性。
1.2.2.2 肺功能指标检测分别于就诊当日和治疗7 d后采用肺功能仪检测患儿肺功能,包括FEV1、PEF及FVC。
1.2.2.3 炎症因子检测分别于就诊当日和治疗7 d后采集外周静脉血3 ml两份其中一份置于抗凝管中,采用流式细胞仪检测Th1、Th2水平;另一份3 000 r/min离心取上清,检测Th1、Th2型细胞因子的水平,具体如下:①Th1、Th2检测:样本于37℃、5%CO2培养箱孵育4~6 h,分别加入10 µl CD4-PC7和CD3-PC5,室温避光孵育15 min,加入3 ml缓冲液,混匀,离心,留下层沉淀,加入100µl破膜剂,分别加入10 µl IFN-γ-FITC荧光抗体和IL-4-PE单克隆抗体,室温避光孵育15 min,缓冲液重悬后上流式细胞仪检测,获得只分泌IFN-γ和IL-4的CD4+细胞,分别代表Th1细胞和Th2细胞,并计算其比值。②Th1、Th2型细胞因子检测:采用ELISA法检测外周血清IL-2、IFN-γ、IL-4、IL-6水平,所有操作严格按照说明书进行。
1.3 统计学方法所有数据采用SPSS20.0软件进行统计分析,计数资料采用百分比表示,卡方检验,计量资料的采用±s表示,多组比较采用F检验,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 哮喘患儿病毒感染特征220例患儿中有164例病毒阳性,阳性率74.55%。其中RSV(82/220,37.27%)、RV(65/220,29.55%)、ADV(19/220,8.64%)、IF(27/220,12.27%)、HPIV(30/220,13.64%)、EV(38/220,17.27%)、hMPV(10/220,4.55%)、Boka virus(12/220,5.45%)、BOCA(8/220,3.64%)。其中122例为单一病毒感染,42例为混合感染。其中不同季节的病毒阳性率为:春季38/54(70.37%)、夏 季17/30(56.67%)、秋 季33/48(68.75%)、冬季76/88(86.36%),差异有统计学意义(χ2=12.881,P=0.004),冬季阳性率显著高于其他3个季节。
220例患儿根据病情严重程度分为轻度(96例)、中度(80例)、重度(44例)3个亚组,比较3个亚组病毒感染情况,单个病毒感染上3组差异无统计学意义(P>0.05),但中度组和重度组病毒总阳性率显著高于轻度组(P<0.05),详见表1。

表1 轻、中、重组哮喘患儿病毒感染情况[例(%)]Tab.1 Viral infection in children with mild,moderate and severe asthma[n(%)]
2.2 肺功能比较健康组儿童男52例,女48例,年龄3~12岁,平均(6.72±1.16)岁。164例病毒阳性患儿随机分为对照组(82例)和观察组(82例);其中对照组患儿男45例,女37例,年龄3~12岁,平均(7.10±1.24)岁,轻度17例,中度28例,重度37例;观察组男48例,女34例,年龄3~12岁,平均(7.23±1.05)岁,轻度14例,中度22例,重度46例。3组性别和年龄差异无统计学意义(P>0.05),对照组和观察组病情严重程度差异无统计学意义(P>0.05),具有可比性。对照组、观察组FEV1%、PEF%、FVC%治疗前无显著差异(P>0.05),但显著低于健康组(P<0.05);治疗后,对照组和观察组FEV1%、PEF%、FVC%显著升高(P<0.05),组间比较,观察组和健康组无显著差异(P>0.05),但观察组显著高于对照组(P<0.05),详见表2。
表2 治疗前后肺功能指标比较(±s)Tab.2 Comparison of pulmonary function indexes before and after treatment(±s)

表2 治疗前后肺功能指标比较(±s)Tab.2 Comparison of pulmonary function indexes before and after treatment(±s)
Note:Compared with Healthy group,1)P<0.05;compared with before treatment,2)P<0.05;compared with control group after treatment,3)P<0.05.
?
2.3 Th细胞比较对照组、观察组Th1%、Th2%、Th1/Th2治疗前无显著差异(P>0.05),但Th1%、Th1/Th2显著低于健康组(P<0.05),Th2%显著高于健康组(P<0.05);治疗后,对照组和观察组Th1%、Th1/Th2显著 升 高、Th2%显著 下 降(P<0.05),组间比较,观察组和健康组无显著差异(P>0.05),但观察组Th1%、Th1/Th2显著高于对照组(P<0.05),Th2%显著低于对照组(P<0.05),详见表3。2.4 Th细胞因子比较对照组、观察组IL-2、IFN-γ、IL-4、IL-6治疗前差异无统计学意义(P>0.05),但
表3 治疗前后Th1、Th2细胞比较(±s)Tab.3 Comparison of Th1 and Th2 cells before and after treatment(±s)
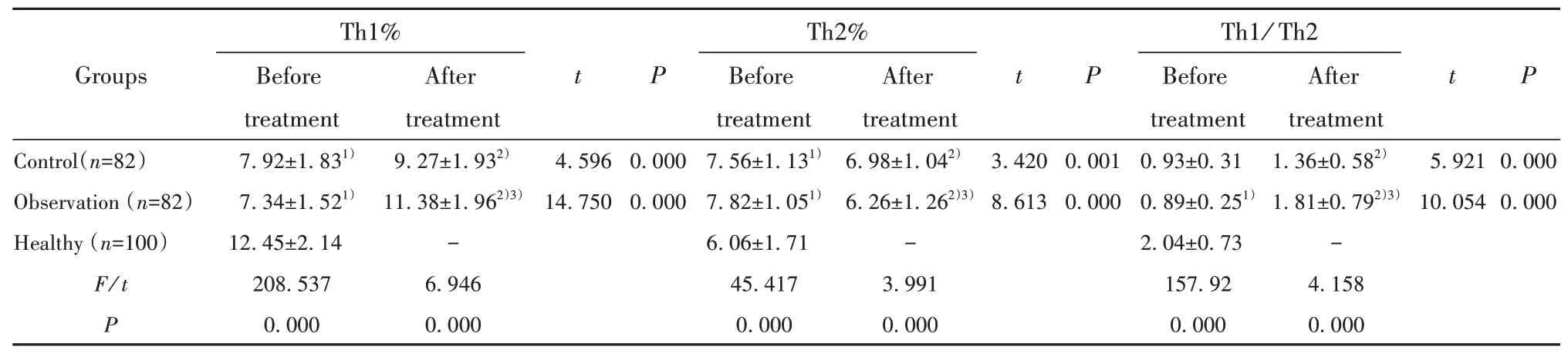
表3 治疗前后Th1、Th2细胞比较(±s)Tab.3 Comparison of Th1 and Th2 cells before and after treatment(±s)
?
Note:Compared with Healthy group,1)P<0.05;compared with before treatment,2)P<0.05;compared with control group after treatment,3)P<0.05.
IL-2、IFN-γ显著低于健康组,IL-4、IL-6显著高于健康组(P<0.05);治疗后,对照组和观察组IL-2、IFN-γ显著升高,IL-4、IL-6显著下降(P<0.05),组间比较,观察组和健康组差异无统计学意义(P>0.05),但观察组IL-2、IFN-γ显著高于对照组(P<0.05),IL-4、IL-6显著低于对照组(P<0.05);详见表4。
表4 治疗前后IL-2、IFN-γ、IL-4、IL-6比较(±s)Tab.4 Comparison of IL-2,IFN-γ,IL-4,IL-6 before and after treatment(±s)
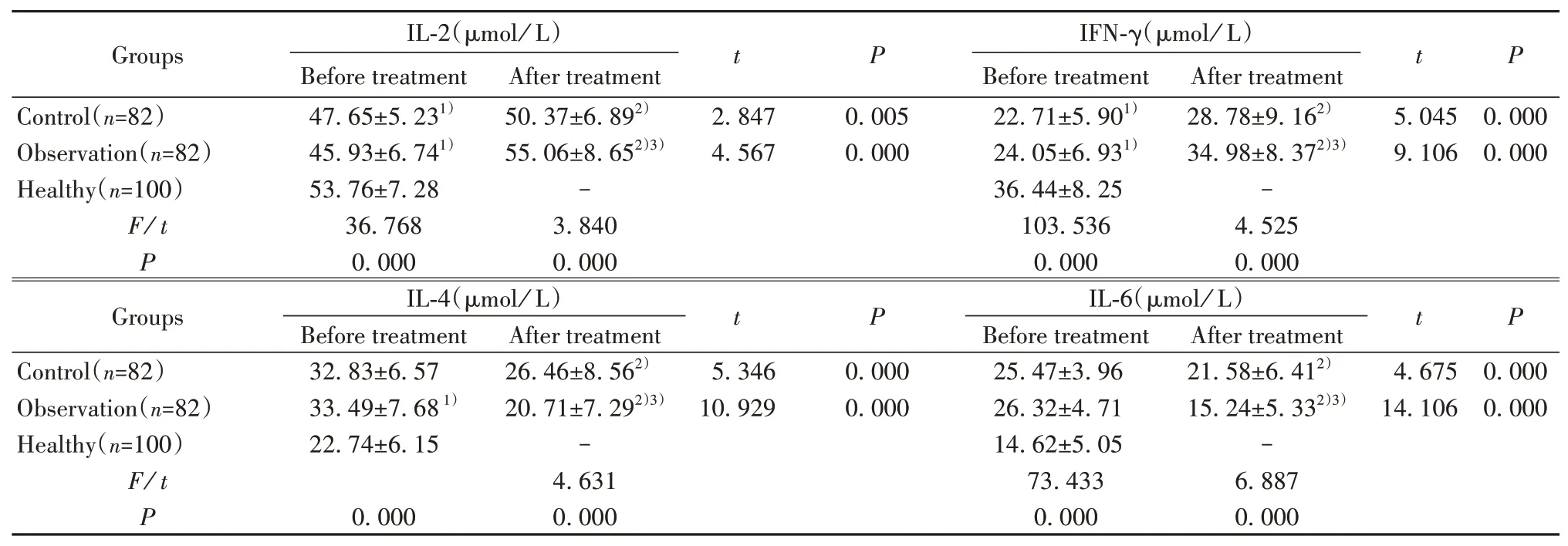
表4 治疗前后IL-2、IFN-γ、IL-4、IL-6比较(±s)Tab.4 Comparison of IL-2,IFN-γ,IL-4,IL-6 before and after treatment(±s)
Note:Compared with Healthy group,1)P<0.05;compared with before treatment,2)P<0.05;compared with control group after treatment,3)P<0.05.
?
2.5 肺功能与Th1/Th2的相关性研究将164例患儿治疗前后的FEV1%、PEF%、FVC%与治疗前后的Th1、Th2、Th1/Th2纳入Pearson相关性研究,结果发现FEV1%与Th1呈正相关(P<0.05)、与Th2呈负相关(P<0.05),FEV1%、PEF%、FVC%与Th1/Th2均呈正相关(P<0.05);详见表5。
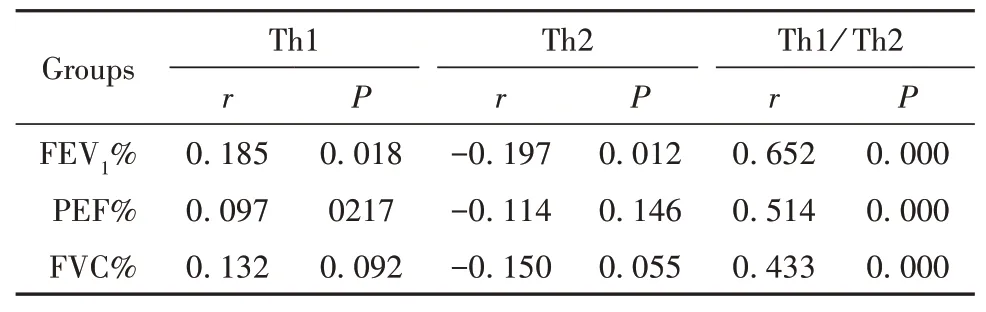
表5 FEV1%、PEF%、FVC%与Th1、Th2、Th1/Th2的相关性Tab.5 Correlation between FEV1%,PEF%,FVC% and Th1,Th2,Th1/Th2
2.6 不良反应治疗期间,未发生严重不良反应。
3 讨论
哮喘是一种气道慢性炎症,临床症状以反复喘息、气促、胸闷和咳嗽为主。一项收集2015年1月至2019年3月的484 719例儿童Meta分析表明,中国儿童哮喘平均患病率为4.90%,进一步亚组分析表明发病率逐年升高,由3.8%上升6.5%[5]。哮喘严重影响儿童的生长发育健康,带来了巨大的医疗负担。近年来,现代医学研究发现,病毒感染可能是导致哮喘发病的主要原因之一。患儿支气管壁在感染病毒后,发生炎性改变,形成炎症浸润,气道表现出高反应性,即支气管壁黏膜发生水肿,分泌物不断增加,逐渐导致气管痉挛、气流受限,表现出咳嗽、喘息等临床症状[6]。与此同时,体内的免疫系统启动,气管内的嗜酸性粒细胞升高,释放炎症因子和过敏介质,扩大炎症反应,杀灭病原菌的同时也会损伤气管组织,加剧气道高反应性和喘息症状[7]。
病毒作为可能是诱发哮喘急性发作的重要原因,但具有一定的地域性差异。能诱导急性哮喘的病毒种类众多,本研究对在我院就诊的220例哮喘患儿进行病毒筛查检测,发现74.54%伴有单一或多重病毒感染,其中以RSV和RV的感染率最高,分别为37.27%、29.55%,RSV和RV是被报道的最常见单位两种导致呼吸道疾病的病毒[8]。王婷等[9]对喘息发作期哮喘婴幼儿的病毒原检测中发现,鼻咽部标本病毒阳性率为49.6%;卢可斌等[10]对菏泽115例支气管哮喘急性发作期患儿的调查发现病毒感染率为67.83%,说明病毒感染在哮喘中不可小觑。分别对季节和严重程度进行分析以后发现冬季是病毒感染的高发季节,而春夏秋感染率较低,这与病毒本身单链RNA不耐热的特征有关,提示哮喘病毒感染具有一定的季节流行性。分析病毒感染与病情的特征发现,中重度患儿病毒感染率显著高于轻度患儿,这与孙逊等[11]报道的RSV和PIV感染与哮喘中重度哮喘急性发作有关具有相似性,说明病毒感染可能是导致病情加重的原因。这可能与病毒感染会影响机体的免疫平衡,加重气道炎症相关。
目前临床已经达成共识,认为嗜酸性粒细胞、中性粒细胞、T淋巴细胞、肥大细胞、平滑肌细胞、气道上皮细胞等多种细胞及其分泌的细胞因子共同参与了哮喘的整个发病过程,但是单纯地针对过敏机制以及减轻气道反应症状的常规治疗仍然无法完全控制患儿的病情,特别是伴有病毒感染的重症患儿。病毒感染与哮喘的病情进展的关系已经获得了临床大多数学者的认可[12],因此,本研究进一步对病毒感染的患儿进行α-干扰素抗病毒治疗,结果发现治疗1周后观察组肺功能显著改善且优于对照组,FEV1%、PEF%、FVC%与健康组儿童比较无显著差异,说明α-干扰素通过雾化吸入能显著改善急性发作哮喘患儿的临床症状。顾霞等[13]使用IFN-γ治疗支气管哮喘,发现能提高临床有效率、改善肺功能。分析认为雾化吸入能有效提高病灶局部药物有效浓度,针对气道炎症进行快速干预,同时有效减轻全身副作用。α-干扰素是一种能作用于细胞表面受体的活性蛋白质,具有广谱的抗病毒作用,其机制主要是通过与细胞膜表面受体结合产生抗病毒蛋白发挥抑制蛋白复制、扩增作用,已经被应用于多种病毒感染的相关治疗[14]。此外,α-干扰素还可以调节机体的免疫系统,可以通过调节机体T淋巴细胞亚群的平衡来间接发挥免疫增强作用[15]。
目前,已有相关研究证实哮喘患儿存在T细胞介导的免疫功能紊乱现象,T细胞介导的细胞免疫是机体清除病毒感染的重要机制[16]。T细胞分为Th1和Th2,Th1主要通过产生IL-2、IFN-γ来减轻免疫炎症、缓解临床症状,Th2主要通过产生IL-4、IL-6发挥免疫促进、加重炎症反应作用。本研究结果发现,与健康组比较,治疗前两组患儿的Th1%降低、Th2%升高,Th1/Th2偏低,提示病毒感染的哮喘患儿存在T细胞免疫向Th2偏移现象。在治疗1周后,观察组Th1/Th2显著高于对照组,并接近健康组水平,说明α-干扰素干预能调节机体的Th1、Th2免疫平衡。同时,我们分别观察了Th1和Th2分泌的代表性细胞因子,发现其规律与Th细胞类似,治疗前,两组患儿IL-2、IFN-γ显著低于健康组,IL-4、IL-6显著高于健康组,治疗后观察组IL-2、IFN-γ显著升高,IL-4、IL-6显著下降,且与健康组比较均无显著差异,提示α-干扰素治疗有利于调节Th1和Th2分米的细胞因子的平衡,这些可能是支持α-干扰素能调节哮喘患儿免疫平衡的证据之一。机体在感染病毒后,Th1细胞产生IL-2、IFN-γ,有助于减轻炎症反应,其中IFN-γ又可以进一步促进T细胞分化成Th1细胞,发挥免疫炎症抑制作用,减轻对气管壁正常组织的损伤[17]。Th2细胞产生的IL-4和IL-6参与嗜酸性粒细胞的免疫放大炎症反应,这些细胞因子可以招募更多的炎症因子,加重放大炎症反应,并抑制Th1型炎症保护作用,促进T细胞免疫平衡向Th2偏移[18]。临床也有相关报道认为病毒感染的呼吸道病毒中,免疫应答方式以Th2为优势应答,并以Th1/Th2的平衡状态来衡量疾病的严重程度[19]。本研究中进一步的相关性分析也有类似发现:FEV1%与Th1呈正相关(P<0.05)、与Th2呈负相关(P<0.05),FEV1%、PEF%、FVC%与Th1/Th2比值均呈正相关(P<0.05),这也进一步说明哮喘患儿的肺功能与Th1/Th2有密切相关性,α-干扰素的抗病毒和免疫调节作用能有利于改善肺功能以及Th1/Th2平衡。
综上所述,急性哮喘病毒感染率高,采用α-干扰素进行抗病毒治疗有利于改善患儿肺功能,调节Th1/Th2细胞平衡以及其对应的细胞因子平衡。

