组学技术在干燥综合征研究中的应用与思考①
喻晓雯 王琴 严诗楷 吴斌(中医药防治自身免疫疾病重庆市重点实验室,重庆400021)
干燥综合征(Sjögren's syndrome,SS)是一种复杂的异质性自身免疫性疾病,口干、眼干是其最常见的临床表现,其发病机制不明,患病率约0.01%~0.60%[1]。SS早期由于缺乏典型的临床表现,超过一半的患者出现漏诊或误诊,平均确诊时间为3.9年[2-3]。到目前为止主要是对症治疗为主,以缓解临床症状,但很难改变SS的自然过程[4]。因此SS的发病机制、诊断和治疗均面临诸多困惑,迫切需要寻求新的技术来提高对SS的认识。组学技术因其自动化、高通量、高灵敏度和可重复的特点,广泛应用于SS的早期诊断、疾病分类和治疗反应等[5-6]。本文将对近年来组学技术在SS的应用综述如下。
1 转录组学
原 发 性 干 燥 综 合 征(primary Sjögren's syn‑drome,pSS)的发病是多因素的,B细胞活化在pSS的致病机制中发挥重要作用。IMGENBERG[7]团队对12例pSS患者和20例健康对照(healthy controls,HCs)纯化的CD19+B细胞进行RNA全转录组测序,发现pSS患者的Ⅰ型和Ⅱ型干扰素(IFN)诱导的基因、趋化因子及其受体表达上调,而细胞因子信号传导的抑制因子下调,提示pSS的B细胞呈免疫激活特征。
miRNA是基因表达的重要调控方式,HILLEN等[8]采用OpenArray定量PCR技术对30例pSS患者和16例HCs的外周血浆细胞样树突细胞(pDC)的758种miRNA进行检测,发现并验证了10种差异表达miRNA,其中miR-29a和miR-29c是促细胞凋亡因子,提示pSS的miRNA的下调与pDC存活率增加有关。
唾液腺自身免疫炎症也与SS发病机制相关,研究者通过RT-PCR比较了36例SS患者和25例对照的唾液腺组织、导管上皮细胞(SGEC),发现SS的导管上皮细胞的PPARγ表达和转录活性持续性降低。由于PPARγ具有重要的抗炎活性,提示SS导管上皮细胞的抗炎功能降低。此外,PPARγ激动剂在体外对SS-SGEC细胞系有良好的治疗作用,提示PPARγ激动剂可应用于SS的临床治疗[9]。综上所述,转录组主要应用于SS发病机制的研究,但还不深入,尤其在基因表达调控方面。SS的转录组研究见表1。

表1 SS的转录组研究Tab.1 Transcriptomics study of SS
2 蛋白组学
2.1 差异蛋白与疾病诊断SS可累及泪腺,影响蛋白的分泌,LI等[10]通过LC-MS/MS对8例SS、干眼症和HCs的泪液进行蛋白质组分析,发现SS特异表达的蛋白有防御素α1、簇蛋白和乳铁蛋白。AQRA‑WID等[11]通 过LC-MS检 测27例pSS患 者 和32例HCs的泪液蛋白谱,发现pSS的DNA裂解酶APEX1、硫氧还蛋白依赖性过氧化物酶还原酶PRDX、CPNE1、乌头酸水合酶ACO2和LIM结构域蛋白7上调最明显。泪液的差异蛋白常用于SS的诊断,如TOMOSUGI等[12]应用SELDI-TOF-MS分析了23例pSS、8例 继发 性 干燥 综合 征(secondary Sjögren's syndrome,sSS)、14例干眼症、22例其他眼病、21例HCs泪液蛋白质谱,发现7种下调蛋白和3种上调蛋白可作为SS的诊断标志物,灵敏度为87%,特异度为100%。
唾液腺也是SS常累及的靶器官,既往研究发现pSS唾液的β-2-微球蛋白、乳铁蛋白、免疫球蛋白j轻链、免疫球蛋白k轻链、聚合Ig受体、溶菌酶C、胱抑素C和表皮脂肪酸结合蛋白显著增加,而淀粉酶、α-淀粉酶前体、甘油醛-3-磷酸脱氢酶减少、碳酸酐酶Ⅵ减少或缺失[13-15]。唾液差异蛋白也尝试用于疾病的诊断中。如GALLO等[16]通过SELDI-TOF-MS分析了pSS、非SS干燥患者和HCs的唾液样品,发现GCDFP-15/PIP蛋白能够区分pSS患者和HCs,灵敏度为96%,特异度为70%。又如DELALEU等[17]通过基于187-plex捕获抗体的研究发现SS患者的唾液蛋白变化显著,如4-plex和6-plex生物标志物标签(IL-4、IL-5和簇蛋白),可准确预测94%的病例。此外该团队还通过唾液腺的焦点评分、生发中心有无和唾液腺功能受损情况,对pSS患者进行分组,发现22个与唾液分泌减少相关蛋白,4-plex标签能准确预测大于80%的病例的唾液腺功能[18]。LI等[19]通过MALDI-TOF-MS对35例pSS、50例疾病对照和26例HCs的血清进行差异蛋白筛选,建立pSS的诊断模型并进行验证,该模型的灵敏度高达95.5%,特异度为88%。上述研究均获得了差异蛋白或标志物,但差异较大,可能与标本类型、实验分组、实验技术和分析方法等不同有关。
在鉴别诊断方面,台湾的一项研究使用LC-MS/MS技术对RA、pSS、RA-sSS和HCs的血清进行分析,结果发现抗瓜氨酸化ITIH3542-556肽IgM能很好地区分RA与pSS、pSS与RA-sSS[20]。此外BODEWES等[21]通 过SOMAscan扫 描 技 术 分 析22名 疲 劳 和23名非疲劳pSS患者的血清差异蛋白,发现神经活性突触体相关蛋白25、α-烯醇酶、泛素羧基末端水解酶同工酶L1、促炎介质IL36a和补体因子能鉴别疲劳和非疲劳的患者。
2.2 发病机制唾液差异蛋白与发病机制密切相关。STEA等[22]报道了pSS患者唾液含有高水平的翻译后修饰的La/SSB自身抗原和肌动蛋白,仅能微弱地识别pSS的天然形式蛋白,提示自身蛋白质的理化性质改变可能打破了免疫耐受而发病。GAL‑LO等[16]发 现pSS的GCDFP-15/PIP的表 达 显 著降低,这与蛋白质产量的减少有关。且GCDFP-15/PIP的mRNA和唾液蛋白与MSG活检病灶评分和患者的唾液流速相关,提示GCDFP-15/PIP唾液减少可能反映了pSS淋巴细胞介导的腺泡损伤,而AQP5-GCDFP-15/PIP axis的损伤可能在pSS腺体功能障碍中起作用。HALL等[23]采用ITRAQ技术分析了15例pSS患者、15例口干对照和14例HCs的样本,发现β2-微球蛋白(血浆)上调与碳酸酐酶Ⅵ(唾液)和BPIFB2(血浆)下调。且pSS患者血浆和唾液中的大量唾液糖蛋白有更大程度的N糖基化,表明pSS与唾液糖蛋白的糖基化增加有关。这些研究从不同侧面探讨了pSS的发病机制,但还任重道远。
疲劳是SS的常见症状,其发病机制未知。LARSSEN等[24]采用无标记鸟枪法蛋白质组学方法分析10例重度疲劳和10例轻度疲劳pSS患者的脑脊液蛋白质组。结果鉴定了载脂蛋白A4、血红素结合蛋白、色素上皮衍生因子、分泌粒蛋白-1、分泌粒蛋白-3、硒结合蛋白1和补体因子B等差异蛋白,提示疲劳与先天免疫,细胞应激防御和/或中枢神经系统功能等有关。
上述研究发现许多蛋白可作为SS的候选生物标志物,具体见表1。在这些研究中获得证实的差异蛋白有β-2-微球蛋白和碳酸酐酶Ⅵ[13-15]。前者是MHCⅠ类抗原的轻链分子,与SS的唾液腺炎症有关[15];后者与唾液碳酸氢盐和氢离子转化为二氧化碳和水相关,对维持唾液pH稳态至关重要[17]。尽管这些研究有较大差异,但总体而言,SS唾液蛋白谱的特征是炎症和免疫应答相关蛋白表达增加,腺泡蛋白减少,分泌蛋白丢失,还有一些与氧化应激损伤有关的蛋白,这可能是由于腺泡细胞的损伤和功能障碍引起的。
2.3 临床评估疾病活动指数(EULAR SS disease activity index,ESSDAI)是SS常用的病情评估指标。NISHIKAWA等[25]分析了30例pSS患者和30名HCs血清的差异蛋白与ESSDAI之间的相关性,结果发现CXCL1、TNF-R2、CD48、B-细胞激活因子(BAFF)和PD-L2可作为疾病活动度评估的候选指标,提示应用生物标志物评估病情存在可行性。另外匹鲁卡品可促进唾液分泌,PELUSO等[26]通过LC-MS分析了匹鲁卡品对9名pSS患者,9名sSS患者和10名HCs的62种唾液蛋白的影响,结果发现pSS患者60%的唾液蛋白检测不到或显著降低,匹鲁卡品可恢复部分蛋白的分泌,腮腺蛋白、α-防御素1和β-防御素2对匹鲁卡品的反应最好。提示蛋白组技术可以应用于治疗评估。SS的蛋白组研究见表2。
3 表观基因组学
3.1 表观遗传修饰与SS发病机制相关表观遗传修饰(如DNA甲基化、组蛋白修饰和非编码RNA等)已成为自身免疫疾病发病的重要诱因[28]。如THABET等[29]观察到pSS唾液腺上皮细胞DNA甲基化程度降低,提示其与唾液腺功能障碍的关联。KONSTA等[30]发现唾液腺上皮腺泡中的DNA甲基化缺陷与SSB基因表达,抗SSB/LA抗体产生和淋巴细胞浸润有关。B细胞浸润唾液腺是上皮细胞低甲基化的原因之一,用B细胞耗尽剂治疗可恢复DNA甲基化,从而控制炎症和自身免疫有关基因的表 达[29-31]。又 如IMGENBERG等[32]发 现pSS的CD19+B细胞中IFN调节基因的显著低甲基化,包括MX1、IFI44L和PARP9基因。CHARRAS等[33]在pSS的SGEC中亦发现了IFN调节基因的低甲基化,表明IFN诱导基因的表观遗传调控pSS的发病。KARA‑GIANNI等[31]总结了一系列与SS风险相关的甲基化基因座,如主要组织相容性复合物/人类白细胞抗原区、干扰素调节因子5、BLK、信号转导子和转录激活因子4、白介素12A、TNFAIP3相互作用蛋白1和CXC基序趋化因子受体5,表明表观遗传学改变与SS的发病机制有关。
3.2 DNA甲基化改变与pSS患者的疲劳相关慢性疲劳是pSS患者的一个典型特征,但其机制不明。NORHEIM等[34]调查了高与低疲劳pSS患者的全血的差异DNA甲基化,共鉴定了251个差异甲基化的CpG位点,发现非编码RNA在高疲劳状态下的低甲基化,证实DNA甲基化与疲劳间的关联。SS的表观基因组研究见表3。
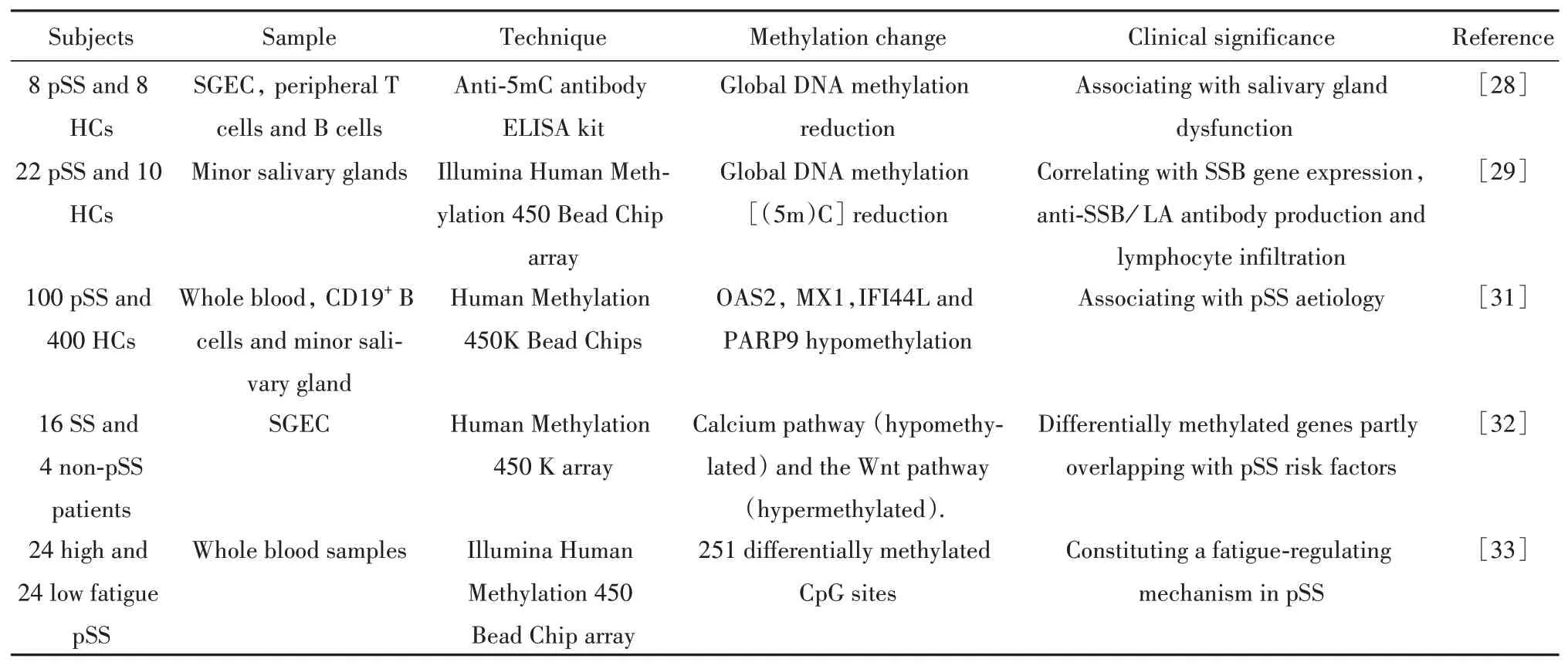
表3 SS的表观基因组研究Tab.3 Epigenomics study of SS
4 微生物组学
4.1 SS患者的口腔微生物组特征存在争议人类微生物群落由100万亿个细菌、原生动物、真菌和病毒组成。通过能量提取、代谢调节、抵御致病菌、调节免疫等对健康产生至关重要的作用[35]。早在2003年就开展了唾液微生物研究,如ALMSTAH等[36]观察到SS的唾液中念珠菌和变形链球菌的增加,而具核梭杆菌则被耗尽。DEPAIVA等[37]发现了高水平的乳酸菌、金黄色葡萄球菌和白色念珠菌和纤毛菌,而梭杆菌减少。SIDDIQUI等[38]发现pSS患者唾液中厚壁菌门明显升高,而互养菌门和螺旋体门显著减少。SHARMA等[39]的研究证实pSS患者唾液的微生物组多样性无显著变化,但pSS中双歧杆菌、小杆菌和乳酸菌明显增多,而纤毛菌明显缺失。这些研究提示SS口腔菌群组成存在显著差异,SS患者有较高水平的厚壁菌门和变形菌门细菌,而梭杆菌门细菌则明显减少或缺失。
然而,MEULEN等[40]发现SS颊黏膜标本的微生物菌群虽不同于HCs,但与非SS干燥患者并没有差别,表明SS患者颊黏膜微生物组是由唾液分泌减少和疾病特异性因素共同决定的。另有研究证实pSS唾液微生物群、口腔健康状况及唾液流量与非SS干燥患者相似,提示唾液微生物群的变化似乎不是由pSS本身决定的[41]。显然唾液微生物的变化特征还需进一步论证。
4.2 SS患者的肠道微生物组特征近年研究者开始关注SS患者肠道微生物的变化,如DEPAIVA等[37]发现SS肠道微生物菌落特征,即粪杆菌、拟杆菌、副杆菌和普雷沃菌属的减少以及埃希菌、志贺菌和链球菌属的增加,提示SS的标志是由共生细菌减少和病原菌属增加。然而,MEULEN等[42]比较pSS和SLE患者的粪便菌群组成,并未发现差异,均表现为细菌多样性减少、有较低比率的厚壁菌门和较高比率拟杆菌门,提示pSS和SLE患者在肠道菌群组成上有相似的改变,使患者有别于一般人群。显然SS肠道微生物菌落是否具有特异性还需要更深入研究来揭示。见表4。

表4 SS的微生物组研究Tab.4 Microbiomics study of SS
5 代谢组学
目前SS的代谢组学研究较少。BENGTSSON等[43]将代谢组学应用于SLE与pSS和系统性硬化的鉴别诊断。在SLE与pSS、SSc和HCs的比较中,观察到高于67%的代谢谱差异。KAGEYAMA等[44]通过GC-MS分析 了12例pSS和21例HCs的唾液 的代谢物谱,发现pSS的41种代谢物降低和多样性的丢失,甘氨酸、酪氨酸、尿酸和岩藻糖的减少可能与唾液腺破坏相关。主成分分析发现pSS患者的两个亚群的唾液腺炎的患病率差异显著,提示代谢物谱受到唾液腺炎的影响。
6 组学联合研究
目前SS的组学联合研究还处于初级阶段,日本的一项研究对30例SS和30例HCs标本进行了表观基因组、转录组和蛋白组联合研究,整合分析发现SS基因标签(SGS)失调存在于多组学层面,SGS主要涉及IFN标签和ADAMs底物。此外,SGS与全基因组关联研究和表达性状基因座分析表明SS致病基因显著重叠。结合分子标记和免疫表型特征发现细胞毒性CD8-T细胞与SGS有关[4]。
另一项研究通过微生物组(16S rRNA基因测序)和代谢组(LC-MS/MS)分析27例SLE,23例SS,11例原发性抗磷脂综合征,26例未分化结缔组织患者和27例HCs的粪便和血浆样本,以确定疾病之间的共同特征。结果发现了29个微生物属和41个代谢峰,在微生物组和代谢组模型中,HCs与全身性自身免疫性疾病(SADS)能很好地区分,而未分化结缔组织与其他疾病有很大程度的重叠。在所有的SADS中,促耐受菌减少,而致病菌属增加。酰基肉碱家族成员和磷脂两类发生了代谢改变,前者与富集普罗沃特氏菌群集正相关;后者与产生丁酸盐的细菌负相关。这些发现表明SADS患者的肠道微生物区系和代谢功能之间存在很强的相互作用[45]。显然多组学联合研究有助于更系统性地认识SS的发病机制。
7 思考与展望
Omics研究旨在整合和分析代表生物流体或组织内特定生物学参数整体的大量数据,并使用高级计算分析来检查与表型或疾病状态的关系。自动化、高通量和高灵敏度的组学方法能捕获成千上万个变量,并证明疾病过程与多个变量的相互关系[46]。但组学研究有数据质量/完整性,可重复性和研究样本量等的挑战[47]。使用标准质量控制过程和度量来标准化实验室内和实验室间组学测量变化,并应用一致的统计校正方法和适当的计算工具可以解决这类技术问题,有利于不同研究间的整合,获得价值更高的研究成果[48-50]。
目前组学研究取得一些可喜的成绩,但面临诸多的困惑。不同研究之间差异大,可比性差。如现有的组学研究筛选的标志物特异性较低,难以与其他自身免疫疾病相鉴别[51]。另外,SS的临床表现有较大的异质性,如FLEISSIG等[52]发现SS的唾液蛋白组就存在两组表达模式。未来应不断规范样本的采集、实验技术、多中心和多组学研究平台,结合网络分析和机器学习等发现传统方法无法识别的生物标志物,进而有助于对疾病的诊断、病情监测和发病机制的理解。

