青霉素对银屑病模型小鼠肠道菌群变化及免疫功能调节作用的实验研究①
金曌 王飞 苏慧 张峻 殷翘(武汉市第一医院皮肤科,武汉430022)
银屑病是一种全身炎症性疾病,由环境刺激引发皮肤细胞、免疫细胞和多种生物信号分子遗传程序化的病理相互作用[1]。1型(Th1)和17型(Th17)T辅助细胞由皮肤中抗原呈递细胞分泌的IL-12和IL-23激活,通过肿瘤坏死因子-α(TNF-α)等多种细胞因子引发慢性炎症,并改变皮肤表皮增生、分化、凋亡和新血管生成情况,从而导致银屑病皮损[2]。研究显示,微生物菌群改变可能导致免疫系统改变,从而诱发炎症性疾病[3]。于尧等[4]发现,肠道菌群变化与皮肤炎症存在相关性。王丽玮等[5]研究指出,银屑病患者存在肠道菌群改变,银屑病发生与肠道菌群紊乱紧密相关。咪喹莫特是一种应用广泛的银屑病动物模型诱导剂,可激活免疫系统,诱导银屑病皮损[6]。青霉素在感染性疾病治疗中疗效显著,临床研究显示青霉素对银屑病患者具有明确治疗效果[7-8]。但青霉素对银屑病作用的具体机制鲜有报道,故本研究以咪喹莫特诱导构建银屑病小鼠模型,探讨青霉素对银屑病的可能作用机制,为阐明银屑病发病机制及提出新的治疗方案提供参考。
1 材料与方法
1.1 材料24只4~6周龄雌性BALB/c小鼠,体重20~25 g,无菌饲养于特定温度和湿度,剃光所有小鼠背部毛发,在医院动物实验中心饲喂标准饲料和水,标准饲料蛋白、碳水化合物和脂肪占热量摄入量的20%、70%和10%。实验按照《中国实验动物护理和使用指南》进行,经我院动物伦理委员会批准。青霉素(华北制药股份有限公司);咪喹莫特软膏(美国3M医药用品有限公司);凡士林软膏(广州白云医药有限公司);4%多聚甲醛(上海索宝生物科技有限公司);苏木精和伊红染液(南京建成生物工程研究所);ELISA试剂盒(美国cusabio公司);粪便采样盒(南京阿森泰科生物技术有限公司);革兰氏染色试剂盒(上海索宝生物科技有限公司);光学显微镜(日本奥林巴斯株式会社);流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 动物处理小鼠腹腔注射80 mg/kg戊巴比妥钠,电动剃须刀剔除其背部毛发,露出面积约2 cm×3 cm,随机分为青霉素组(备皮后外涂5%咪喹莫特软膏8 d诱导银屑病模型,腹腔注射0.1 ml青霉素,初始剂量20 mg/ml,100 mg/kg,连续7 d)、模型组(备皮后外涂5%咪喹莫特软膏8 d诱导银屑病模型,腹腔注射0.1 ml生理盐水至实验结束)和对照组(备皮后外涂凡士林软膏8 d,腹腔注射等量生理盐水至实验结束),每组8只。
1.2.2 皮损严重程度评分第1、2、4、7天,采用皮损面积和严重程度指数(psoriasis area and severity index,PASI)评价小鼠背部皮损严重程度,红斑、鳞片和浸润情况评分,0分:无;1分:轻微;2分:中度;3分:严重;4分:非常严重。所有评分均由2名人员独立进行评估,累积评分(红斑+鳞屑+浸润)反映炎症严重程度(0~12级)[9]。
1.2.3 组织病理学染色实验结束后处死小鼠,切除背部剃毛皮肤,4%多聚甲醛固定,石蜡包埋24~36 h,切片(4µm),HE染色,光学显微镜下观察。
1.2.4 血清免疫细胞因子水平检测第7天采集3组小鼠血浆,室温下10 000 r/min离心5 min,去上清,分离淋巴细胞,400 r/min离心20 min,收集第2层淋巴细胞,PBS稀释,计数;每管加入2×106个细胞,加入荧光抗体冰上孵育20 min,PBS清洗2遍,离心,PBS重悬细胞,流式细胞仪检测血清CD4+T细胞、CD8+T细胞、CD11c+树突状细胞(DCs)阳性细胞百分比(%)。
1.2.5 血清炎症细胞因子水平检测血清收集同1.2.4,采用ELISA试剂盒检测血清IL-17A、IL-17F、IL-22、IL-23水平。
1.2.6 肠道菌群检测第7天收集3组小鼠粪便,一部分用于乳酸杆菌、双歧杆菌、肠球菌及肠杆菌检测,将稀释后的标本接种至培养基进行培养,采用革兰氏染色试剂盒进行菌种涂片染色鉴定,根据革兰氏染色和细菌形态特征判断目的菌:乳酸杆菌为革兰氏阳性菌,多数菌种菌体较大,为直行或微弯行;双歧杆菌为革兰氏阳性菌,菌体长短、形态不一,多有分叉;肠球菌为革兰氏阳性菌,菌种菌体为圆形或椭圆形;肠杆菌为革兰氏阴性菌,中等大小,端圆,长短不一。计算菌落数,CFU/g=菌落数×稀释浓度×100,结果以对数形式表示。剩余小鼠粪便标本用于微生物16s rRNA测序,由上海生工公司完成。
1.3 统计学处理采用SPSS20.0软件进行统计学分析,计量数据以±s表示,进行单因素方差检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组BALB/c小鼠皮损变化情况对照组小鼠背部皮肤无明显变化;模型组小鼠第2天起背部皮肤出现红斑、鳞片和浸润,并逐渐明显,第7天皮肤表现与人斑块型银屑病相似,病理可见皮肤明显角化、棘突及炎症细胞浸润。青霉素组小鼠背部皮肤可见少量红斑和薄鳞片,无明显浸润,皮肤病理变化明显减轻。模型组小鼠第2、4、7天PASI评分明显高于对照组(P<0.05),青霉素组第2、4、7天PASI评分明显低于模型组(P<0.05,表1、图1)。
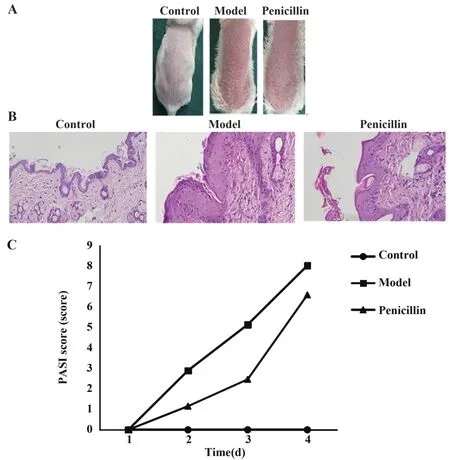
图1 各组小鼠第7天背部皮损情况、组织病理学染色情况及PASI评分(×400)Fig.1 Back skin lesions,histopathological staining at 7 d and PASI score of mice in each group(×400)
表1 各组小鼠PASI评分(±s,n=8,分)Tab.1 PASI score of mice in each group(±s,n=8,score)
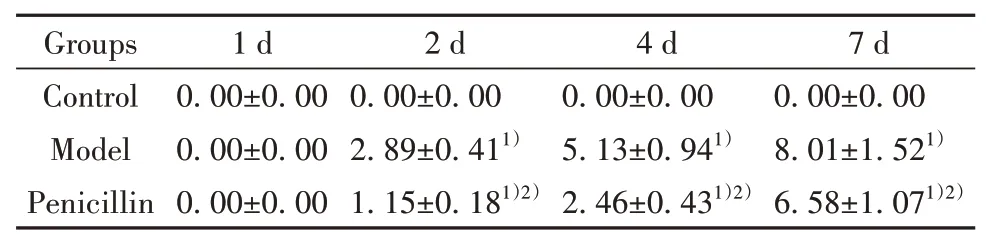
表1 各组小鼠PASI评分(±s,n=8,分)Tab.1 PASI score of mice in each group(±s,n=8,score)
Note:Compared with Control,1)P<0.05;compared with Model,2)P<0.05.
?
2.2 各组小鼠血清免疫细胞因子水平模型组小鼠CD4+T细胞、CD8+T细胞百分比明显低于对照组(P<0.05),CD11c+DCs百分比明显高于对照组(P<0.05);青霉素组CD4+T细胞百分比明显高于模型组(P<0.05),CD11c+DCs百分比明显低于模型组(P<0.05),CD8+T细胞百分比与模型组差异无统计学意义(P>0.05,图2)。
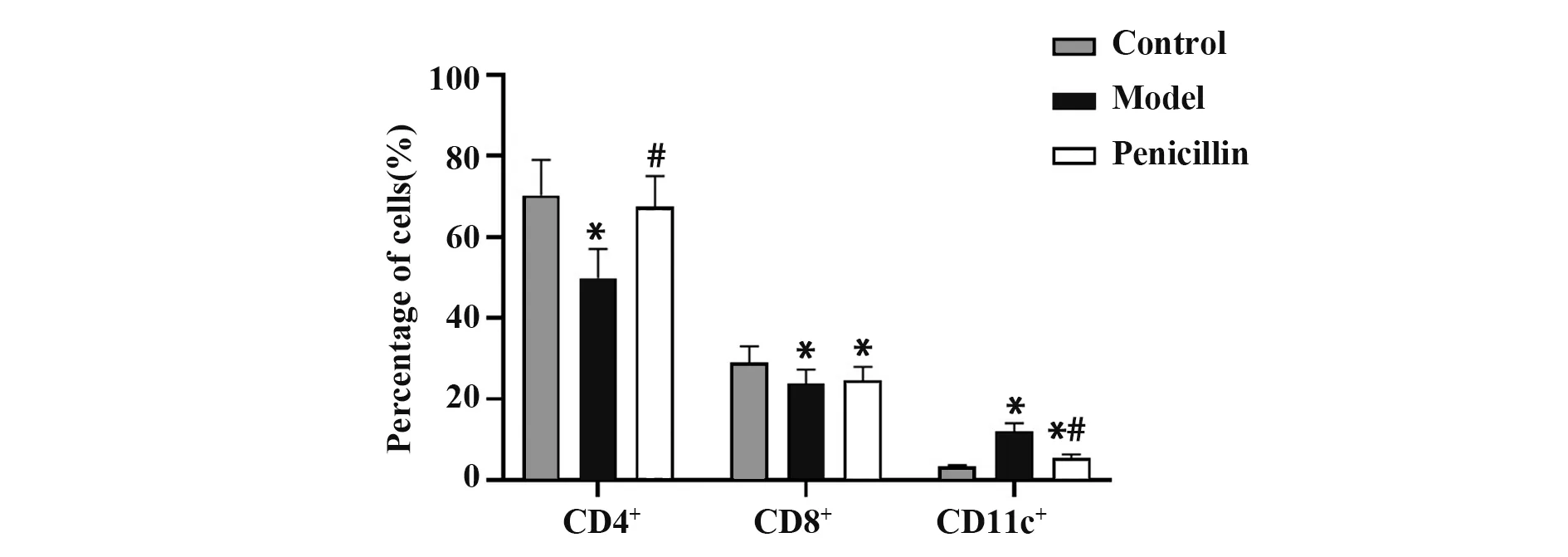
图2 各组小鼠免疫细胞因子水平Fig.2 Immune cytokines levels of mice in each group
2.3 各组小鼠血清炎症细胞因子水平模型组小鼠IL-17A、IL-17F、IL-22、IL-23水平明显高于对照组(P<0.05);青霉素组IL-17A、IL-17F、IL-22、IL-23水平明显低于模型组(P<0.05,图3)。
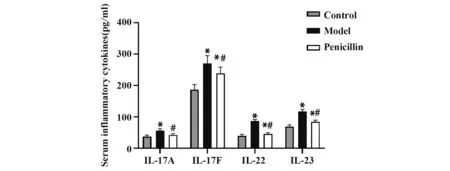
图3 各组小鼠血清炎症细胞因子水平Fig.3 Serum inflammatory cytokines levels of mice in each group
2.4 各组小鼠肠道菌群数比较模型组小鼠乳酸杆菌、双歧杆菌、肠球菌及肠杆菌数与对照组差异无统计学意义(P>0.05);青霉素组乳酸杆菌、双歧杆菌数明显少于模型组(P<0.05),肠球菌、肠杆菌数明显多于模型组(P<0.05,图4)。

图4 各组小鼠肠道菌群数Fig.4 Intestinal flora quantity of mice in each group
2.5 各组小鼠肠道菌群OTU数及多样性比较模型组小鼠OTU、Chao1、ACE、Shannon及Simpson值与对照组差异无统计学意义(P>0.05);青霉素组OTU、Chao1、ACE、Shannon值明显低于模型组(P<0.05),Simpson值明显高于模型组(P<0.05,表2)。
表2 各组小鼠肠道菌群OTU数及多样性比较(±s,n=8)Tab.2 OTU number and diversity of intestinal flora of mice in each group(±s,n=8)

表2 各组小鼠肠道菌群OTU数及多样性比较(±s,n=8)Tab.2 OTU number and diversity of intestinal flora of mice in each group(±s,n=8)
Note:Compared with Control,1)P<0.05;compared with Model,2)P<0.05.
?
2.6 各组小鼠肠道菌群门水平相对丰度比较模型组小鼠放线菌门、厚壁菌门、变形菌门及拟杆菌门比例与对照组差异无统计学意义(P>0.05);青霉素组放线菌门、变形菌门比例明显高于模型组(P<0.05),厚壁菌门、拟杆菌门比例明显低于模型组(P<0.05,表3、图5)。
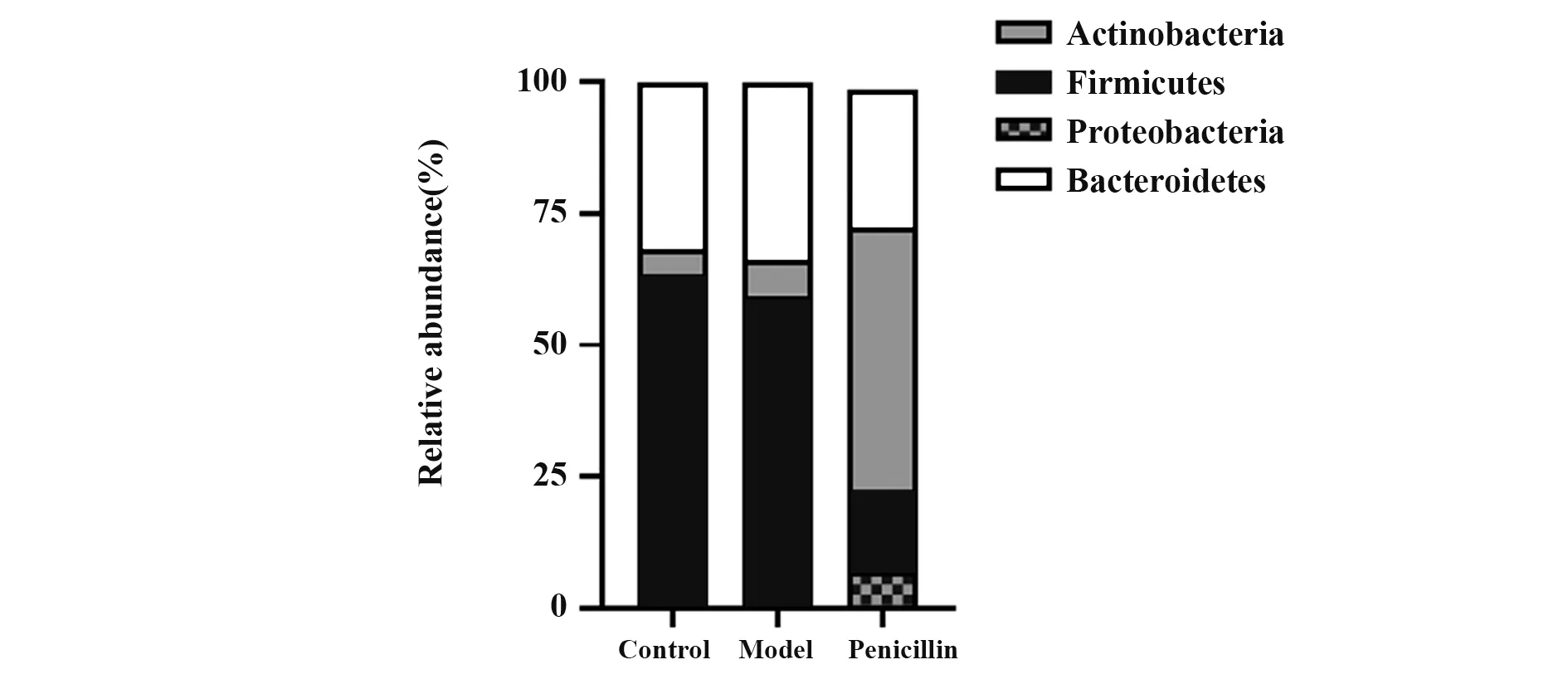
图5 各组BALB/c小鼠肠道菌群门水平相对丰度Fig.5 Relative abundance of intestinal flora phylum level of BALB/c mice in each group
表3 各组小鼠肠道菌群门水平相对丰度比较(±s,n=8,%)Tab.3 Comparison of relative abundance of intestinal flora phylum level of mice in each group(±s,n=8,%)
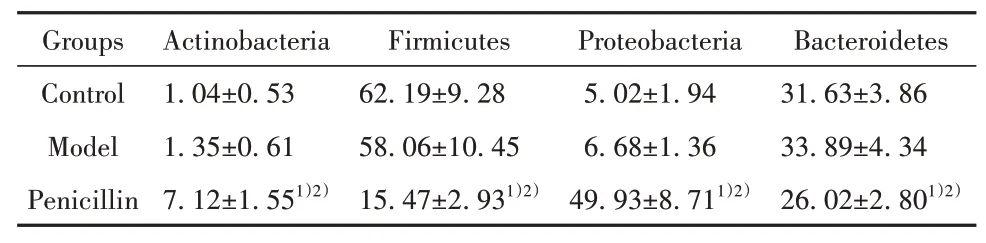
表3 各组小鼠肠道菌群门水平相对丰度比较(±s,n=8,%)Tab.3 Comparison of relative abundance of intestinal flora phylum level of mice in each group(±s,n=8,%)
Note:Compared with Control,1)P<0.05;compared with Model,2)P<0.05.
?
2.7 各组小鼠肠道菌群细菌属比例比较模型组与对照组小鼠副拟杆菌属、粪芽孢菌属相比差异无统计学意义(P>0.05);青霉素组副拟杆菌属、粪芽孢菌属比例明显高于模型组(P<0.05,图6)。
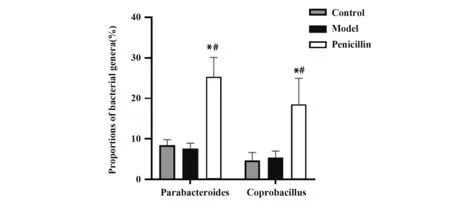
图6 各组小鼠肠道菌群细菌属比例Fig.6 Proportions of intestinal flora bacterial genera of mice in each group
3 讨论
银屑病是一种病因不明的慢性炎症性皮肤病,其发病是遗传、环境和免疫学因素共同作用的结果[10]。最新研究表明,免疫细胞(尤其是T细胞、DCs)与角质形成细胞在推动炎症过程中起重要作用,且这些炎症过程参与银屑病发展[11]。目前研究发现,T细胞在人银屑病皮损过程中明显增多[12]。T细胞激活的细胞因子信号通路是银屑病炎症反应的重要组成部分[13]。IL-23/IL-17轴失调参与以及其他炎症细胞因子(如IL-1、IL-36和IL-22)过量产生在人类银屑病发病途径中发挥关键作用[14]。既往研究表明,长时间(5~7 d)采用TLR7激动剂咪喹莫特可诱发银屑病样皮肤炎症[15-16]。研究显示,咪喹莫特诱导的银屑病样炎症明显可反映人类斑块型银屑病特点,包括皮肤红斑和鳞屑形成、表皮增厚、角质形成细胞分化改变、新血管生成和免疫细胞皮肤浸润[17]。本研究采用咪喹莫特成功诱导银屑病小鼠模型。
青霉素是治疗感染性疾病的抗生素,研究证明,青霉素可用于银屑病治疗,且患者耐受性良好[18-20]。但青霉素对银屑病的治疗作用机制尚未阐明。本研究采用青霉素局部治疗,可明显减轻咪喹莫特诱导的BALB/c小鼠炎症反应,显著降低PASI评分,表明青霉素治疗银屑病可能通过减轻炎症反应发挥作用。银屑病是一种由T细胞介导的慢性炎症性免疫性皮肤病[21]。本研究显示,与对照组相比,模型组CD4+T细胞、CD8+T细胞百分比明显低于对照组,CD11c+DCs百分比明显高于对照组,与模型组相比,青霉素组CD4+T细胞百分比明显高于模型组,CD11c+DCs百分比明显低于模型组,表明青霉素可能通过调节CD4+T细胞及CD11c+DCs调节银屑病样小鼠免疫功能。虽然CD8+T细胞是银屑病的重要参与者,但本研究中CD8+T细胞百分比无明显变化,可能与小鼠银屑病致病机理与人银屑病致病机理不同有关。
近年研究指出,微生物群在多种生物过程中发挥重要作用,其受环境和饮食因素影响,可维持效应T细胞和调节性T细胞平衡以及诱导免疫球蛋白A释放,从而调节免疫应答[22]。此外,微生物群除对胃肠道有影响,还可影响其他器官和组织,肠道菌群失调在部分情况下与皮肤慢性炎症性疾病(如银屑病)有关[23]。抗生素治疗可在短时间内改变肠道菌群组成,降低其肠道菌群多样性[24]。本研究发现,模型组和对照组肠道菌群数无明显差异,而青霉素组乳酸杆菌、双歧杆菌数明显少于模型组,肠球菌、肠杆菌数明显多于模型组,表明青霉素可改变银屑病小鼠肠道菌群组成,增强其免疫功能。OTU代表物种丰富度,Chao1、ACE均代表物种总数,Shannon、Simpson代表菌群多样性,Shannon越高,Simpson越低,菌群多样性越高。进一步测序结果显示,青霉素组OTU、Chao1、ACE、Shannon值明显低于模型组,Simpson值明显高于模型组,且青霉素组放线菌门、变形菌门比例明显高于模型组,厚壁菌门、拟杆菌门比例明显低于模型组,另外,副拟杆菌属、粪芽孢菌属比例明显高于模型组,表明腹腔注射青霉素治疗,银屑病小鼠肠道菌群明显改变,生物多样性明显降低。HUANG等[25]研究指出,阿奇霉素可通过减少溶酶体酸化及破坏TLR成熟和信号转导抑制咪喹莫特诱导的DCs激活,并对咪喹莫特诱导的小鼠银屑病样炎症具有明显改善作用,可能是治疗银屑病的潜在药物。另一项研究指出,IL-17抑制剂和IL-12/23抑制剂可改善银屑病患者肠道微生物群组成[26]。因此,青霉素可能通过降低生物多样性调节肠道免疫,从而改善免疫耐受与炎症平衡,最终促进疾病转归,但尚缺乏更多证据支持,尤其是青霉素的用药方式是否影响其对肠道菌群的作用有待进一步研究,后续还需进行更多体内外实验验证,为探索青霉素治疗银屑病的可能分子机制提供更多有价值的参考。
综上所述,青霉素可通过改变肠道菌群组成降低肠道微生物多样性,调节免疫细胞因子及相关因子表达,减轻银屑病小鼠皮肤炎症,从而改善皮损状况,有助于进一步阐明银屑病发病机理,为银屑病治疗提供新参考。

