杨梅素通过诱导巨噬细胞自噬抑制NLRP3炎症小体激活
罗连响 黄芳芳 吴锐剑 黄宇戈(广东医科大学海洋医药研究院,湛江524023)
Nod样受体蛋白3(NLRP3)炎症小体是由天然免疫感受器NLRP3、接头蛋白ASC和caspase-1前体组成的多聚蛋白复合物,其组装可导致caspase-1的激活,活化的caspase-1随后促进IL-1β前体和IL-18前体裂解,从而产生成熟的、有功能的IL-1β和IL-18[1-3]。研究表明,NLRP3炎症小体可被包括危险相关分子模式(DAMPs)和病原体相关分子模式(PAMPs)在内的多种不同刺激所激活,并且这些刺激可能通过ROS产生、离子通量和溶酶体损伤三个过程激活NLRP3炎症小体,但具体机制仍未明确[1]。目前,NLRP3炎症小体已被报道与多种自身炎症和自身免疫性疾病有关,包括痛风、2型糖尿病、肥胖、骨关节炎、动脉粥样硬化以及多发性硬化、阿尔茨海默病和帕金森病等神经退行性疾病[4-11]。因此,寻找靶向NLRP3炎症小体的抑制剂,可能是治疗NL‑RP3炎症小体相关疾病的较好选择。
杨梅素是一种常见的植物类黄酮,广泛存在于各种水果和蔬菜中,并具有多种重要的药理活性,包括抗氧化、抗炎、抗糖尿病、抗癌以及镇痛等[12-14]。目前,已有研究表明杨梅素能抑制NF-κB的激活和促炎细胞因子IL-1β的分泌[15-16]。这些发现促使我们研究杨梅素调控NLRP3炎症小体激活的可能机制。本研究发现杨梅素可抑制NLRP3炎症小体的组装以及调节线粒体ROS产生,并通过诱导细胞自噬抑制NLRP3炎症小体激活。这些发现证实杨梅素是治疗NLRP3驱动的疾病的一种潜在抑制剂。
1 材料与方法
1.1 材料THP-1细胞购自American Type Culture Collection(ATCC);iBMDM细胞由北京生命科学研究所邵峰院士赠送;杨梅素购自MedChemExpress;1640培养基、DMEM培养基、胎牛血清(FBS)和0.25%Trypsin-EDTA(1×)购自Gibco;抗IL-1β(p17)抗体、抗caspase-1抗体、抗NLRP3抗体、抗LC3抗体、抗AMPK抗体、抗P-AMPK抗体、抗mTOR抗体、抗P-mTOR抗体购自Cell Signaling Technology(CST);抗SQSTM1/p62抗体、抗Beclin-1抗体购自Abcam;DAPI、活性氧检测试剂盒购自碧云天公司;Mito‑ROSTM580购自AAT Bioquest。二氧化碳培养箱(型号FORMA STERI-CYCLE i160)购自美国Thermo Electron公司;超净工作台(型号SW-CJ-2D)购自苏州净化设备有限公司;流式细胞仪(型号EPICS XLMCL)购自美国BECKMAN COULTER公司;超分辨激光扫描共聚焦荧光显微镜(型号FV3000)购自日本Olympus公司;化学发光成像仪(型号GelView 6000M)购自广州博鹭腾仪器仪表有限公司;微孔板分光光度计(型号EPOCH)购自美国BioTek公司。
1.2 方法
1.2.1 细胞培养及刺激iBMDM细胞培养在含10%胎牛血清和1%青霉素/链霉素的DMEM高糖培养基中。THP-1细胞培养在含10%胎牛血清和1%青霉 素/链霉素的RPMI Medium 1640培养基中。所有细胞于37℃、5%CO2的培养箱中培养。
为诱导NLRP3炎症小体活化,将5×105个/ml iBMDM细胞和5×105个/ml THP-1细胞分别接种于12孔板中,过夜。第2天将每孔更换为500 µl含250 ng/ml LPS的培养基,并处理细胞4 h,4 h后加入杨梅素刺激30 min,最后用Nigericin(10µmol/L)刺激细胞30 min,以诱导典型的NLRP3炎症小体活化。THP-1细胞在用LPS刺激前需先用50 nmol/L PMA诱导分化3 h。
刺激结束后,收集细胞培养上清至1.5 ml EP管中,并将上清中的蛋白通过甲醇氯仿的方法抽提出来:首先将上清12 000 r/min离心5 min去除死细胞,然后转移至新的离心管中,每个离心管中加入等体积的甲醇和四分之一体积的氯仿,涡旋混匀,12 000 r/min室温离心5 min。离心后的液体会分为3层,中间一层为蛋白层,将上层液体去掉,再加入等体积的甲醇,混匀后离心5 min,尽可能弃尽上清。然后55℃金属浴干燥5 min。最后加入35µl 2×SDS上样缓冲液,100℃金属浴10 min。培养板上的细胞则加入40µl RIPA裂解液裂解10 min,12 000 r/min、4℃离心10 min,然后将上清转移至新的EP管中,最后加入10µl 5×SDS上样缓冲液,100℃金属浴5 min。
1.2.2 Western blot检测蛋白表达水平将收集的蛋白样品进行SDS-PAGE电泳,置于转膜仪转膜。转膜后分别孵育一抗抗体,4℃孵育过夜。第2天洗膜后加入稀释(1∶4 000)的二抗,室温孵育1 h。二抗孵育完成后,显影仪显影。
1.2.3 免疫荧光法检测ASC斑点形成提前1天将iBMDM细胞铺于6孔板,在铺细胞之前将无菌的方形盖玻片放入6孔板。第2天进行NLRP3炎症小体活化刺激,收样时吸掉培养基,用PBS洗3次,然后加入4%多聚甲醛(PFA)室温固定20 min。弃掉PFA,PBS室温浸洗3次,每次5 min。然后加500µl 0.5%Triton X-100(PBS配制)室温破膜15 min,再用PBS浸洗3次,每次5 min。之后用山羊血清封闭0.5 h。去除封闭液后加入PBS浸洗3次,每次5 min。加入相应的一抗稀释液(5%BSA稀释1∶300),静置于4℃冰箱过夜。第2天回收一抗,加入PBS浸洗3次,每次5 min。然后加入对应的荧光二抗稀释液(PBS稀释1∶1 000)室温避光1 h。再用PBS避光清洗3次,每次5 min。接着加入DAPI染色液(PBS稀释1∶2 000)室温避光10 min。去除DAPI并加入PBS避光清洗3次,每次5 min。最后,准备好载玻片,并于每个样品处加50µl抗淬灭封片液,将玻片倒扣于之封片液上,4℃避光保存。在激光共聚焦显微镜下观察,并拍照记录结果。
1.2.4 流式细胞术检测细胞内ROS和线粒体ROS的产生荧光探针DCFH-DA检测细胞内ROS的形成。iBMDM以每孔5×105个细胞的密度接种在12孔板中。第2天进行NLRP3炎症小体活化刺激后,将细胞与终浓度为10 µmol/L的DCFH-DA在37℃孵育30 min。最后用PBS清洗细胞,重悬细胞后在流式细胞仪上检测荧光强度,激发波长为488 nm,发射波长为525 nm。
荧光探针MitoROSTM580检测线粒体ROS(mtROS)的形成。THP-1细胞以每孔5×105个细胞的密度接种在12孔板中。进行NLRP3炎症小体活化刺激后,将细胞与1×MitoROSTM580在37℃孵育30 min。最后用PBS清洗细胞,重悬细胞后在流式细胞仪上检测荧光强度,激发波长为540 nm,发射波长为590 nm。
1.3 统计学处理使用GraphPad Prism 8.3.0软件分析统计数据信息。所有数据以±s表示。两组间数据比较采用双尾t检验,多组数据间的比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 杨梅素阻断THP-1细胞中NLRP3炎症小体激活为了确定杨梅素(图1A)能否抑制NLRP3炎症小体活化,用Nigericin诱导NLRP3炎症小体活化,并观察杨梅素对NLRP3炎症小体活化导致的IL-1β(p17)分泌的影响。结果显示,杨梅素能够剂量依赖抑制培养上清液中IL-1β的分泌,而不影响细胞裂解物中的前体蛋白pro-IL-1β、pro-caspase-1和NL‑RP3的表达(图1B)。
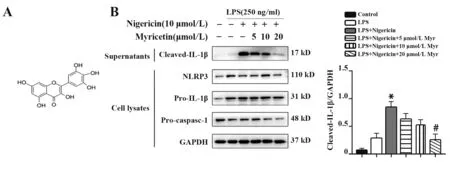
图1 杨梅素阻断THP-1细胞中NLRP3炎症小体激活Fig.1 Myricetin blocks activation of NLRP3 inflamma⁃some in THP-1 cells
2.2 杨梅素抑制ASC斑点形成在NLRP3炎症小体激活过程中伴随着ASC斑点的形成,其是cas‑pase-1激活和IL-1β分泌的关键事件[17-18]。为了解杨梅素是否可以减少ASC斑点的形成,本研究用免疫荧光法进行了检测。与杨梅素对IL-1β分泌的抑制作用一致,杨梅素显著降低了Nigericin诱导的ASC斑点形成(图2)。LPS和Nigericin处理后,iBM‑DM细胞胞浆中出现ASC齐聚,呈斑点状结构(图2,第3列),而杨梅素处理显著减少了Nigericin诱导的ASC斑点的形成(图2,第4列),表明杨梅素处理抑制了NLRP3炎症小体的组装。
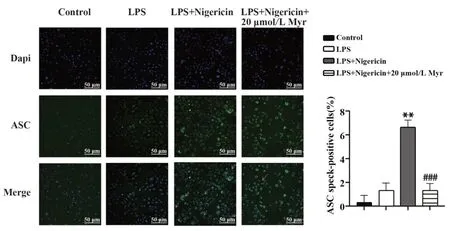
图2 免疫荧光法检测ASC斑点形成Fig.2 Detection of ASC speck by immunofluorescence
2.3 杨梅素通过抑制ROS和mtROS的产生抑制NLRP3炎症小体的激活一些细胞事件被认为是NLRP3炎症小体激活的上游事件,包括ROS和mtROS的产生[19]。为了确定杨梅素是否通过影响ROS以及mtROS产生从而影响NLRP3炎症小体活化,本研究采用流式细胞术进行了检测。结果显示,杨梅素处理可抑制iBMDM细胞内ROS以及THP-1细胞中mtROS的产生(图3),表明杨梅素可通过调节NLRP3炎症小体激活的上游事件中ROS和mtROS的产生从而影响NLRP3炎症小体活化。
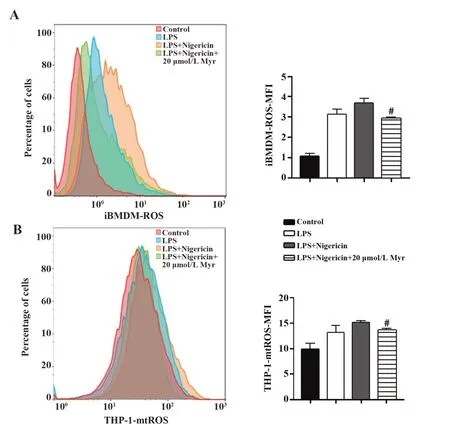
图3 流式细胞术检测ROS和mtROS的形成Fig.3 Detection of ROS and mtROS formation by flow cy⁃tometry
2.4 杨梅素通过诱导细胞自噬抑制NLRP3炎症小体的激活为了探索杨梅素抑制NLRP3炎症小体激活和ROS产生的机制,本研究对参与清除ROS的信号通路进行了检测,发现杨梅素处理增加了THP-1细胞中自噬相关蛋白LC3Ⅱ、P62、Beclin-1的产生,而不影响AMPK和mTOR的磷酸化(图4)。LC3Ⅱ是自噬发生的标志[20],因此,本研究结果表明杨梅素可通过诱导THP-1细胞自噬抑制NLRP3炎症小体的激活。
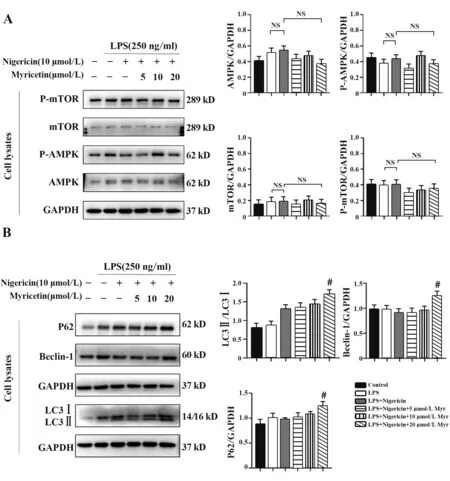
图4 Western blot检测细胞裂解物中AMPK、P-AMPK、mTOR、P-mTOR、P62、Beclin-1和LC3的表达Fig.4 Western blot was used to detect expressions of AMPK,P-AMPK,mTOR,P-mTOR,P62,Beclin-1 and LC3 in cell lysates
3 讨论
本研究发现杨梅素是一种NLRP3炎症小体激活抑制剂,在人和小鼠的巨噬细胞中都具有显著的抗炎活性,可抑制NLRP3炎症小体的组装以及ROS的产生,并通过诱导细胞自噬来抑制NLRP3炎症小体的激活(图5)。此外,杨梅素是一种常见的植物类黄酮,是蔬菜、茶和水果等多种人类食物的关键成分之一,具有较高的安全性[12]。因此,本研究结果揭示了杨梅素作为潜在的抑制剂用于治疗NL‑RP3炎症性疾病的新用途。
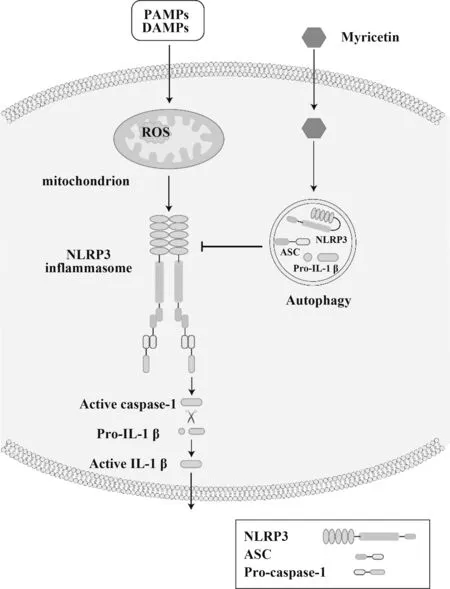
图5 杨梅素抑制NLRP3炎症小体激活示意图Fig.5 Schematic diagram illustrates inhibitory effect of Myricetin on NLRP3 inflammasome activation
NLRP3炎症小体的活化需要两个不可或缺的信号。第一个信号(也称为启动信号)通过激活NFκB通路诱导pro-IL-1β的表达[21],第二个信号触发NLRP3炎症小体组装,导致caspase-1的激活和随后的IL-1β成熟[22]。目前,研究已表明杨梅素主要基于对NF-κB通路的抑制作用来发挥抗炎活性[15-16],该通路可被第一个信号所激活。然而,本研究结果表明,抑制NLRP3炎症小体的激活对杨梅素发挥抗炎活性也起着重要作用。ASC寡聚在NLRP3炎症小体激活过程中是必不可少的,而杨梅素可通过抑制ASC寡聚从而影响NLRP3炎症小体的组装和激活。
先前的研究表明,杨梅素是一种强效的抗氧化剂,而ROS的产生是最早发现的NLRP3炎症小体激活的共同信号通路之一[12,23]。因此,本研究重点研究了杨梅素是否通过调控ROS的产生来影响NL‑RP3炎症小体激活。结果表明,杨梅素可抑制ROS的产生从而抑制NLRP3炎症小体活化。线粒体是细胞内ROS的主要来源,各种应激条件,包括代谢率增加、缺氧或膜损伤,均可显著诱导线粒体产生ROS[24]。因此,进一步研究了杨梅素对mtROS生成的影响,发现杨梅素可通过抑制mtROS的产生抑制NLRP3炎症小体激活。NAKAHIRA等[25]的研究也表明,LPS和ATP对caspase-1的激活取决于ROS和mtROS的生成。
炎症小体是一种先天免疫结构,主要在髓系细胞(如巨噬细胞)中被激活,并诱导依赖性细胞因子的产生以保护宿主免受微生物感染[26]。然而,炎症小体经常被宿主来源的刺激因子和环境刺激物错误地激活,引起大量的炎症因子释放,从而导致炎症性疾病的发展。自噬是细胞内回收和清除受损蛋白质和细胞器以及破坏细胞内病原体的重要过程[27]。有研究表明,NLRP3炎症小体的活性受到自噬的负调控,自噬可以通过不同的机制调节NLRP3炎症小体的激活[25,28-29]。一方面,自噬可清除受损的细胞器,如线粒体,导致线粒体来源的DAMPs释放减少,从而抑制炎症小体激活[27]。另一方面,自噬可促进炎症小体成分的降解,从而抑制炎症小体的激活[27]。而这一过程主要依赖于p62,在巨噬细胞中刺激NLRP3炎症小体后,ASC被p62识别,NL‑RP3炎症小体组分(包括NLRP3和ASC)与自噬体共定位,表明NLRP3炎症小体可以被自噬体吞噬和降解[30]。本研究发现杨梅素可诱导细胞自噬从而抑制NLRP3炎症小体的激活,但其具体作用机制需进一步研究。
综上,本研究结果证实了杨梅素对巨噬细胞中NLRP3炎症小体激活的抑制作用,并且考虑到杨梅素在临床上的高安全性和低成本,提示杨梅素具有治疗NLRP3炎症性疾病的潜力。

