GⅡ.17型诺如病毒人源中和性单链抗体制备及生物特性鉴定①
王璐 侯玉珍 曾志云 谢东杰 邱梦丝 张绪富戴迎春
(南方医科大学公共卫生学院流行病学系,广州510515)
诺如病毒(norovirus,NoV)是引发全球各年龄段人群急性胃肠炎(acute gastroenteritis,AGE)暴发流行及散发的主要病原体,占全球AGE发病的近20%[1]。NoV的低感染剂量及传播途径多样化,在医院、养老院、学校、托儿中心及餐馆等半封闭环境中迅速传播[2-4]。全球范围内,NoV感染每年可导致约6.99亿病例和22万人死亡,医疗费用达40亿美元以上,因丧失劳动力产生的间接社会费用超过600亿美元[1,5]。我国NoV发病率为80万例/年,年均发病率为6.0/100人年,5岁以下儿童年均发病率约为15.6/100人年[6]。因此,NoV暴发流行及散发是我国及世界范围内的重要公共卫生问题。
NoV属杯状病毒科,是单股正链小RNA病毒,直径约27~38 nm,基因组全长约7.4~7.7 kb,可识别人类组织血型抗原(histo-blooding group antigen,HBGA)作为受体或病毒附着因子,HBGA是研究NoV易感性和致病性的重要因素[7-10]。基于VP1氨基酸序列的多样性,可将其分为GⅠ~GⅩ共10个基因组,共49个基因型[11]。GⅠ、GⅡ和GⅣ可感染人类,其中GⅡ.4 NoV是1996年以来暴发流行及散发最主要基因型,占所有NoV相关胃肠炎暴发的70%~80%[6,12]。2014年以来,中国、日本等亚洲国家均报道了由GⅡ.P7~GⅡ.17新变异株引发的NoV相关胃肠炎暴发[13-15]。2014~2015年,这一变异株在NoV暴发中占76.9%,取代GⅡ.4/2012 Sydney株成为我国2014~2015年和2015~2016年NoV流行的主要流行株[16]。
目前,NoV疫苗和特异性抗体药物研究主要集中于GⅡ.4,本团队前期研究表明,GⅡ.4预存抗体对与GⅡ.17感染无明显交叉保护作用,因此建议将GⅡ.17纳入NoV候选疫苗研制范畴,开展其中和抗体及抗原表位研究[17]。本研究基于一起GⅡ.17 NoV感染引发的急性胃肠炎暴发,采集患者恢复期外周血,采用噬菌体展示技术构建NoV噬菌体抗体库,筛选特异性GⅡ.17 NoV单链抗体,并进行原核系统表达,得到中和性单链抗体,为NoV临床防治及相关疫苗研制提供依据。
1 材料与方法
1.1 材料RevertAid First Strand cDNA Synthesis Kit、限制性内切酶NotⅠ/SfiⅠ/BamHⅠ、GeneJET Gel Extraction Kit、GeneJET Plasmid Miniprep Kit、Phusion High-Fidelity DNA Polymerase购自Thermo Fisher Scientific;High Pure Viral RNA Kit购自罗氏公司;NoV荧光定量检测试剂盒购自上海之江生物科技有限公司;Ficoll-PaqueTMPLUS Media淋巴细胞分离液、HRP-鼠抗M13单克隆抗体和凝血酶购自GE公司;T4连接酶 和DNA Marker购 自TaKaRa公司;免疫管购自NUNC公司;96孔酶标板购自Corn‑ing公 司;2×Phanta Max高 保 真 聚 合 酶 和ClonEx‑press®ⅡOne Step Cloning Kit购自诺唯赞公司;TMB、大肠杆菌E.coliTG1购自碧云天公司;大肠杆菌E.coli TOP10和BL21购自天根生物技术有限公司;噬菌粒载体pCANTAB-5E购自Amersham Bio‑sciences公 司;pGEX-4T-1质 粒、辅 助 噬 菌 体M13KO7、GⅡ.17/GⅡ.4/GI.3 NoV P颗 粒、鼠 抗GⅡ.17/GⅡ.4/GⅠ.3 NoV血清和分泌型B型唾液为本实验室保存。
1.2 方法
1.2.1 样本采集及病例定义2017年12月25日广州市某部队暴发一起以呕吐、腹泻等为主要症状的急性胃肠炎[18]。采集患者肛拭子或粪便样本18份,2018年1月16日(暴发后3周)采集患者恢复期外周血13份,患者知情同意。根据《NoV感染暴发调查和预防控制技术指南(2015版)》,临床诊断病例为2017年12月25日以来,该部队所有官兵出现腹泻(≥3次/24 h,伴有大便性状改变)或呕吐(≥3次/24 h)之一者;确诊病例定义为粪便或肛拭子标本经NoV核酸检测呈阳性的临床诊断病例[19]。
1.2.2 粪便混悬液制备与总RNA提取采用PBS将粪便配制为10%~20%悬液,剧烈振荡1 min,4℃、12 000 r/min离心10 min,收集上清,-80℃保存。按照High Pure Viral RNA Kit说明书,从肛拭子或粪便样本中提取病毒核酸,得到的总RNA用于RTRCR检测或-80℃保存。实验均在二级生物安全柜中进行。
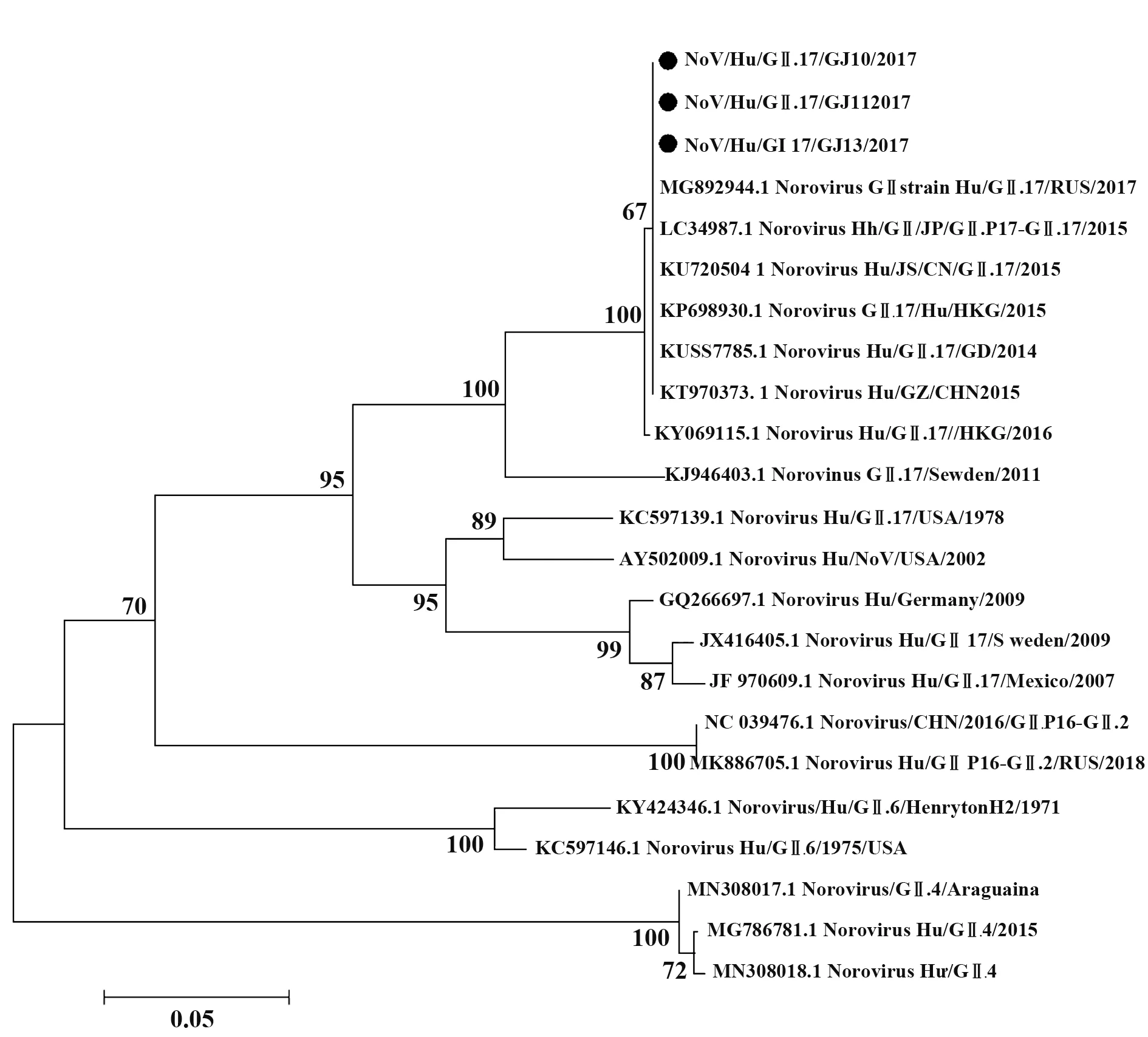
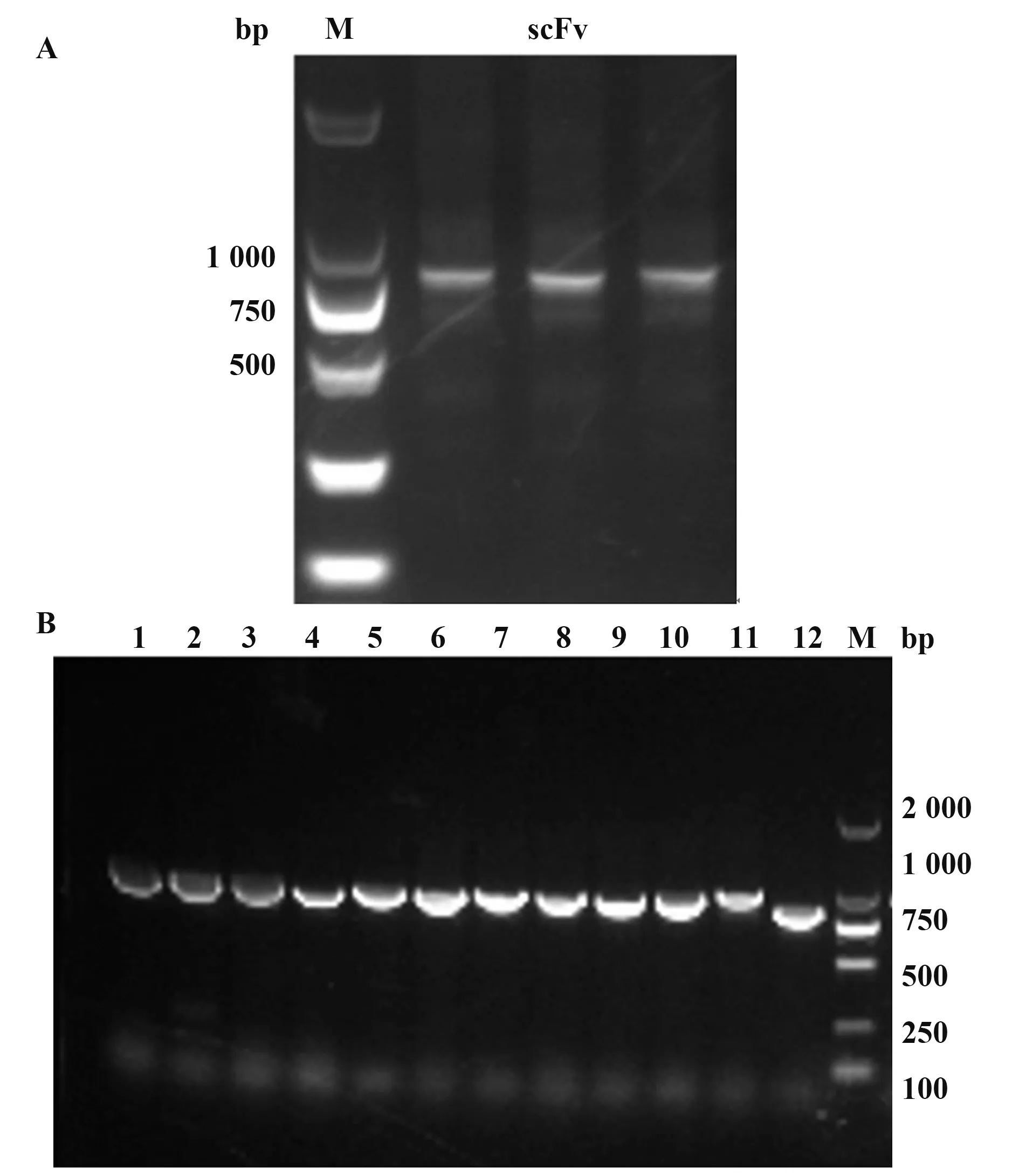
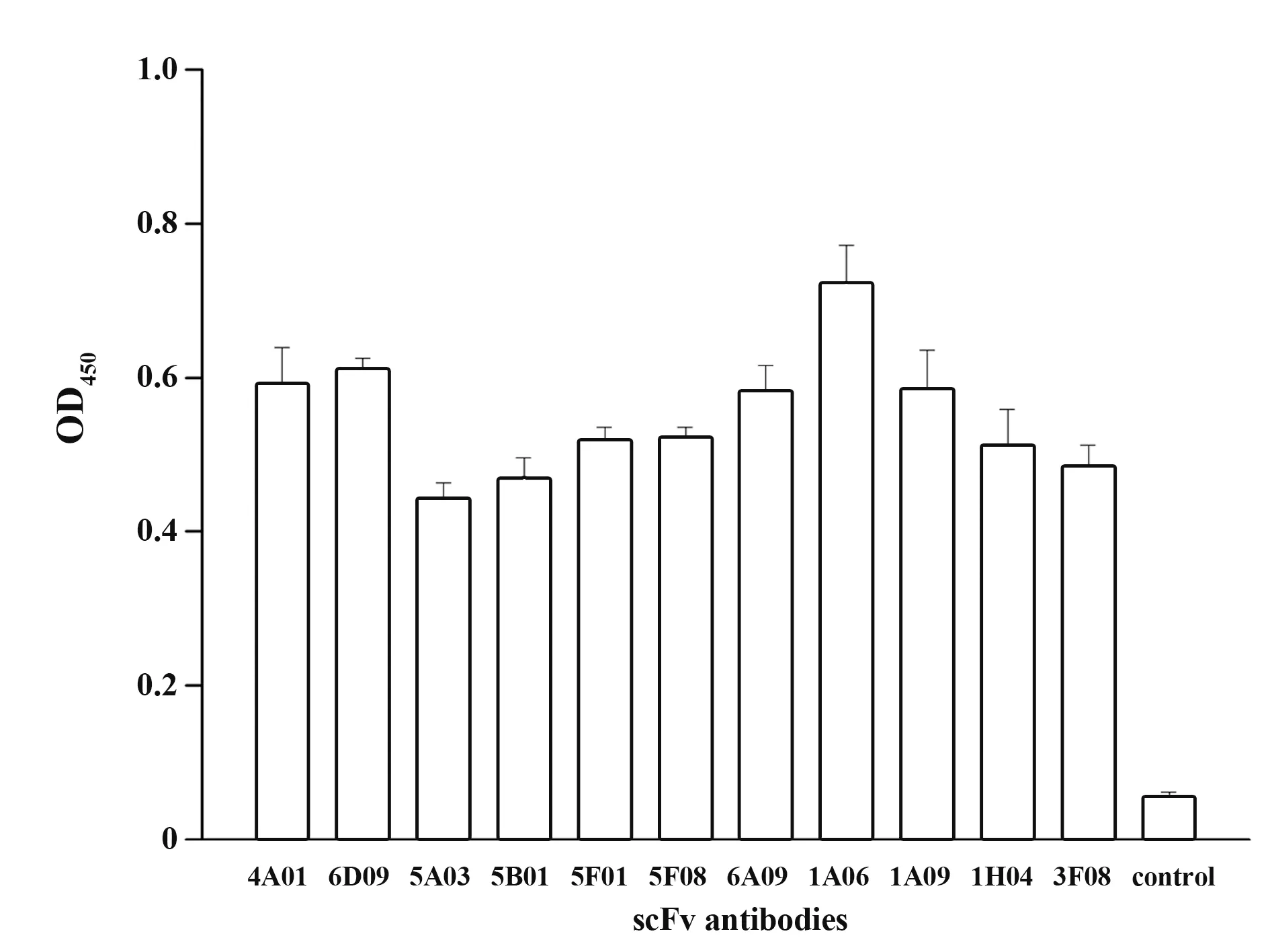
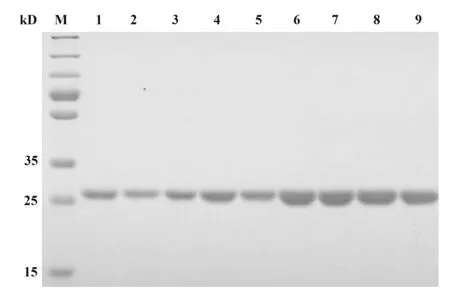
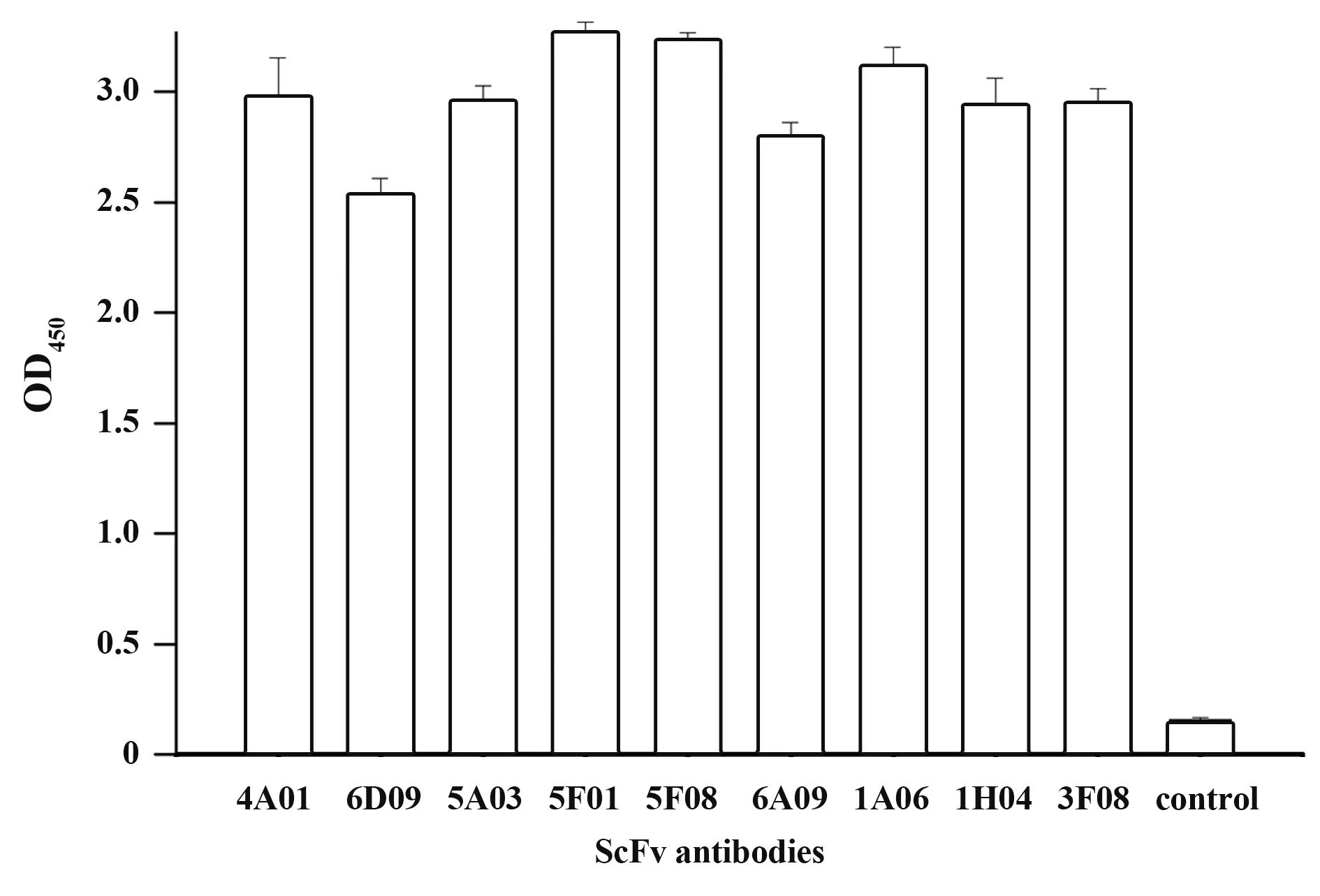
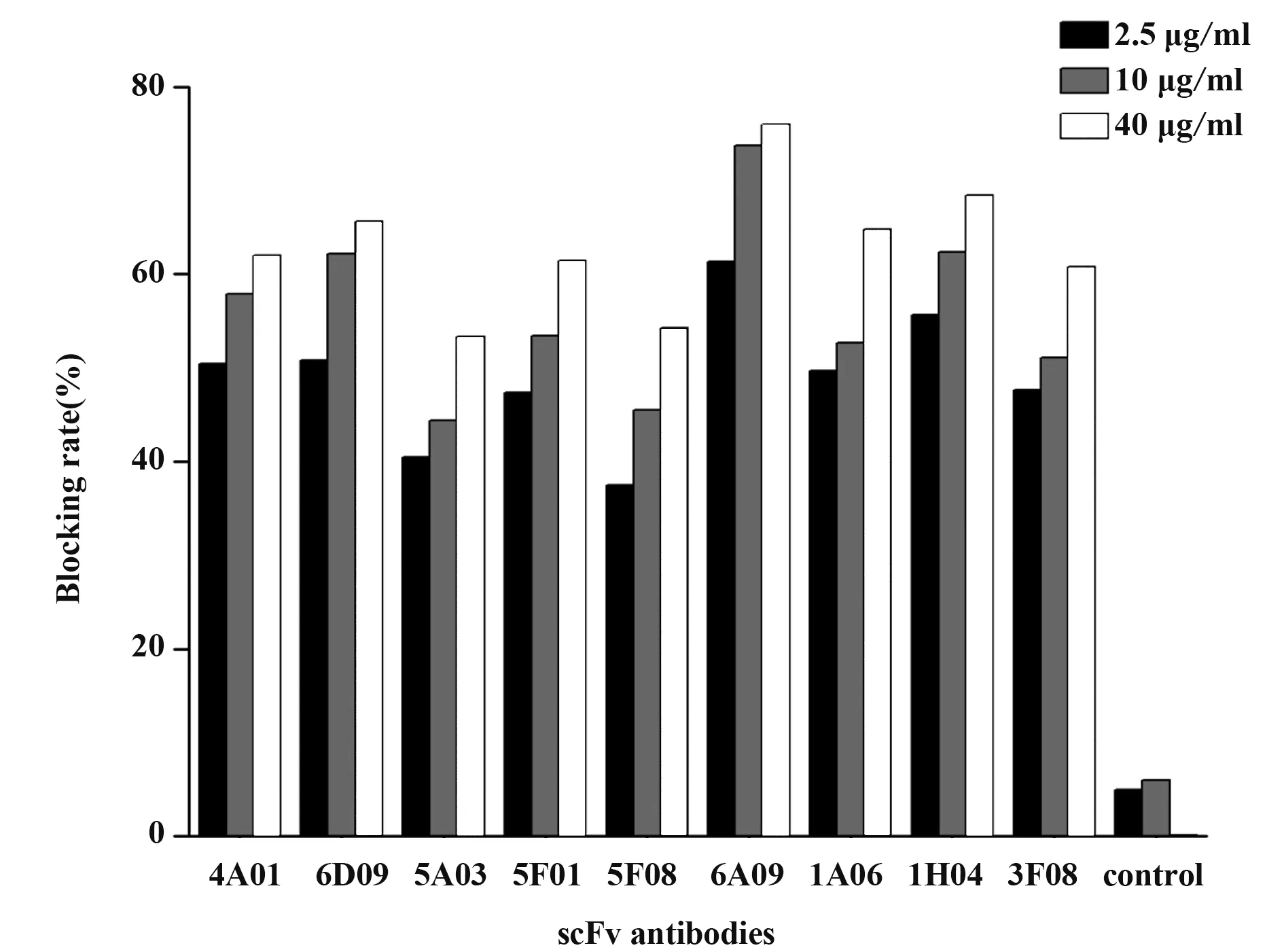
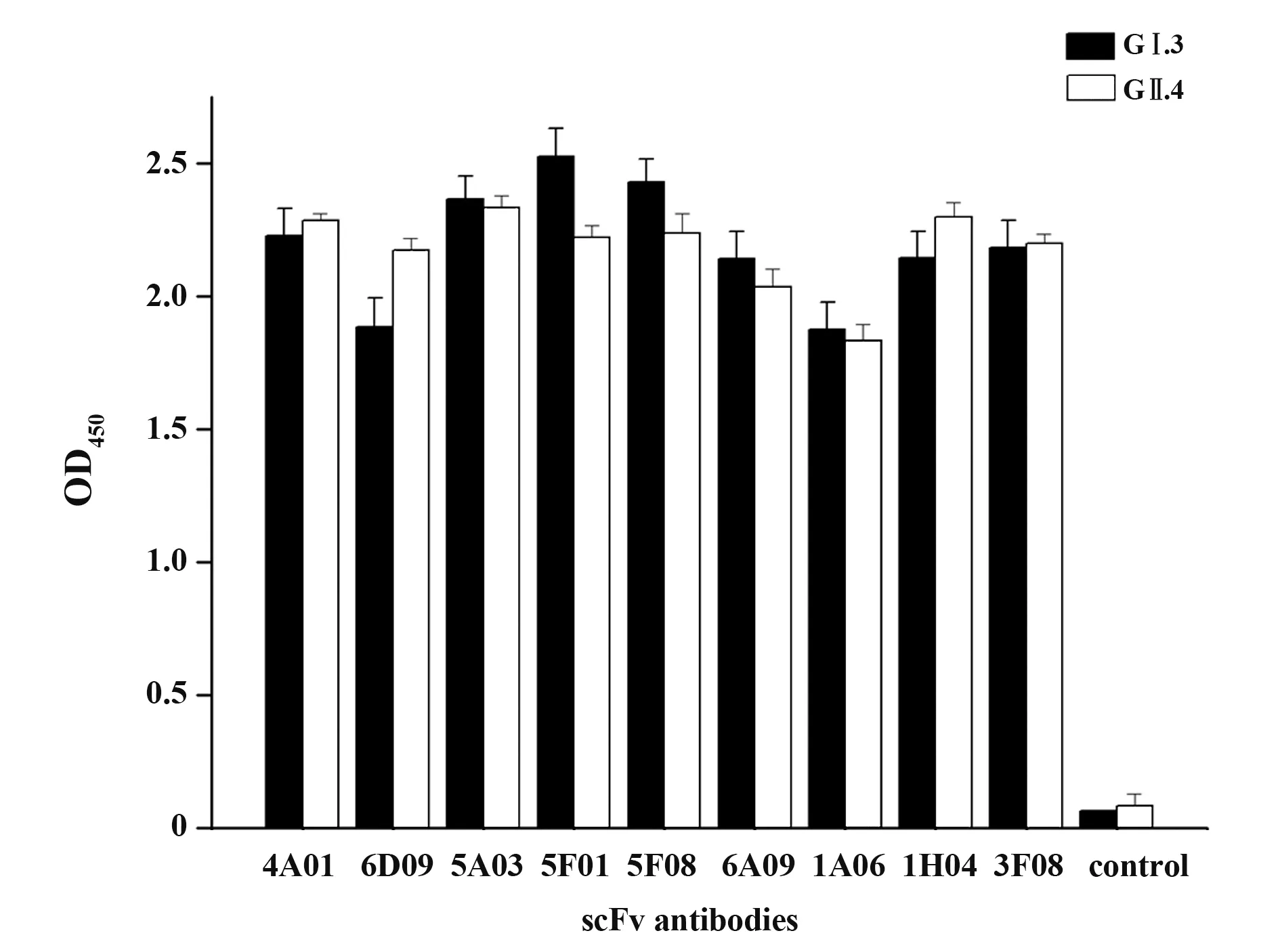
1.2.3 RT-PCR和实时荧光RT-PCR按照Rever‑tAid First Strand cDNA Synthesis Kit说明书对总RNA进行RT-PCR检测。根据NoV荧光定量检测试剂盒说明书检测NoV GⅠ、GⅡ型。判断标准:Ct≤30为阳性;30 1.2.4 NoV基因序列扩增、纯化及序列分析按照Phusion High-Fidelity DNA Polymerase说明书,扩增NoV衣壳蛋白基因区N/S端基因序列,判断NoV基因型;扩增P区域基因序列,构建进化树。根据GeneJET Gel Extraction Kit说明书,对PCR产物进行纯化,并将产物送华大基因公司进行测序。采用DNAStar中的MegAlign分析核苷酸序列同源性,Mega 4.0软件分析基因序列,邻接法(neighbor-join‑ing,NJ)构建系统进化树,自展法(bootstrap)进行可信度检测,重复次数设为1 000。 1.2.5 患者恢复期外周血中总RNA提取按照密度梯度离心法,采用Ficoll-PaqueTMPLUS Media淋巴细胞分离液从NoV患者恢复期外周血中分离PBMC和血浆,Trizol法提取PBMC总RNA,并进行RT-PCR检测,采用随机引物合成cDNA第一链。 1.2.6 pCANTAB-5E-scFv重组质粒构建参考文献[20-21],设计合成扩增人抗体基因引物。以cD‑NA第一链为模板,分别采用抗体重轻链的混合正反向引物扩增抗体重轻链基因(VH和VL);以等量VH和VL为模板,重叠PCR将两者随机拼接成scFv;采用限制性内切酶SfiⅠ和NotⅠ分别将pCANTAB-5E和scFv双酶切,回收双酶切片段;采用用T4连接酶将两者纯化产物16℃连接过夜,所得产物即为重组质粒pCANTAB-5E-scFv。 1.2.7 人源GⅡ.17型NoV噬菌体单链抗体库构建将重组质粒电转化至感受态细胞E.coli TG1中,37℃、180 r/min振荡培养1 h,取少量菌液梯度稀释,铺SOB-AG固体培养基30℃培养过夜;次日随机挑取单克隆抗体进行菌落PCR,选取阳性克隆测序,鉴定抗体库重组率和多样性,测定抗体库初级库容;剩余菌液加入辅助噬菌体M13KO7和氨苄青霉素(100 mg/ml),37℃孵育30 min,37℃、180 r/min振荡培养1 h;1 000 g离心10 min,弃上清,采用2×YT-AK培养基混匀菌体,37℃、250 r/min振荡培养12~16 h;次日4℃、1 000 g离心15 min,收集上清,PEG/NaCl沉淀重组噬菌体颗粒,混匀,冰上孵育30 min;4℃、10 000 g离心30 min,弃上清,1%BSA重悬沉淀;4℃、10 000 g离心5 min,收集上清,即得到人源抗NoV噬菌体单链抗体库。取少量菌液梯度稀释,加入对数期TG1,室温孵育15 min,铺板,过夜培养,数克隆数,计算抗体滴度。实验均在二级生物安全柜中进行。 1.2.8 噬菌体抗体库筛选以GⅡ.17 NoV P颗粒(5µg/ml)为固相抗原,包被免疫管,4℃孵育过夜,PBS洗2遍,5%脱脂奶封闭,37℃孵育2 h,PBS洗2遍,加入1 ml噬菌体抗体库,37℃孵育2 h,0.05%PBST洗9~15遍,加入对数期E.coli TG1直接感染,37℃孵育15 min,移至培养瓶,补加2×YT-A培养基;向免疫管内加入0.1 mol/L甘氨酸-盐酸洗脱液(pH=2.2)37℃孵育10 min,颠倒数次,加入2 mol/L Tris中和液(pH=8.8)快速混匀,再次加入对数期TG1,37℃孵育15 min;将免疫管中菌液转移至上述培养瓶,混匀,取少量菌液铺氨苄抗性琼脂板,隔日计算产出量,37℃、220 r/min振荡培养1 h,补加2×YT-A培养基,培养至对数生长期,加入辅助噬菌体M13KO7,并加入卡那霉素(50 mg/ml),30℃、220 r/min振荡培养过夜;次日4℃、8 000 r/min离心15 min,收集上清,加入PEG/NaCl充分混匀,冰浴30 min;4℃、8 000 r/min离心30 min,弃上清,1% BSA重悬沉淀;4℃、10 000 g离心5 min,收集上清。取少量上清梯度稀释,铺氨苄抗性琼脂板,隔日计算投入量,并进行下一轮筛选,“吸附-洗涤-洗脱-感染-拯救”共4轮,最终富集与GⅡ.17 P颗粒特异性结合的噬菌体单链抗体。实验均在二级生物安全柜中进行。 1.2.9 Phage-ELISA鉴定及DNA序列分析第4轮洗脱后挑取琼脂板上单克隆,加入2×YT-A培养基,37℃、200 r/min振荡培养8 h,补加辅助噬菌体M13KO7,30℃、200 r/min振荡培养过夜;次日室温1 000 r/min离心5 min,收集噬菌体上清。实验均在二级生物安全柜中进行。将GⅡ.17 NoV P颗粒(0.1µg/ml)、轮状病毒VP8*(对照抗原,0.1µg/ml)、PBS(空白对照)包被于96孔酶标板,以获得的噬菌体上清为一抗,同时以无噬菌体上清的培养基为阴性对照,HRP-antiM13抗体为二抗,TMB显色,测定各孔OD450,选取OD450值较高的阳性噬菌体克隆,送华大基因公司测序,DNA Star软件分析测序结果。 1.2.10 原核表达载体pGEX-scFv构建根据阳性克隆测序结果,挑取序列正确的克隆,设计scFv原核表达引物,在上下游引物中均引入载体pGEX-4T-1的两末端同源序列,分别引入BamHⅠ和NotⅠ酶切位点。以阳性克隆的菌液为模板,采用对应引物分别扩增scFv片段,根据ClonExpress®ⅡOne Step Cloning Kit说明书,将scFv片段重组克隆至线性化载体pGEX-4T-1,并将同源重组产物转化至感受态细胞E.coli T0P10,取菌液铺氨苄抗性琼脂板,37℃培养过夜。次日挑取单克隆进行菌液PCR,将阳性克隆送测序,并按照GeneJET Plasmid Miniprep Kit说明书提取重组质粒,即为重组原核表达载体 pGEX-scFv。 1.2.11 scFv原核表达及纯化将pGEX-scFv质粒转至感受态细胞E.coliBL21,取菌液铺氨苄抗性琼脂板,37℃培养过夜。次日挑取单克隆,37℃、200 r/min振荡培养过夜;按1∶100转接至LB培养基,37℃振荡培养至细菌对数期,加入1 mmol/L IPTG,22℃、220 r/min振荡过夜诱导表达。4℃、5 000 r/min离心12 min,收集菌体,PBS充分重悬菌体,冰浴中对其进行超声破碎;4℃、12 000 r/min离心75 min,收集上清,采用GST-resin亲和层析柱进行分离纯化,加入凝血酶,22℃酶切过夜,次日收集滤液,即为scFv可溶性抗体。 1.2.12 scFv抗体特异性鉴定将纯化后的scFv抗体稀释至终浓度为1µg/ml,包被于96孔酶标板,以GST蛋白为阴性对照,PBS为空白对照,4℃孵育过夜,封闭,加入GⅡ.17 NoV P颗粒(0.02µg/ml),37℃孵育1 h;以鼠抗GⅡ.17血清为一抗,HRP-羊抗鼠IgG为二抗,TMB显色,测定各孔OD450。 1.2.13 scFv抗体中和能力检测采用HBGA受体结合实验确定所用GⅡ.17 NoV P颗粒浓度,采用经预试验证实结合力强和稳定性高的B型抗原作为HBGA受体,与梯度稀释的GⅡ.17 NoV P颗粒结合,使其OD450为0.7~1.3。将HBGA表型明确的分泌型B型唾液标本稀释至终浓度为1∶1 000,包被于96孔酶标板,4℃孵育过夜;将已确定所用浓度的GⅡ.17 NoV P颗粒与4倍梯度稀释的scFv(稀释浓度为40、10、2.5 µg/ml)的混合液37℃孵育1 h,阳性对照采用未加scFv的P颗粒,阴性对照采用确定无阻断能力的血浆和P颗粒的混合液,空白对照采用1%脱脂奶粉-PBS代替scFv和P颗粒的混合液,加入酶标板,并以鼠抗GⅡ.17血清为一抗,HRP-羊抗鼠IgG为二抗,TMB显色,测定各孔OD450。阻断率(%)=(阳性对照OD450-实验组各孔OD450)/阳性对照OD450×100%。 1.2.14 scFv抗体与GⅡ.4/GⅠ.3 NoV P颗粒交叉反应选取常见流行株GⅠ.3和GⅡ.4分别作为GⅠ和GⅡ型代表株,与单链抗体进行交叉反应。具体操作同1.2.12。 2.1 暴发调查及NoV序列进化分析实时荧光RT-PCR检测结果显示,18份粪便或肛拭子样本中15份为GⅡNoV核酸阳性,RT-PCR扩增NoV衣壳蛋白N/S区序列并测序,经GenBank BLAST比对分析确定该急性胃肠炎暴发由GⅡ.17型NoV感染引起。GJ10、GJ11和GJ13株核苷酸序列同源性达99.7%~100%,并从GenBank中选取NoV VP1基因序列,构建系统进化树(图1)。 图1 GⅡ.17型NoV VP1部分基因进化树Fig.1 Phylogenetic analysis based on partial VP1 gene sequence of GⅡ.17 NoV 2.2 VH和VL基因扩增以PBMC中获得的cDNA第一链为模板,PCR扩增抗体重轻链可变区基因VH和VL(Vκ和Vλ),片段大小为300~500 bp,凝胶电泳结果见图2。 图2 VH和VL基因PCR扩增产物Fig.2 PCR amplification results of VH and VL 2.3 噬菌体抗体库构建及鉴定采用Overlap PCR将VH和VL拼接为约750 bp的scFv片段(图3A),将 其克隆至pCANTAB-5E,电转获得初级噬菌体抗体库,挑取单菌落进行PCR检测并测序,结果显示,各序列彼此不重复,说明该抗体库重组率和多样性均较好(图3B)。根据板上细菌生长情况,计算初级噬菌体抗体库库容约为2.4×107CFU/ml。 图3 scFv片段、抗体库菌落PCR产物Fig.3 PCR products of scFv and clones from antibody library 2.4 噬菌体抗体库富集以GⅡ.17 NoV P颗粒为固相抗原,对噬菌体抗体库进行4轮富集,噬菌体产出率从第1轮的2.8×10-7提升至第4轮的2.9×10-5,说明抗GⅡ.17 NoV特异性噬菌体单链抗体得到有效富集(表1)。 表1 噬菌体抗体库4轮筛选结果Tab.1 Results of 4 rounds of phage antibody library screening 2.5 Phage-ELISA鉴定及序列分析随机挑取第4轮筛选出的单克隆抗体,加入辅助噬菌体M13KO7拯救,包被GⅡ.17 NoV P颗粒,取噬菌体上清进行Phage-ELISA,将阳性菌液进行测序分析,最终得到11株序列不同且正确的单链抗体基因scFv(图4)。 图4 噬菌体阳性克隆Phage-ELISA鉴定Fig.4 Phage-ELISA identification of positive clones of phage 2.6 筛选后scFv DNA序列分析选取测序结果中1条核酸序列进行翻译,酶切位点SfiⅠ和NotⅠ间的scFv基因片段全长753 bp,其中VH片段为366 bp,编码122个氨基酸,VL为342 bp,编码113个氨基酸,连接肽为1条15个氨基酸的多肽片段(图5)。 图5 scFv测序及翻译结果分析Fig.5 Sequencing and translation analysis of scFv 2.7 全人源scFv表达以序列正确且翻译无误的阳性菌液为模板,PCR扩增scFv片段,将产物与载体pGEX-4T-1连接转化,构建原核表达载体pGEXscFv,并于感受态细胞E.coliBL21中表达,纯化所得抗体经SDS-PAGE电泳鉴定,可见9个约27 kD的目的蛋白(图6),与scFv大小相符,成功获得9株全人源单链抗体scFv。 图6 全人源scFv SDS-PAGE结果Fig.6 SDS-PAGE results of human scFv 2.8 scFv特异性鉴定采用ELISA鉴定scFv特异性,结果显示,9株抗体可与GⅡ.17 NoV P颗粒结合,均具有良好反应性(图7)。 图7 scFv特异性鉴定Fig.7 Identification of scFv specificity 2.9 scFv中和能力鉴定采用体外HBGA受体阻断实验确定9株scFv中和能力,即阻断GⅡ.17 NoV P颗粒与HBGA受体结合能力,结果显示,9株scFv随浓度增加,阻断率逐渐升高,40 µg/ml时阻断率均>50%,其中6A09中和能力最强,40µg/ml时阻断率达76.0%(图8)。 图8 scFv阻断GⅡ.17 P颗粒与HBGA结合的能力Fig.8 Ability of scFv to block GⅡ.17 P particle binding to HBGA receptor 2.10 scFv与GⅡ.4/GⅠ.3 NoV P颗粒的交叉反应 ELISA鉴定scFv与GⅡ.4/GⅠ.3 NoV P颗粒的交叉识别能力,结果显示,9株抗体与GⅡ.4/GⅠ.3 NoV P颗粒均具有良好的交叉反应(图9)。 图9 scFv抗体与GⅡ.4/GⅠ.3 P颗粒的交叉反应Fig.9 Cross reaction between scFv and GⅡ.4/GⅠ.3 P particles NoV是全球范围内引起各年龄AGE暴发、散发及流行的主要病原体,由于NoV流行株的抗原多样性、变异进化,且缺乏成熟的细胞培养系统及小动物感染模型,其疫苗和特异性抗病毒药物研究进展缓慢,过去30年,GⅡ.4 NoV一直是全球范围内的优势流行株,因此,现阶段NoV疫苗开发及研制主要集中于GⅡ.4,5种亚单位候选疫苗已进入临床和临床前研究阶段[22]。本团队前期研究表明,GⅡ.4抗体免疫对与GⅡ.17感染无交叉保护作用[17],因此开展GⅡ.17 NoV特异性中和抗体及疫苗研制具有重要意义。 传统单克隆抗体制备主要采用杂交瘤技术,但获得的鼠源性单抗用于人类具有较强的免疫原性,易诱发人抗鼠抗体(human anti-mouse antibody,HA‑MA)反应,导致其在体内半衰期较短,无法有效激活人体生物效应[23-25]。与前者相比,全人源抗体具有亲和力强、特异性高等特点,且无种属异源性,是重要的治疗性抗体药物。噬菌体抗体库技术是目前最成熟、应用最广泛的人源抗体制备技术之一,将抗体基因编码肽段和噬菌体外壳蛋白融合并展示于噬菌体表面,再对抗体库进行多轮“吸附-洗脱-扩增”,可筛选出大量特异性抗体基因,具有高效、快捷、经济等优势,所得抗体库易于进行高通量筛选。与IgG和Fab相比,scFv具有可更好在原核系统中表达、耐受性好、免疫原性低、安全性和有效性更高等优点。中和性抗体也在抗病毒免疫保护中起重要作用[26-28]。目前采用该技术已成功制备多种FDA批准使用的人源单克隆抗体,如Ranibizumab用于湿性老年性黄斑变性治疗,Raxibacumab与抗菌药物联合用于吸入性炭疽的预防治疗等[28]。 本研究基于一起GⅡ.17 NoV引起的急性胃肠炎暴发,采集患者恢复期外周血,这一阶段,体内可产生大量记忆性B细胞,前期实验发现患者血浆中具有较高水平的中和抗体,为制备中和性scFv库提供保障;采用噬菌体展示技术获得库容约为2.4×107CFU/ml的全人源噬菌体抗体库,筛选得到11株与GⅡ.17 NoV特异性结合的scFv;在原核系统中进行表达纯化,得到9株高纯度scFv抗体;采用体外HBGA受体阻断实验对其中和能力进行鉴定,最终获得7株可明显阻断GⅡ.17与HBGA受体结合的scFv。其 中,Phage-ELISA结 果 显 示,1A06株 与GⅡ.17 P颗粒结合能力最强,与scFv特异性鉴定中的强弱结果不一致,原因可能为前者所用一抗为噬菌体抗体,而后续实验采用的是经原核系统表达纯化的scFv,噬菌体抗体和纯化后的抗体结构和性质可能有差异,而噬菌体自身外壳蛋白也可能影响scFv属性,从而导致Phage-ELISA与后续实验结果差异。该9株scFv与GⅡ.4和GⅠ.3 P颗粒交叉反应结果显示,GⅡ.17 NoV scFv对GⅡ.4/GⅠ.3有较好的交叉反应,说明该抗体可能对NoV其他亚型存在交叉识别现象。 本研究获得的具有中和能力的全人源抗GⅡ.17 NoV scFv具有高亲和力和高特异性,有望成为抗体候选药物,同时可用于后续中和表位鉴定,对NoV新型表位疫苗设计和抗体药物研发具有重要意义。2 结果



3 讨论

