miR-1204靶向调控DEK蛋白对非小细胞肺癌细胞凋亡的影响及作用机制研究
蒋 慧 邵乐健 杨树坤 宋 瑞(皖北煤电集团总医院呼吸内科,宿州234000)
肺癌是全球范围内发病率较高和死亡速度较快的原发性恶性肿瘤,严重威胁人类生命和身体健康[1-2]。非小细胞肺癌约占肺癌的80%,包括鳞状细胞癌、腺癌、大细胞癌,癌细胞生长分裂较快,且扩散转移较早[3]。非小细胞肺癌早期症状为发热、咳嗽、胸痛等,多数患者因以上初期症状被误诊,约75%患者发现时已处于中晚期,错过了最佳治疗时机[4]。非小细胞肺癌临床治疗方法以手术为主,以放化疗、中药治疗为辅,但患者生存率仍然较低。靶向治疗逐渐成为研究热点,为非小细胞肺癌治疗提供了新思路。miR-1204异常表达与肿瘤发生发展密切相关。DEK蛋白是高度保守的转录调控因子,被确认为是一种癌基因,其过表达已被证实与多种人类恶性肿瘤相关,可作为肿瘤治疗靶点[5]。本文旨在研究miR-1204靶向调控DEK蛋白对非小细胞肺癌细胞凋亡的影响及作用机制,为非小细胞肺癌靶向治疗提供依据。
1 材料与方法
1.1 材料 人非小细胞肺癌细胞株(中国医学科学院肿瘤细胞库);兔抗大鼠Bak抗体(Invitrogen公司);大鼠抗小鼠Bcl-2抗体(Dako公司);兔抗小鼠caspase-7抗体(Selleck公司);兔抗人DEK抗体(武汉博士德生物);BCA蛋白定量试剂盒、MTT试剂盒(天根生化);磷酸盐缓冲液、胎牛血清、DMSO(北京中杉金桥)。
1.2 方法
1.2.1 细胞培养及分组 采用含10%胎牛血清的培养液培养人非小细胞肺癌细胞株,培养条件为37℃、5%CO2,85%融合时传代。
1.2.2 慢病毒载体构建及分组 根据质粒特点设计miR-1204引物序列,引入SacⅠ酶切位点,F:5'-UCGUGGCCUCCUCUCCAUUAU-3',R:5'-AGCACCGGACCAGAGGUAAUA-3',由宝生物工程(大连)有限公司合成,将正反链混合后加入退火缓冲液,94℃反应4 min,冷却至室温,生成双链。采用Eco31Ⅰ酶切线性化质粒pGenesil-1,将退火产物100倍稀释后与其连接,22℃孵育过夜,采用大肠杆菌DH5α转化,第2天采用单克隆菌落接种于30 μg/ml Kana的LB培养液,200 r/min离心,37℃振动混合过夜。抽提少量质粒,采用SacⅠ酶切鉴定(上海生工生物工程技术服务有限公司完成),分为空白组、miR-1204上调组和miR-1204下调组,重悬,分别加入4 μg生理盐水、pcDNA3.1-miR-1204、miR-1204siRNA,电击,室温存放120 min,将各组细胞加入6孔、96孔板,培养箱内培养,加入含800 μg/ml G418的培养基再次培养。
1.2.3 ELISA检测DEK表达 将待检细胞采用胰酶消化后制成细胞悬液。50 mmol/L碳酸盐稀释抗DEK,置于聚苯乙烯反应孔,4℃放置24 h,次日洗涤3次,甩干,各孔中加入稀释液稀释的待测标本0.1 ml,同时加入阴性阳性的对照标本,45℃放置60 min,洗涤3次,移除液体,各孔中加入0.1 ml DEK酶标抗体,45℃放置60 min,洗涤3次,移除液体,各孔中加入0.1 mol/L Na2HPO4和0.05 mol/L枸橼酸混匀,加入0.1 ml邻苯二胺,遮光保存20 min,加入0.05 ml H2SO4(2 mol/L)终止反应,酶标仪检测DEK水平。
1.2.4 MTT法检测细胞增殖 将待测细胞置于96孔板,12 h、24 h、72 h后加入MTT溶液常温孵育4 h,加入DMSO,酶标仪检测波长497 nm处各孔OD值。
1.2.5 流式细胞术检测细胞凋亡 将培养好的细胞用磷酸盐缓冲液清洗3次,各组取样本细胞加入5 μl AnnexinV染液和10 μl碘化丙啶染液,常温避光染色30 min,流式细胞仪检测细胞凋亡。
1.2.6 流式细胞术检测细胞周期分布 将培养好的细胞用70%乙醇溶液固定,4℃保存过夜,离心5 min去除固定液,磷酸盐缓冲液清洗3次。加入100 μl RNA酶(100 μg/ml),常温保存30 min,加入100 μl碘化丙啶染色液,低温避光染色30 min,流式细胞仪检测细胞周期分布。
1.2.7 Transwell小室实验细胞侵袭、迁移情况 细胞侵袭情况:实验开始前2 h湿化小室,上室加入细胞悬液200 μl,下室加入含10%胎牛血清的细胞培养液培养24 h,PBS冲洗2次,4%多聚甲醛中放置30 min。细胞迁移情况:胰酶消化细胞制成细胞悬液,接种于6孔板,10枪尖垂直于孔板底部划直线,PBS缓冲液清洗3次,常温培养24 h,拍照,计算划痕。
1.2.8 Western blot检测细胞凋亡相关蛋白表达
提取蛋白,采用BCA试剂盒测定蛋白浓度,离心10 min,取上清电泳5 min,10%牛奶封闭90 min。加入一抗孵育1 d,清洗,加入二抗孵育1 h,清洗,显色,检测细胞凋亡相关蛋白Bak、Bcl-2、caspase-9表达。
1.3 统计学处理 采用SPSS20.0软件进行统计学分析。计量资料以±s描述,3组间比较采用F检验,两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-1204靶向调控DEK表达miR-1204下调组DEK表达高于空白组(P<0.05)。miR-1204上调组DEK表达低于空白组、miR-1204下调组(P<0.05,表1)。
表1 miR-1204靶向调控DEK表达(±s)Tab.1 miR-1204 targeting regulated DEK expression(±s)

表1 miR-1204靶向调控DEK表达(±s)Tab.1 miR-1204 targeting regulated DEK expression(±s)
Note:Compared with blank group,1)P<0.05;compared with down-regulated miR-1204 group,2)P<0.05.
Groups Blank Down-regulated miR-1204 Up-regulated miR-1204 DEK 0.85±0.22 1.34±0.421)0.69±0.101)2)
2.2 各组非小细胞肺癌细胞增殖率、凋亡率比较miR-1204下调组细胞增殖率高于空白组(P<0.05);miR-1204上调组细胞增殖率低于空白组、miR-1204下调组(P<0.05)。miR-1204下调组细胞凋亡率低于空白组(P<0.05);miR-1204上调组细胞凋亡率高于空白组、miR-1204下调组(P<0.05,表2)。
表2 各组非小细胞肺癌细胞增殖率、凋亡率比较(±s,%)Tab.2 Comparison of proliferation rate and apoptosis rate of NSCLC cells in each group(±s,%)
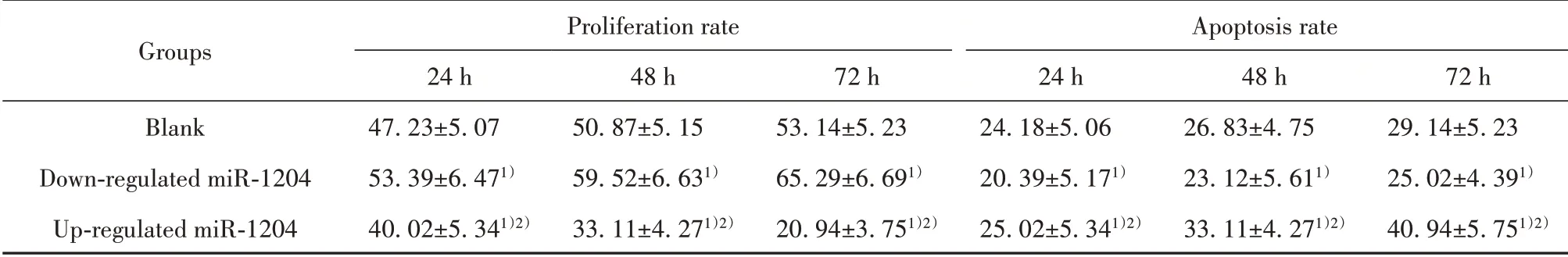
表2 各组非小细胞肺癌细胞增殖率、凋亡率比较(±s,%)Tab.2 Comparison of proliferation rate and apoptosis rate of NSCLC cells in each group(±s,%)
Note:Compared with blank group,1)P<0.05;compared with down-regulated miR-1204 group,2)P<0.05.
Groups Blank Down-regulated miR-1204 Up-regulated miR-1204 Proliferation rate 24 h 47.23±5.07 53.39±6.471)40.02±5.341)2)48 h 50.87±5.15 59.52±6.631)33.11±4.271)2)72 h 53.14±5.23 65.29±6.691)20.94±3.751)2)Apoptosis rate 24 h 24.18±5.06 20.39±5.171)25.02±5.341)2)48 h 26.83±4.75 23.12±5.611)33.11±4.271)2)72 h 29.14±5.23 25.02±4.391)40.94±5.751)2)
2.3 各组非小细胞肺癌细胞周期分布情况比较miR-1204下调组细胞处于G1期的比例高于空白组(P<0.05);miR-1204上调组细胞处于G1期的比例低于空白组、miR-1204下调组,(P<0.05,表3)。
表3 各组非小细胞肺癌细胞周期分布情况比较(±s,%)Tab.3 Comparison of cell cycle distribution of NSCLC in each group(±s,%)
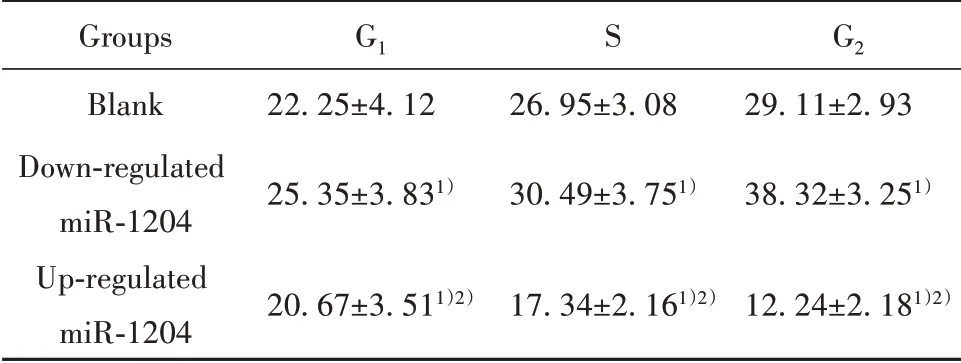
表3 各组非小细胞肺癌细胞周期分布情况比较(±s,%)Tab.3 Comparison of cell cycle distribution of NSCLC in each group(±s,%)
Note:Compared with blank group,1)P<0.05;compared with down-regulated miR-1204 group,2)P<0.05.
Groups Blank Down-regulated miR-1204 Up-regulated miR-1204 G1 22.25±4.12 25.35±3.831)20.67±3.511)2)S 26.95±3.08 30.49±3.751)17.34±2.161)2)G2 29.11±2.93 38.32±3.251)12.24±2.181)2)
2.4 各组细胞侵袭、迁移能力比较 空白组、miR-1204上调组侵袭细胞数明显多于miR-1204下调组(P<0.05);空白组与miR-1204上调组迁移细胞数明显少于miR-1204下调组(P<0.05,表4、图1)。
表4 细胞侵袭、迁移情况(±s,%)Tab.4 Cell invasion and migration(±s,%)

表4 细胞侵袭、迁移情况(±s,%)Tab.4 Cell invasion and migration(±s,%)
Note:Compared with blank group,1)P<0.05;compared with down-regulated miR-1204 group,2)P<0.05.
Groups Blank Down-regulated miR-1204 Up-regulated miR-1204 Invasive cells number 63.87±12.59 82.64±16.751)51.66±9.851)2)Migrating cells number 66.72±11.37 79.66±13.551)55.67±8.761)2)
2.5 各组细胞凋亡相关蛋白Bak、Bcl-2、caspase-9表达 如表5、图2所示,miR-120下调4组细胞Bcl-2、caspase-9蛋白表达高于空白组,Bak蛋白表达低于空白组(P<0.05);miR-1204上调组细胞Bcl-2、caspase-9蛋白表达低于空白组、miR-1204下调组,Bak蛋白表达高于空白组、miR-1204下调组(P<0.05)。
表5 各组细胞凋亡相关蛋白Bak、Bcl-2、caspase-9表达(±s)Tab.5 Expressions of apoptosis related proteins Bak,Bcl-2 and caspase-9 in each group(±s)
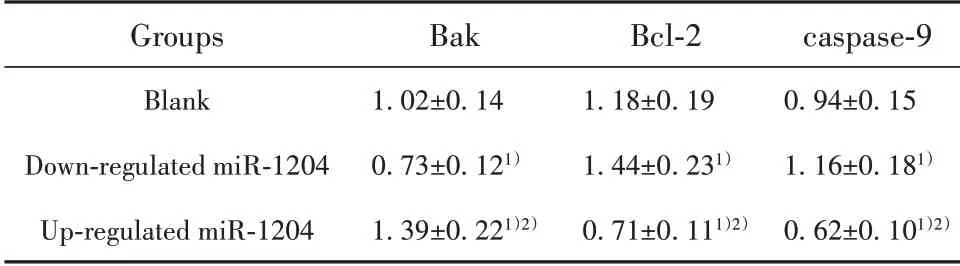
表5 各组细胞凋亡相关蛋白Bak、Bcl-2、caspase-9表达(±s)Tab.5 Expressions of apoptosis related proteins Bak,Bcl-2 and caspase-9 in each group(±s)
Note:Compared with blank group,1)P<0.05;compared with down-regulated miR-1204 group,2)P<0.05.
Groups Blank Down-regulated miR-1204 Up-regulated miR-1204 Bak 1.02±0.14 0.73±0.121)1.39±0.221)2)Bcl-2 1.18±0.19 1.44±0.231)0.71±0.111)2)caspase-9 0.94±0.15 1.16±0.181)0.62±0.101)2)

图2 Bak、Bcl-2、caspase-9表达Fig.2 Expressions of Bak,Bcl-2 and caspase-9
3 讨论
非小细胞肺癌是肺原发性恶性肿瘤,位居我国城市人口恶性肿瘤死亡原因第一[6]。EGRF络氨酸激酶抑制药使分子靶向治疗进入人们的视野,为非小细胞肺癌个体化治疗注入了新的生命[7]。各类靶向药物研究层出不穷,寻找有效治疗靶点对非小细胞肺癌治疗至关重要。研究证明,微小RNA(miRNA)参与多种复杂生物过程,具有组织特异性,其功能可根据靶基因作用不同调控肿瘤发生发展,具有癌基因或抑癌基因作用,可作为肿瘤诊断生物标志物[8]。
miR-1204由非蛋白编码PVTI基因座编码,对相关基因具有负调控作用,参与多个复杂生物学过程,在细胞增殖和凋亡中发挥作用[9-10]。DEK蛋白普遍存在于部分蛋白及多细胞生物中,在急性髓系白血病亚型中以DEK-CAN融合蛋白形式分离,在结肠癌、宫颈癌、乳腺癌等多种人类肿瘤中呈高表达,与肿瘤发生发展密切相关。刘双萍等[11]研究发现,DEK蛋白检测可作为宫颈癌细胞增殖指标之一,有望成为宫颈癌治疗的新靶点。本研究显示,miR-1204上调组DEK蛋白表达较低,说明上调miR-1204可降低DEK蛋白表达,对DEK具有靶向调控作用。
非小细胞肺癌细胞异常增殖可不断产生新的癌细胞,促进疾病发展。郭智慧等[12]研究认为,Notch1靶向调控DEK基因可显著抑制癌细胞增殖,抑制乳腺癌发展,提示靶向作用于DEK基因对癌细胞具有抑制效果。本研究显示,miR-1204上调组12 h、24 h、72 h非小细胞肺癌细胞增殖率降低,说明上调miR-1204可降低DEK基因表达,抑制癌细胞增殖。
细胞周期分为3个阶段:DNA合成前期(G1)、合成期(S)、合成后期(G2),S期是细胞分裂增殖的关键时期,将细胞阻滞于S期之前可有效抑制癌细胞发展[13]。李伟伟等[14]研究发现,siRNA靶向调控DEK基因可改变癌细胞周期分布。本研究显示,miR-1204上调组非小细胞肺癌细胞处于G1期的比例相对较高,说明上调miR-1204可降低DEK基因表达,改变肿瘤细胞周期分布。
非小细胞肺癌发生发展与肿瘤组织细胞不断侵袭、迁移密切相关,抑制癌细胞侵袭、迁移能力是抑制非小细胞肺癌发展的关键。本研究显示,上调miR-1204表达的非小细胞肺癌细胞侵袭、迁移细胞数相对较少,说明上调miR-1204表达可抑制非小细胞肺癌细胞侵袭、迁移,抑制肿瘤组织发展、扩散。
细胞异常凋亡与细胞异常增殖密切相关,细胞凋亡是细胞主动性凋亡过程,与多种凋亡相关因子相互作用有关[15-16]。caspase家族蛋白、Bcl-2家族蛋白等在凋亡信号中扮演重要角色[17-18]。Bcl-2家族蛋白分为促凋亡蛋白和抗凋亡蛋白2类,Bak属于促凋亡蛋白,Bcl-2属于抗凋亡蛋白;caspase-9属于凋亡执行因子[19-20]。本研究显示,miR-1204上调组12 h、24 h、72 h非小细胞肺癌细胞凋亡率升高,且miR-1204上调组细胞Bcl-2、caspase-9蛋白表达降低,Bak蛋白表达升高,说明上调miR-1204可降低DEK基因表达,通过调控细胞凋亡相关蛋白Bak、Bcl-2、caspase-9相对表达促进非小细胞肺癌细胞凋亡,抑制肿瘤发展。
综上所述,miR-1204上调可降低DEK表达,通过调控Bak、Bcl-2、caspase-9表达抑制细胞增殖,阻滞细胞周期分布,促进细胞凋亡。