Hippo信号通路与细胞因子的研究进展①
李峥嵘 曾维忠(中南大学湘雅医学院附属株洲医院重症医学科,株洲412007)
Hippo信号通路是一条高度保守的信号通路,从最初在果蝇中被发现逐渐到在高级脊椎动物中拓展,研究表明其在组织器官的生长发育过程中影响生物学过程[1]。Hippo信号通路通过调节关键的靶基因来控制细胞增殖、分化、转归、代谢和细胞凋亡,从而调节组织生长和内环境稳态。Hippo信号通路目前已知由核心激酶模块和转录模块组成(图1)[2]。激酶模块的组成部分如下:MST1/2(mammalian STE20-like protein kinase 1/2),MAP4Ks(mitogen-activated protein kinase kinase kinase kinases),LATS1/2(large tumor suppressor kinase 1/2),SAV1(salvador family WW domain-containing protein 1),RAP2s(rasrelated proteins),MOB1A/B(MOB kinase activator 1 A/B)。转录模块包括YAP(yes-associated protein)/TAZ(transcriptional co-activator with PDZ-binding motif),TEADs(TEA domain family members)。当Hippo信号通路被激活,MST1/2或MAP4Ks磷酸化并激活下游激酶LATS1/2,依次促进转录共激活因子YAP/TAZ的磷酸化,导致YAP/TAZ滞留于细胞质或被蛋白酶体降解[3]。相反,当Hippo信号通路被抑制,去磷酸化的YAP/TAZ转移至细胞核激活TEADs并与TEADs转录因子结合促进目的基因转录。YAP/TAZ介导的转录通常驱动细胞行为的多个方面,包括细胞增殖、分化、代谢、凋亡和干细胞特性的维持,这对组织生长和再生至关重要[4]。但近年来,研究者们发现调控Hippo信号通路与细胞因子中的核心组分将改变相关疾病的发生、发展,为疾病的干预与治疗提供新的方向。本文对Hippo信号通路与细胞因子的最新研究进展做一综述。
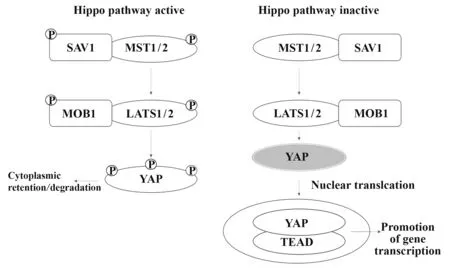
图1 Hippo信号通路激活和抑制时的级联反应简图Fig.1 A schematic of cascade of Hippo signaling pathway activation and inhibition
1 Hippo信号通路与肿瘤坏死因子α(TNF-α)
TNF-α是一种促炎细胞因子,主要由单核细胞、巨噬细胞和活化T细胞等炎症细胞以及包括内皮细胞在内的其他类型细胞产生[5]。DONG等[6]采用TNF-α干预口腔鳞状细胞癌细胞株(HN6细胞)诱导LATS 2过表达从而降低YAP协同转录激活,LATS 2过表达抑制了口腔鳞癌细胞的增殖、集落形成、细胞侵袭和体内转移灶的生长,即TNF-α可诱导LATS 2过表达抑制细胞增殖。LATS 2可能在口腔鳞状细胞癌的发生中起一定作用,TNF-α和LATS 2可能是口腔鳞癌治疗的潜在靶点。GU等[7]在大鼠急性胰腺炎细胞模型中发现YAP的过表达可增加大鼠胰腺外分泌细胞分泌TNF-α和IL-6来加重炎症反应,而MicroRNA-194则能显著抵消这种增强作用。该研究说明MicroRNA-194和YAP之间存在一个调节环,它们动态地调节急性胰腺炎的进展,这为治疗该疾病提供了一个新的治疗靶点及方向。LU等[8]在A172胶 质 母 细 胞 瘤 细 胞 系 中 发 现,MAPK-ERK-YAP信号通路是TNF-α调控线粒体裂变和胶质母细胞瘤凋亡的主要分子机制。MAPKERK信号通路是线粒体裂变的上游抑制因子,TNF-α调控线粒体裂变,MAPK-ERK-YAP信号中YAP过度表达可以中和TNF-α的细胞毒性,减轻线粒体裂变,有助于胶质母细胞瘤细胞的存活。而且研究数据显示,TNF-α介导的胶质母细胞瘤凋亡来源于线粒体裂变的增加和不活跃的MAPK-ERK-YAP信号通路,调控YAP的表达水平为胶质母细胞瘤的治疗提供潜在的新靶点[8]。DENG等[9]在YAP过表达转基因小鼠软骨中发现,YAP过度表达抑制TNF-α诱导JNK和NF-κB信号通路激活来减少骨关节炎软骨的降解,YAP过度表达为预防骨关节炎软骨降解提供了一个靶点。CHOI等[10]在内皮细胞中观察到TNF-α和YAP的关联,用TNF-α刺激人血管内皮细胞(HUVEC),激活Hippo信号通路中YAP去磷酸化,去磷酸化YAP转移至细胞核加强HUVEC中血管细胞黏附分子1(VCAM 1)和细胞间黏附分子1(ICAM-1)的表达。它们是白细胞黏附内皮细胞的重要调节因子,白细胞黏附在内皮炎症反应中起着非常重要的作用,是动脉粥样硬化斑块形成的关键环节。因此,抑制Hippo信号通路中YAP的去磷酸化可能成为阻止动脉粥样硬化斑块形成的一种新方法。上述研究阐述Hippo信号通路与TNF-α相互调控的影响,揭示了口腔鳞癌、急性胰腺炎、胶质母细胞瘤、骨关节炎、动脉粥样硬化等疾病新的可能发病机制,为上述疾病的治疗提供新的靶点与方向。
2 Hippo信号通路与IL-6
IL-6是一种常见的促炎细胞因子,IL-6由多种细胞产生,包括成纤维细胞、内皮细胞、单核细胞和巨噬细胞等[11]。李朗等[12]在急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)小鼠中发现,低表达LATS 2的骨髓间充质干细胞(mMSCs)可降低肺组织促炎因子IL-1β、IL-6水平而增加抗炎因子IL-10的产生,从而改善肺内促炎/抗炎反应失衡,可促进mMSCs在ARDS小鼠肺组织内存留及向AECⅡ分化,改善肺水肿及肺泡上皮通透性,调控肺内炎症反应,减轻肺组织病理损伤及纤维化病变。本研究阐明通过抑制Hippo信号通路LATS 2表达可提高mMSCs在肺组织内的存留时间并进一步加强mMSCs对ARDS肺部炎症的改善作用。KIM等[13]在四氯化碳诱导的肝损伤的研究中发现,TAZ在肝再生过程中表达增加,TAZ缺乏将延迟肝再生。TAZ刺激巨噬细胞浸润,产生IL-6,诱导肝细胞增殖和抑制肝损伤后细胞死亡来促进肝再生。设想是否能通过干预TAZ的激活来促进肝细胞再生?CHEN等[14]在大鼠髓核细胞的研究中发现,IL-6刺激大鼠髓核细胞,该细胞的YAP蛋白表达水平显著升高,髓核细胞的细胞外基质(ECM)降解,IL-6可激活YAP,促进髓核细胞的ECM的降解,髓核细胞的ECM降解加速椎间盘退行性变。此研究表明,YAP可能是椎间盘退行性变一种潜在的治疗靶点。WANG等[15]在研究中发现YAP能调节子宫内膜癌细胞中IL-6和IL-11的表达,而且通过上调IL-6和IL-11的表达来增加子宫内膜癌细胞的增殖,降低其化疗敏感性。所以靶向抑制YAP可以降低子宫内膜癌细胞中IL-6和IL-11的表达水平来调控子宫内膜癌细胞的恶性程度,靶向抑制YAP是治疗子宫内膜癌患者的一种潜在的治疗方法。ZHOU等[16]葡聚糖硫酸钠(DSS)诱导的炎症性肠病(IBD)小鼠中发现,敲除YAP的小鼠巨噬细胞产生较少的IL-6并且促进M2巨噬细胞极化,这样能减轻DSS诱导的结肠炎的炎症反应,所以在巨噬细胞中靶向调控YAP的表达是治疗IBD的一种潜在的治疗方法。HOU等[17]在研究中发现,IL-6刺激ER-乳腺癌细胞能促进ER-乳腺癌细胞迁移和侵袭,分子机制是IL-6激活ER-乳腺癌细胞Hippo-YAP信号,IL-6诱导YAP调控ER-乳腺癌细胞迁移和侵袭,靶向抑制IL-6/YAP信号抑制ER-乳腺癌细胞的侵袭,通过激活YAP信号,IL-6可触发乳腺癌细胞的恶性,所以靶向抑制IL-6/YAP可能是治疗ER-乳腺癌一种新的治疗方法。通过调控Hippo信号通路中核心成分的表达来影响IL-6在细胞及微环境的表达或IL-6影响Hippo信号通路的激活为肿瘤和炎症性疾病提供一种潜在的治疗方法。
3 Hippo信号通路与IL-1β
Hippo信号通路与IL-1β之间的相互联系揭示了胃癌及骨关节炎发病的新机制。WU等[18]在幽门螺杆菌(HP)感染的小鼠胃细胞中发现,HP诱导YAP进入细胞核通过增强IL-1β的表达促进胃癌的发生,YAP作为转录共激活剂与IL-1β启动子结合,从而增加IL-1β的表达。IL-1β的大量表达通过刺激癌细胞增殖,促进胃癌的发生发展。HP通过调节YAP促进IL-1β表达在胃癌的进展中发挥重要作用。所以研究者们揭示HP-YAP-IL-1β通路的联系,在胃癌的形成和发展中起着重要的作用,可能为胃癌治疗提供新的药物靶点。GONG等[19]研究发现YAP在骨关节炎(OA)软骨细胞或软骨中表达上调,YAP过表达导致IL-1β诱导软骨细胞分解代谢基因表达增加。用干扰RNA抑制YAP能抑制IL-1β诱导软骨细胞分解代谢基因表达和软骨细胞凋亡。关节腔内注射干扰RNA改善小鼠OA进展,显微CT结果显示软骨下异常骨形成也有所减少。所以用干扰RNA抑制YAP是防止OA软骨降解的有效方法。这研究表明局部抑制YAP是防止OA软骨退化的有效方式。靶向抑制YAP可干预胃癌及OA的发展进程。
4 Hippo信号通路与IL-2、IL-10
Hippo信号通路与IL-2、IL-10也存在相互作用。ZOU等[20]在创伤性脑损伤动物模型中发现,TAZ激活剂刺激肌肉组织,细胞中IL-10的基因转录显著升高,细胞分泌IL-10的量增加来调节肌肉中巨噬细胞从M1向M2表型的转变,进一步促进肌肉生长与再生。本研究揭示TAZ激活剂在肌肉疾病中的应用,并促进学术界的药物发现。ZHANG等[21]用IL-2和索拉非尼联合干预肝癌细胞发现,细胞周期蛋白的表达水平较单一运用索拉非尼干预更加减少,失活TAZ可让细胞周期蛋白表达恢复正常水平,而且Western blot试验分析显示IL-2可显著上调TAZ的表达。该研究发现一种新的方法来增强索拉非尼对肝癌的体外抗肿瘤作用。
5 Hippo信号通路与IFN-γ
IFN-γ是一种多效性细胞因子,在炎症、传染病和癌症中发挥重要作用。人鸟苷脂结合蛋白1(GBP-1)是干扰素-γ诱导细胞蛋白中最强的一种。UNTERER等[22]用建立蛋白模型的方法发现GBP-1与TEAD相互作用通过下调TEAD靶基因的转录来抑制细胞增殖。在细胞实验中研究者用siRNA抑制GBP-1表达则可使上述效应消失,这间接说明IFN-γ对细胞的TEAD活性也有抑制作用。本研究首次展示了GBP-1通过干扰素-γ与Hippo信号通路的相互作用介导抑制细胞增殖的分子机制。这可能为研究干扰素-γ的复杂细胞反应开辟新的途径,也有利于开发临床使用的活性IFN-γ。RAMJEE等[23]在心肌梗死小鼠模型中发现,过表达YAP和TAZ转基因小鼠心肌中IFN-γ表达增加并调节性T细胞(Tregs)浸润增加,小鼠心肌炎症反应受到抑制并心肌纤维化减少;而敲除YAP和TAZ的小鼠在心肌梗死后,心肌细胞中IFN-γ基因编码降低并心肌组织中Tregs浸润减少,小鼠发生严重的心肌炎和心肌纤维化;在敲除YAP和TAZ的小鼠心肌梗死后局部注射IFN-γ可增加Tregs浸润并减低心肌纤维化。本研究表明Hippo信号通路在心肌梗死后的适应性免疫调节中起着关键作用,靶向调控Hippo信号通路是否有效地调节心肌梗死后的再生和重构。
6 Hippo信号通路与TGF-β
TGF-β是一种多功能细胞因子,调节多种发育和稳态过程。TGF-β通过与细胞表面的TGF-β受体复合物结合,激活称为Smads蛋白的细胞内信号分子,启动其细胞功能[24-27]。QIN等[28]在人皮肤成纤维细胞中发现,YAP/TAZ基因敲除会损害TGF-β诱导的Smad蛋白磷酸化并抑制TGF-β靶基因表达,这揭示YAP/TAZ的基因敲除可抑制TGF-β信号转导。LV等[29]通过定量聚合酶链式反应实验发现,YAP基因敲除小鼠卵巢颗粒细胞中TGF-β受体的mRNA表达减少,并且通过Western blot试验分析,YAP基因敲除对TGF-β诱导的小鼠卵巢颗粒细胞Smads蛋白磷酸化有抑制作用。YAP通过调节TGF-β受体的转录和抑制Smads来调控小鼠卵巢颗粒细胞的TGF-β信号通路。Hippo信号通路与TGFβ信号通路的串扰从而调节小鼠颗粒细胞功能和发育,为颗粒细胞功能异常相关的不孕症提供靶点。MOHSENI等[30]用四氯化碳诱导大鼠肝纤维化模型,Western blot试验发现喂养香芹酚的大鼠肝脏组织中TGF-β、TAZ和YAP蛋白水平降低,定量聚合酶链式反应发现香芹酚降低了TGF-β、TAZ和YAP基因的表达,这说明香芹酚通过靶向TAZ、YAP和TGF-β信号通路来抑制肝纤维化的进展,这为肝纤维化的靶向治疗开辟了新的途径。
7 结语
本文阐述Hippo信号通路与细胞因子的研究进展,揭示了炎症相关疾病、肿瘤、神经系统疾病、心血管疾病等疾病发生、发展的新机制,并阐明其可能成为治疗靶点的途径。大胆设想,未来干预Hippo信号通路中的YAP/TAZ、MST1/2等组成部分在炎症相关疾病、肿瘤、神经系统疾病、心血管疾病等疾病中表达情况,是否能使临床诊断更精确、灵敏,更快速评估疾病的进展及预后,并及时进行治疗,中断病情的恶化。或者研制成靶向药物有效地控制Hippo信号通路中的关键靶点来治疗疾病。为实现Hippo信号通路与细胞因子之间的靶向调控,还有待进一步研究。