切割球囊血管成形术在肾动脉支架内再狭窄中的应用效果
王浩,王兵,王越,李阳,吴斐,王梦宇,牛晓阳
(郑州大学第五附属医院 血管外科,河南 郑州 450000)
肾动脉狭窄(renal artery stenosis,RAS)主要是由动脉粥样硬化性肾病或纤维肌发育不良引起的。动脉粥样硬化性RAS在RAS中占90%,其远期并发症为肾功能不全和高血压[1-2],是继发性高血压最常见的原因。目前,肾动脉支架置入术已成为大多数RAS的治疗选择,RAS的一级通畅性是明确的,但关于支架内再狭窄(in-stent restenosis,ISR)的二次干预,治疗结果数据有限,尚未确定肾动脉ISR的最佳治疗方法。本研究旨在评估切割球囊血管成形术(cutting balloon angioplasty,CBA)治疗肾动脉ISR的效果,为肾动脉ISR的治疗提供参考。
1 资料与方法
1.1 一般资料回顾性分析2017年9月至2020年9月郑州大学第五附属医院收治的12例肾动脉ISR患者的临床资料,其中男3例,女9例,年龄52~74岁,平均(67.83±5.80)岁,合并糖尿病6例,合并高脂血症11例,合并高血压12例,血清肌酐(serum creatinine,SCr)升高8例。狭窄病变均位于肾动脉近端或开口部,发现时间为支架置入术后4~38个月,平均(15.50±8.34)个月。
1.2 选取标准(1)纳入标准:①经肾动脉CT血管成像(computed tomography angiography, CTA)和肾动脉超声检查诊断为肾动脉ISR;②至少一侧肾动脉狭窄≥70%;③伴有难治性高血压[收缩压≥160 mmHg(1 mmHg=0.133 kPa),使用3种或更多降压药物]或轻到中度肾功能损害(SCr 130~350 μmoL·L-1)。(2)排除标准:①严重肾功能不全;②对碘对比剂有严重过敏反应,包括心跳呼吸骤停、心律失常、严重低血压 、痉挛、喉头水肿、反应迟钝等。
1.3 手术操作患者仰卧于数字减影血管造影检查床上,常规消毒铺巾,以20 g·L-1盐酸利多卡因(遂成药业股份有限公司,国药准字H41023667)于右股动脉处行局部麻醉,以Seldinger技术逆行穿刺,成功后置入6 F动脉鞘。经鞘置入单弯造影导管及0.088 9 cm超滑导丝(Terumo,日本),在两者配合下至左肾动脉水平,高压造影提示:左肾动脉支架置入后重度狭窄。再次行高压造影显示,左肾起始部狭窄约80%(图1)。交换7 F鞘管,经鞘管引入7 F导引导管,之后经导引导管引入4 F单弯导管(Cordis,美国)及超滑导丝(Terumo,日本),在两者配合下尝试通过支架狭窄段。之后引入V-14导丝(Boston Scientific,美国),在导管配合下顺利通过肾动脉支架狭窄段进入肾动脉远端。之后沿导丝引入3 mm×30 mm普通扩张球囊(Boston Scientific,美国),球囊造影显示球囊位于真腔,缓慢增压至 8~10 atm(1 atm=1.01×105Pa),维持3 min,使球囊充分扩张。然后引入5 mm×20 mm切割球囊(Boston Scientific,美国),扩张压力为10 atm,使球囊充分扩张,并保持60 s。血管成形术后动脉造影未见明显残余狭窄,未见对比剂外渗,支架远端血流正常(图2)。对于右肾动脉狭窄者,采取同样的手术方法。术中所用对比剂为碘克沙醇(江苏恒瑞医药股份有限公司,国药准字H20103675)。术后给予抗血小板治疗,复查肾动脉超声,监测 SCr、血压。
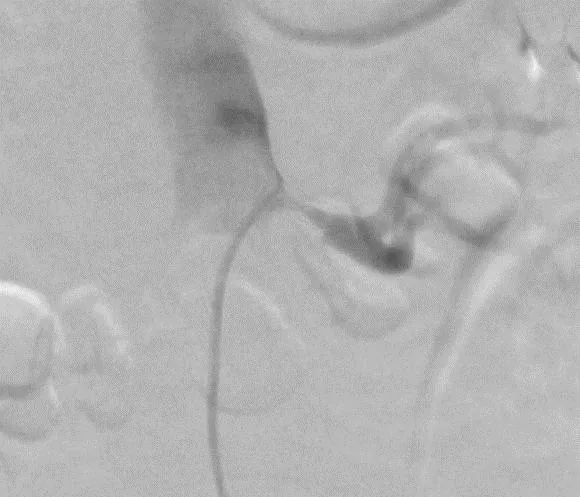
图1 左肾动脉术前血管造影结果
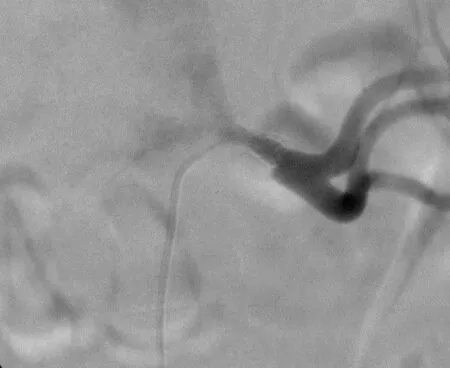
图2 左肾动脉术后血管造影结果
1.4 观察指标以干预前后肾动脉狭窄程度为主要参考指标,以术后并发症发生情况、收缩压、肾动脉收缩期最大血流速度(peak systolic velocity,PSV)、SCr及服用降压药物种类数量变化为次要参考指标。以随访时靶血管直径狭窄≥50%为再狭窄的判定标准。
1.5 随访于患者出院后3、6个月以及1 a,通过电话随访的方式回访患者血管超声、CTA复查情况,统计收缩压、肾动脉PSV、SCr及服用降压药物种类数量变化,记录有无相关夹层、狭窄或动脉瘤发生,观察血管开通情况和再狭窄率。1 a后以同样的方式每年随访1次。

2 结果
2.1 手术完成情况及并发症情况12例患者均成功手术。肾动脉造影示:左肾动脉狭窄5例(41.67%),右肾动脉狭窄7例(58.33%)。狭窄位于肾动脉开口部或近端10例(83.33%),位于肾动脉中段2例(16.67%),狭窄程度均大于70%。所用切割球囊直径为4.0~5.0 mm,其中球囊直径4.0 mm有5个(41.67%),5.0 mm有7个(58.33%)。术后所有支架未出现断裂或明显变形,病变动脉管腔直径狭窄程度由术前[(84.83±7.36)%]下降至术后[(21.92±3.70)%],差异有统计学意义(P<0.05)。12例患者术后未出现腹腔内出血、肾动脉闭塞、夹层动脉瘤、肾衰竭等严重并发症。
2.2 肾动脉PSV、SCr及收缩压CBA术后、1 a随访时,肾动脉PSV、收缩压均低于术前(P<0.05);CBA术后、1 a随访时,SCr与术前比较,差异无统计学意义(P>0.05)。见表1。
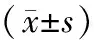
表1 CBA术前、术后及1 a随访时肾动脉PSV、SCr及 收缩压比较
2.3 预后术后随访12~31个月,平均(16.41±5.21)个月。术后1 a随访时,患者服用降压药物种类减少1~2种,CTA发现2例(16.67%)狭窄,狭窄程度约为50%,未再次进行手术治疗。
3 讨论
肾动脉支架置入术是治疗动脉粥样硬化性肾动脉狭窄的首选方法[3],ISR是动脉粥样硬化性RAS患者肾动脉支架置入术后可能出现的严重并发症。当支架置入动脉时,动脉内部弹性层就会破裂,这将导致平滑肌细胞迁移和内膜增生,内膜病变中含有导致ISR的动脉粥样硬化因素[4]。有研究显示,ISR在接受经皮肾腔内血管成形术患者中的发生率高于50%[5],而肾动脉ISR为10%~25%[6]。
当肾动脉进行性闭塞时,肾脏供血不足,通过激活肾素-血管紧张素-醛固酮系统,导致高血压的发生[7-8]。本研究12例ISR患者均接受了CBA治疗,手术成功,病变部位狭窄程度明显降低,通畅性明显改善。在术后1 a随访时,收缩压、肾动脉PSV均较术前降低,且服用降压药物种类明显减少。这表明CBA对血压的改善效果值得肯定,有助于减少降压药物种类,维持理想血压。肾动脉狭窄引起的血流动力学障碍会导致肾功能不全,可表现为SCr的增高。CBA术后、1 a 随访时,患者SCr水平均较术前有一定程度的改善,但差异无统计学意义。
目前,对于肾动脉ISR的最佳治疗方案还未达成共识。有关治疗肾动脉ISR的报道仅限于单中心小样本或不同治疗方式的病例报道,如球囊血管成形术、支架内血管成形术、血管内近距离放射治疗或放置药物洗脱支架[9-11]等。冠状动脉支架置入术的相关研究表明,重复支架置入术可于短期内获得显著疗效,但具有动脉壁过度扩张的缺点,这可能会在新内膜的动脉床中引起新的内膜增生[12]。尽管可使用旋转定向动脉粥样化斑块切除技术或准分子激光斑块切除术作为替代治疗方法,但这些方法普遍不受欢迎,因为增加了治疗费用,并且可能难以使用,绝大多数不能被广泛应用于临床,切割球囊与其相比具有优势。切割球囊的微刀片可通过类似于手术的方式将新生内膜组织切开至金属支架,这些切口有助于球囊最大限度地挤压新生内膜,使其分成3或4个象限[13]。这种直接的内膜破裂和血管壁张力降低的结果是较少的内膜损伤,可能降低继发性再狭窄率[14-15]。CBA与传统经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)相比,在治疗ISR方面也具有实际优势:传统PTA球囊在这些病变内膨胀时往往会向前后移动,因为新生内膜组织的表面光滑,并且可能对血管外部造成意外伤害,因此会导致再狭窄区域重复狭窄[16]。相比之下,切割球囊在充气过程中通过将其刀片固定在组织上,减少了在支架边缘处滑脱的风险。再狭窄切割球囊评估试验证实了CBA的这些优势[13]。一项关于CBA在再狭窄冠状动脉中的应用发现,CBA比标准的血管成形术更有效,与更昂贵的动脉粥样硬化消融术疗效大致相同[15]。
Munneke等[17]报道了1例PTA治疗无效被CBA成功治疗的肾动脉ISR患者,证实了CBA治疗肾动脉ISR的可行性和效果。同样,Otah等[1]报道了1例肾动脉几乎完全闭塞的严重ISR患者,被CBA成功治疗,证明CBA在肾动脉ISR的治疗中效果显著。这些研究表明CBA对肾动脉ISR的治疗是安全有效的,本研究与其结果类似。有研究显示,ISR患者再次接受介入治疗(包括药物洗脱支架置入、支架置入、CBA、球囊扩张)术后再狭窄率高达20%,各种方法之间无明显差异,证明CBA与其他方式治疗ISR后的再狭窄率相似[18]。Zeller等[19]采用多种腔内方法,分别对33例肾动脉ISR患者进行治疗,术后随访发现再次出现ISR的发生率达到36%。以上研究表明,尽管各种治疗方法均取得一定疗效,但是目前仍无彻底解决ISR的有效方法,并且ISR再次治疗后有较高的再狭窄率。本研究随访结果表明再狭窄率为16.67%,与上述报道相似。
采用CBA治疗ISR安全、可靠,并且具有较好的通畅性。但本研究样本量小,随访时间较短,仍需进行大样本、多中心随机对照研究来验证CBA治疗ISR的远期效果。

