甘薯病毒病发生关键因素研究
赵付枚,王爽,田雨婷,乔奇,王永江,张德胜,张振臣
甘薯病毒病发生关键因素研究
赵付枚,王爽,田雨婷,乔奇,王永江,张德胜,张振臣
河南省农业科学院植物保护研究所/河南省农作物病虫害防治重点实验室/农业农村部华北南部作物有害生物综合治理重点实验室,郑州 450002
【】明确甘薯种薯携带的病毒种类与苗期病毒病发生率和严重度之间的关系,以及甘薯田烟粉虱发生量和带毒率与种薯带毒率之间的关系,建立甘薯苗期病毒病预测预报方法和种薯质量早期预警技术,为甘薯无病毒种薯生产和病毒病防控提供理论依据。利用PCR和RT-PCR方法对随机采集的不同来源的甘薯种薯进行病毒检测,检测的病毒种类包括马铃薯Y病毒属()的甘薯羽状斑驳病毒(sweet potato feathery mottle virus,SPFMV)、甘薯病毒C(sweet potato virus C,SPVC)、甘薯病毒G(sweet potato virus G,SPVG)、甘薯潜隐病毒(sweet potato latent virus,SPLV)和甘薯病毒2(sweet potato virus 2,SPV2),毛形病毒属()的甘薯褪绿矮化病毒(sweet potato chlorotic stunt virus,SPCSV)和黄瓜花叶病毒属()的黄瓜花叶病毒(cucumber mosaic virus,CMV)以及甘薯双生病毒(sweepoviruses)等我国甘薯上常见的8类主要病毒。然后对检测的种薯进行育苗,出苗后调查薯苗的发病情况,分析种薯携带的病毒种类与苗期病害严重度之间的关系。2018年和2019年分别在河南、宁夏和陕西等地设置试验点,种植背景相同的甘薯品种商薯19原原种苗和脱毒试管苗,在甘薯生长期,采用黄板诱虫法调查各试验点烟粉虱发生量并采集烟粉虱活体,检测烟粉虱SPCSV带毒率。种薯收获后,随机取样对种薯SPCSV带毒率进行检测,分析甘薯田烟粉虱发生量和带毒率对种薯带毒的影响。在检测的665块甘薯种薯中,有463块种薯携带病毒,育苗后有333块种薯的薯苗表现出叶片黄化、明脉、皱缩和植株矮化等病毒病症状。当种薯携带一种或多种马铃薯Y病毒属病毒时,薯苗病毒病症状主要为0—1级(其中,0级占60.6%;1级占31.8%);当种薯携带甘薯双生病毒或甘薯双生病毒与马铃薯Y病毒属病毒的组合时, 薯苗病毒病症状主要为0—1级(其中,0级占55.3%;1级占32.9%);当种薯携带SPCSV时,苗期病毒病症状显著加重,特别是当种薯同时携带SPCSV与马铃薯Y病毒属病毒时,薯苗显症率为100.0%,症状主要为3—9级(其中,3级和5级占49.0%、7级和9级占51.0%)。连续2年田间试验结果表明,甘薯田烟粉虱发生量和带毒率与种薯带毒率密切相关,回归方程为=9.6281+0.0082+6.537,2=0.914,其中,为种薯SPCSV的带毒率,1为烟粉虱带毒率,2为烟粉虱发生量。种薯携带SPCSV是苗期病毒病严重发生的关键因素,当种薯同时携带SPCSV与马铃薯Y病毒属病毒时,薯苗病毒病显症率和严重度显著增加。甘薯田烟粉虱发生量和SPCSV带毒率与种薯带毒率密切相关,烟粉虱是影响种薯携带SPCSV的关键因素。
甘薯病毒病;种薯;烟粉虱;甘薯褪绿矮化病毒;预测预报
0 引言
【研究意义】甘薯作为重要的粮食、饲料、工业食品原料以及新型能源作物,在世界范围内种植广泛[1]。据FAOSTAT(2018)统计,我国是世界上最大的甘薯生产国,种植面积约占世界甘薯种植面积的50%[2]。病毒病是甘薯上的一类重要病害,是导致甘薯产量降低和种性退化的主要因素之一。甘薯病毒病在世界范围内每年约造成20%—40%的产量损失,在一些非洲国家可达100%[3-4]。据山东、江苏、河南等地的调查结果,我国由病毒病造成的甘薯产量损失一般为20%—30%,严重的可达50%以上[5]。病毒病已成为制约我国甘薯产业健康发展的主要限制因素之一。因此,研究影响甘薯病毒病发生的关键因素,建立预警技术,对于甘薯病毒病的有效防控具有重要意义。【前人研究进展】目前,世界范围内已报道的甘薯病毒有30多种,分属于9个病毒科[2,6]。我国已报道的甘薯病毒至少有20种[2,7-10],主要包括马铃薯Y病毒属()的甘薯羽状斑驳病毒(sweet potato feathery mottle virus,SPFMV)、甘薯病毒C(sweet potato virus C,SPVC)、甘薯病毒G(sweet potato virus G,SPVG)、甘薯潜隐病毒(sweet potato latent virus,SPLV)和甘薯病毒2(sweet potato virus 2,SPV2),毛形病毒属()的甘薯褪绿矮化病毒(sweet potato chlorotic stunt virus,SPCSV),菜豆金色花叶病毒属()的甘薯曲叶病毒(sweet potato leaf curl virus,SPLCV)、甘薯加纳利曲叶病毒(sweet potato leaf curl Canary virus,SPLCCV)、甘薯中国曲叶病毒(sweet potato leaf curl China virus,SPLCCNV)、甘薯乔治亚曲叶病毒(sweet potato leaf curl Georgia virus,SPLCGoV)、甘薯广西曲叶病毒(sweet potato leaf curl Guangxi virus,SPLCGV)、甘薯河南曲叶病毒(sweet potato leaf curl Henan virus,SPLCHnV)、甘薯湖北曲叶病毒(sweet potato leaf curl Hubei virus,SPLCHbV)、甘薯四川曲叶病毒1(sweet potato leaf curl Sichuan virus 1,SPLCSiV-1)、甘薯四川曲叶病毒2(sweet potato leaf curl Sichuan virus 2,SPLCSiV-2)和甘薯山东曲叶病毒(sweet potato leaf curl Shandong virus,SPLCSdV),以及黄瓜花叶病毒属()的黄瓜花叶病毒(cucumber mosaic virus,CMV)等[9,11-13]。侵染甘薯的马铃薯Y病毒属病毒基因组为单链正义RNA[14],主要由蚜虫以非持久方式传播。甘薯上的SPCSV基因组为双组分单链正义RNA,主要通过烟粉虱()以半持久方式传播。侵染甘薯的菜豆金色花叶病毒属病毒与侵染其他植物的菜豆金色花叶病毒属病毒明显不同,把这类病毒称之为“sweepoviruses”[15-16]。Sweepoviruses基因组为单链环状DNA,主要通过烟粉虱以持久方式进行传播。由于甘薯是无性繁殖作物,病毒会通过块根等营养繁殖体进行世代传递[17]。我国大部分甘薯种植区多采用以甘薯的块根作为种薯进行育苗的方式为大田生产提供种苗,苗床期病毒病的发生不仅影响种苗质量和供应,携带病毒的种苗也会成为病毒在田间扩散的主要侵染源[1]。目前对甘薯病毒病的防控主要采用培育和种植脱毒甘薯的方法。脱毒甘薯的培育主要包括茎尖培养、病毒检测、脱毒试管苗快繁以及原原种、原种和良种繁育等环节。脱毒甘薯种薯在繁育过程中,由于烟粉虱等介体昆虫的传毒,会再次感染病毒[18-19]。Ogero等[20]研究表明,防虫网可有效减少甘薯种薯因病毒引起的退化。Adikini等[21]研究显示,SPFMV和SPCSV可以从感病甘薯植株上移动到块根中,导致从块根上萌发的薯苗发病。【本研究切入点】目前,甘薯种薯上携带的病毒种类与苗期病毒病发生之间的关系,以及甘薯田烟粉虱发生量和带毒率与种薯带毒率之间的关系尚不清楚,无法对种薯质量和苗期病毒病发生风险进行早期预警,导致种薯繁育和经营风险较大。【拟解决的关键问题】明确甘薯种薯携带的病毒种类与苗期病毒病发生率和严重度之间的关系,以及田间烟粉虱发生量和带毒率与种薯带毒率之间的关系,建立甘薯苗期病毒病预测预报方法和种薯质量早期预警技术,以期为甘薯无病毒种薯生产和病毒病防控提供技术支撑。
1 材料与方法
1.1 材料
供试甘薯品种为商薯19。Ezup柱式植物基因组DNA抽提试剂盒购自生工生物工程(上海)股份有限公司;植物Total RNA抽提试剂盒(Plant Total RNA Purification Kit)购自GMbiolab公司;cDNA反转录试剂盒(RevertAid Reverse Transcriptase)购自Thermo Scientific公司;烟粉虱Total RNA提取试剂(RNAiso Plus)和Premix Taq购自大连宝生物工程有限公司;PCR产物纯化试剂盒购自美国Omega Bio-tek公司。
1.2 方法
1.2.1 种薯取样及育苗 2017—2018连续2年对保存在薯窖中不同来源的种薯随机取样,将抽取的薯块(种薯)用流水清洗干净、晾干并编号,然后用灭菌的解剖刀在薯块中部取样,挖取大小约为1 cm×1 cm×1 cm的薯皮及其相连的薯肉,用液氮磨成粉状,保存于-70℃超低温冰箱中用于核酸提取及病毒检测。将取样后的种薯在营养钵内育苗,每钵一薯,营养钵编号与薯块编号一一对应,放置于温室中,温室温度为28—30℃,光照16 h·d-1;出苗后调查记载症状类型和病害级别。病毒病严重度分级标准如下:0级:植株无任何病毒病症状;1级:植株部分叶片表现出轻度皱缩或花叶;3级:植株全部或大部分叶片皱缩、黄化或花叶,新叶明脉,植株轻度矮化;5级:植株全株叶片变小、轻度畸形、皱缩、明脉,或伴有黄化症状,植株明显矮化;7级:植株全株叶片变小、明显畸形、皱缩、明脉,或伴有黄化症状,植株严重矮化;9级:植株全株叶片变小、严重畸形、皱缩和明脉,叶片卷曲,植株严重矮化。
1.2.2 引物设计及合成 根据NCBI GenBank中SPFMV、SPVC、SPVG、SPLV、SPV2、CMV、SPCSV和sweepoviruses基因组序列,利用DNAMAN软件进行序列比较,设计上述病毒的特异性检测引物(表1),引物由生工生物工程(上海)股份有限公司合成。
1.2.3 样品核酸提取及病毒检测 种薯总DNA和总RNA分别采用Ezup柱式植物基因组DNA抽提试剂盒和Plant Total RNA Purification Kit进行提取;用灭菌过的牙签将冻存于-70℃冰箱中的烟粉虱分装于液氮预冷的1.5 ml离心管中,每管一头,用灭菌过的塑料离心管研磨棒将样品组织研磨成粉状后,利用RNAiso Plus提取单头烟粉虱总RNA;以上具体操作步骤严格按照各试剂盒所附的说明书进行。核酸浓度和质量通过NanoVue Plus超微量分光光度计进行检测。
采用PCR和RT-PCR方法检测样品中的病毒种类,种薯样品共检测SPFMV、SPVC、SPVG、SPLV、SPV2、CMV、SPCSV和sweepoviruses 8类病毒,烟粉虱样品主要检测SPCSV。对于RNA病毒,先以提取的样品总RNA为模板,利用RevertAid Reverse Transcriptase,采用随机引物或反向引物反转录合成病毒cDNA。以各种病毒的特异性引物(表1)进行PCR反应检测样品的带毒情况。PCR体系20 μL:10 μL 2×Premix TaqTM,正反向引物(5 μmol·L-1)各2 μL,上述合成的cDNA或DNA病毒核酸模板2 μL。PCR反应条件:95℃预变性 5 min;95℃变性30 s,56℃退火30 s,72℃延伸1 min,循环35次;72℃再延伸7 min。用1%的琼脂糖凝胶电泳检测扩增产物,AlphaImager Mini(ProteinSimple,USA)凝胶成像仪观察,记录检测结果。对部分PCR扩增产物进行回收纯化,纯化后的PCR产物委托生工生物工程(上海)股份有限公司直接测序,检测所扩增片段的特异性。

表1 引物序列及扩增片段大小
1.2.4 田间试验方法 (1)供试种苗:2018年试验用种苗为商薯19的脱毒原原种苗,2019年为商薯19的脱毒试管苗。每年3—6月在连栋温室内育苗或进行脱毒试管苗的繁殖,供大田试验用。
(2)田间种植:2018年共在全国设置了3个试验点,包括宁夏银川西夏区试验点(N38°25′55″,E106°02′28″)、河南延津试验点(N35°15′56″,E114°11′57″)和河南原阳试验点(N35°0′35″,E113°42′31″);2019年共在全国设置了7个大田试验点,包括宁夏银川西夏区试验点(N38°25′55″,E106°02′28″)、陕西榆林试验点(N38°29′34″,E109°30′04″)、河南延津试验点(N35°16′27″,E114°12′41″;N35°15′56″,E114°11′57″)、河南温县试验点(N35°01′35″,E113°05′17″)和河南原阳试验点(N35°0′35″,E113°42′31″;N35°0′25″,E113°41′28″)。试验地土质均为沙壤土,每个试验点面积均为666.7 m2左右,6月上旬大田种植,种植密度3 000株/666.7 m2左右,进行常规田间管理。
(3)田间烟粉虱调查方法:利用黄板诱集法调查甘薯田烟粉虱发生量。具体方法为每年的7月上中旬烟粉虱初发生时开始悬挂黄色诱虫板,黄色诱虫板规格为40 cm×25 cm。将黄色诱虫板的下缘高于薯苗5—10 cm进行悬挂,密度为每666.7 m2安插20块诱虫板,每10 d调查一次,记录每块诱虫板上诱集的烟粉虱数量(头/黄板),并更换新的诱虫板。
(4)烟粉虱活体采集和带毒率检测:调查甘薯田烟粉虱数量的同时,采集烟粉虱活体用于检测烟粉虱带毒率。方法为利用一次性塑料餐盒,在试验田随机采样,一只手拿着餐盒,另一只手拿着盒盖轻拍叶片,迅速捕捉飞起的烟粉虱,将烟粉虱带回实验室置于-70℃保存备用。烟粉虱样品的病毒检测方法同1.2.3。每个试验点每次检测100头烟粉虱。烟粉虱的带毒率(%)= PCR阳性烟粉虱头数/检测总头数×100。
(5)种薯收获及病毒检测:每年的10月上旬分别将上述各试验点的种薯收获,收获后,每个试验点随机抽取100块种薯,分别用解剖刀挖取薯块中部部分薯皮及其相连的薯肉,用液氮磨成粉状,保存于-70℃超低温冰箱中用于核酸提取。种薯样品的病毒检测方法同1.2.3。种薯的带毒率(%)= PCR阳性种薯块数/检测总块数×100。
1.2.5 数据统计分析 采用SPSS 17.0统计学软件的相关分析功能对烟粉虱发生量和带毒率与种薯带毒率之间的关系进行统计分析。
2 结果
2.1 甘薯种薯带毒情况分析
对随机抽取不同来源的665块种薯进行了病毒检测。结果表明,665块种薯中共有463块种薯携带病毒,带毒率为69.6%。其中,SPCSV的检出率最高,为48.1%;sweepoviruses、SPFMV、SPVG、SPLV、SPV2、SPVC和CMV的检出率分别为23.2%、28.7%、3.6%、2.1%、1.8%、9.3%和0.6%(表2)。检测结果表明,病毒复合侵染种薯的现象很普遍,665块种薯中共有218块种薯检测到2种或2种以上目标病毒,病毒复合侵染率达32.8%。
2.2 甘薯种薯带毒种类与苗期病毒病显症率和严重度之间的关系
种薯带毒种类与苗期病毒病显症率和严重度之间的关系见表3。463块带毒种薯育苗后有333块薯苗表现叶片黄化、明脉、皱缩和植株矮化等病毒病症状,带毒种薯病毒病显症率为71.9%。进一步分析发现,当种薯携带一种或多种马铃薯Y病毒属病毒时,薯苗主要表现0—1级症状(其中0级占60.6%;1级占31.8%);当种薯携带sweepoviruses或sweepoviruses与马铃薯Y病毒属病毒的组合时,薯苗症状主要表现为0—1级(其中,0级占55.3%,1级占32.9%);当种薯携带SPCSV时,苗期病毒病症状显著加重,无症薯苗较少,3级以上重症薯苗显著增加,特别是当种薯携带SPCSV与马铃薯Y病毒属病毒的组合时,薯苗显症率为100.0%,症状主要为3—9级(其中,3—5级占49.0%、7—9级占51.0%),说明种薯携带SPCSV是甘薯苗期病毒病严重显症的关键因素。
2.3 甘薯田烟粉虱发生量和SPCSV带毒率与种薯SPCSV带毒率之间的关系
2018年利用背景相同的脱毒甘薯原原种苗在全国3个试验点进行了试验,结果表明,原阳和延津2个试验点的烟粉虱发生量较高,平均每块黄板上的烟粉虱数量分别为276.2头和376.8头,烟粉虱SPCSV带毒率分别为3.0%和4.0%,其对应的种薯SPCSV带毒率也较高,分别为30.4%和47.7%;宁夏银川试验点平均每块黄板上的烟粉虱数量为80.6头,烟粉虱中未检出病毒,其对应的种薯SPCSV带毒率为14.8%(表4)。
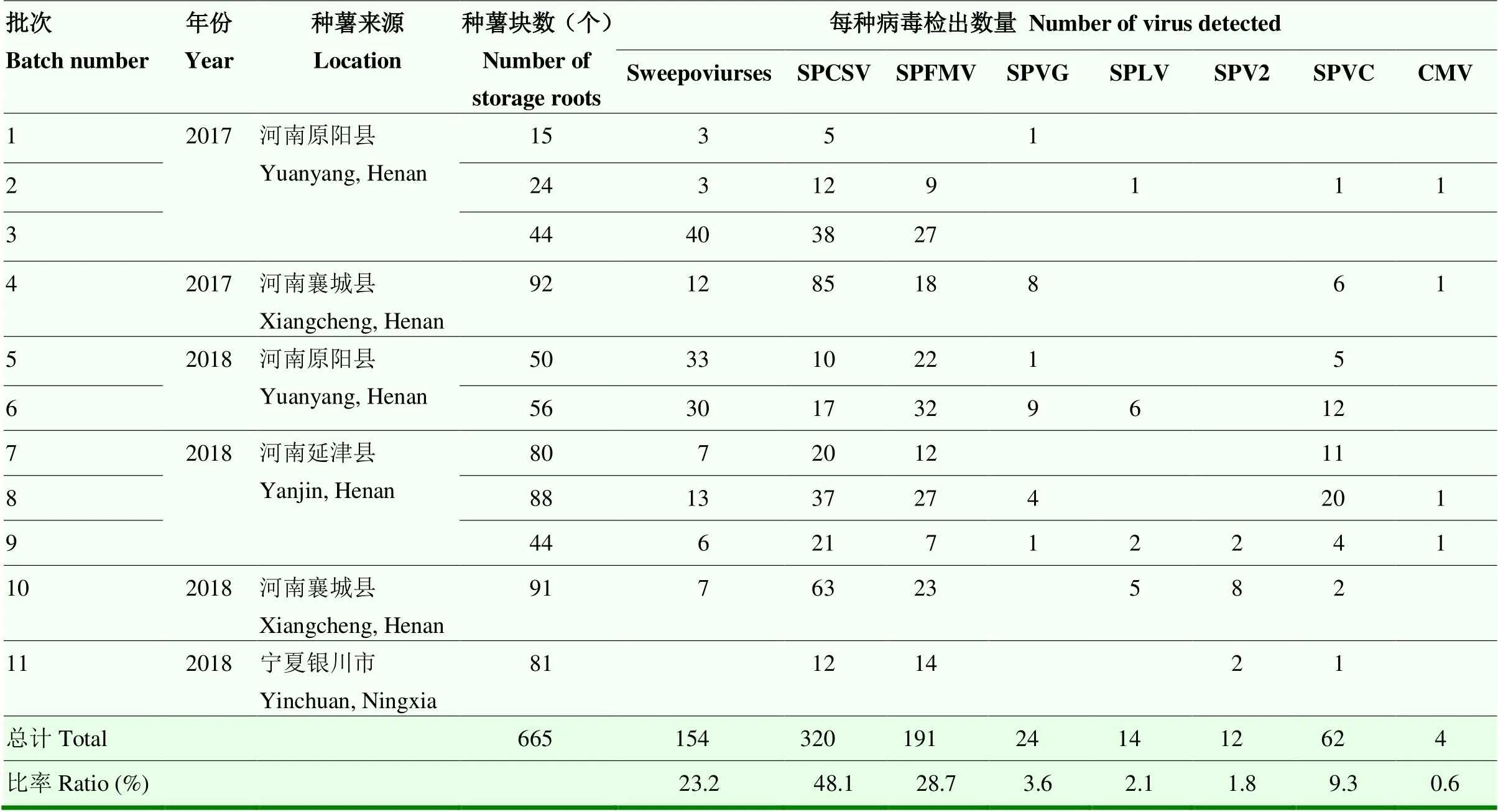
表2 种薯甘薯病毒PCR 和RT-PCR检测
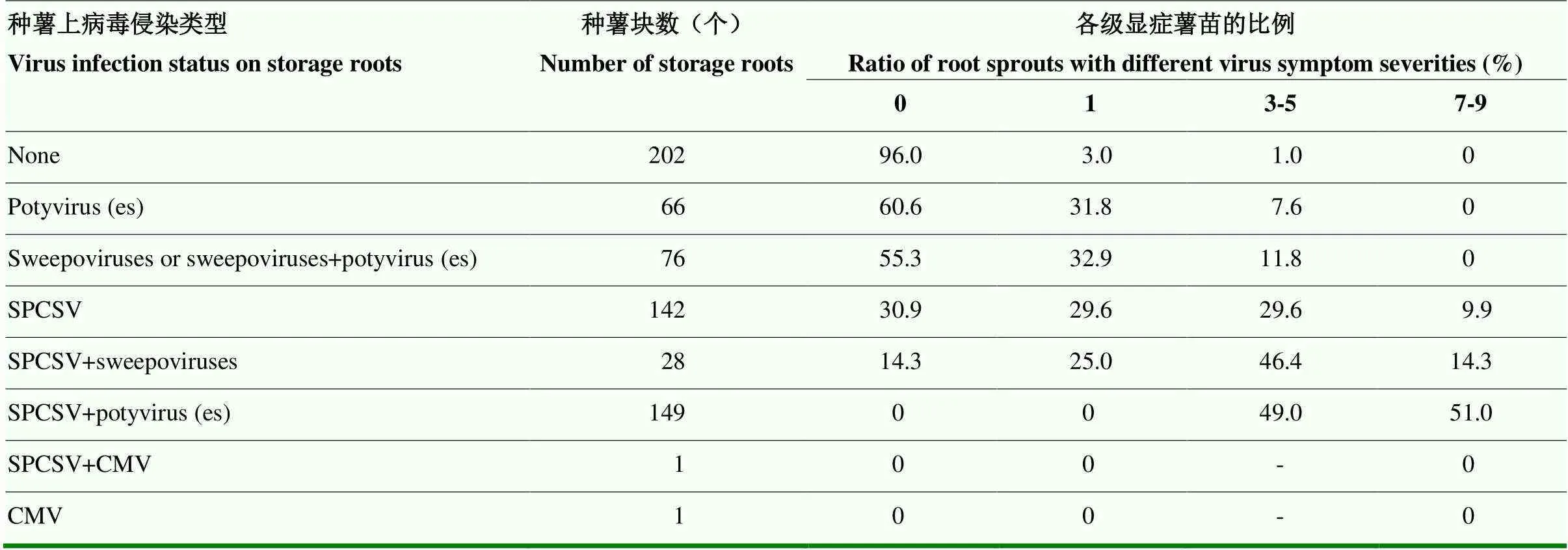
表3 种薯带毒种类与薯苗病毒病严重度之间关系
2019年利用背景相同的脱毒甘薯试管苗在全国7个试验点进行了试验,结果表明,2019年烟粉虱在河南省严重发生,河南的原阳、温县和延津共5个试验点在甘薯生长前期(8月9日)、中期(8月29日)和后期(9月27日)的虫口密度一直较高,例如,原阳试验点(试验点1)8月29日调查的平均每块黄板上的烟粉虱数量达到了5 461.2头。5个试验点烟粉虱平均带毒率也较高,介于2.3%—8.0%,其相应的种薯SPCSV带毒率也较高,介于38.0%—96.0%;宁夏银川试验点只在甘薯生长中期有少量烟粉虱发生,8月29日调查的平均每块黄板上的烟粉虱数量仅为537.2头,烟粉虱中未检出病毒,其相应的种薯SPCSV带毒率也较低,仅为10.0%;陕西榆林试验点在甘薯整个生育期均未发现烟粉虱的发生,其相应的种薯上也未检出SPCSV,种薯带毒率为0(表5)。
以上2年试验结果表明,甘薯田烟粉虱发生量和带毒率与种薯带毒率密切相关。根据甘薯田烟粉虱发生量和烟粉虱带毒率与种薯带毒率之间的关系,利用SPSS统计软件进行多元线性回归分析,甘薯田烟粉虱发生量和烟粉虱带毒率与种薯带毒率之间的关系为:=9.6281+0.0082+6.537,2=0.914,其中,为种薯SPCSV的带毒率,1为烟粉虱带毒率,2为烟粉虱发生量(头/黄板)。
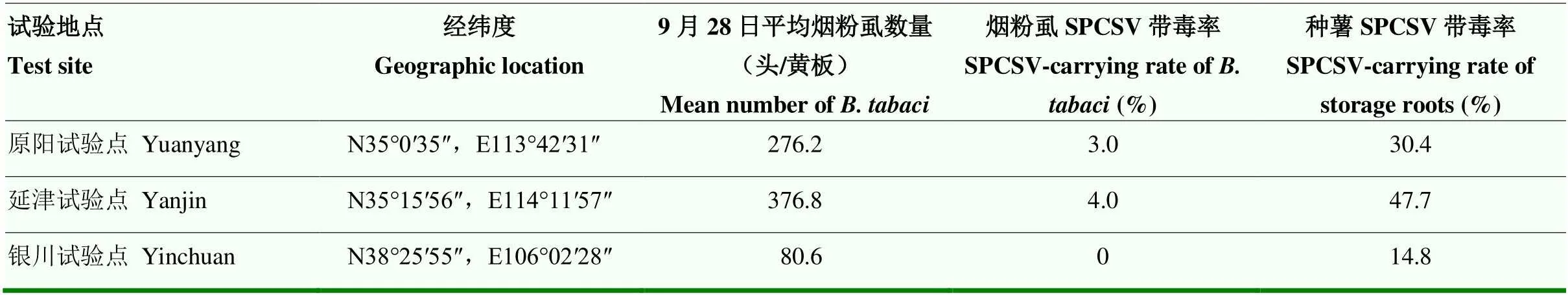
表4 2018年田间烟粉虱发生量和SPCSV带毒率与种薯带毒率之间的关系
3 讨论
本研究通过对甘薯种薯带毒种类的分析,明确了甘薯种薯带毒种类与薯苗病毒病发生之间的关系,发现种薯携带SPCSV是甘薯苗期病毒病严重发生的关键因素。据此可通过对种薯带毒情况的检测,预测苗期病毒病的发生率和严重度,对病毒病发生风险进行评估,及时对存在较大风险的种薯进行质量管控,不仅可以达到防控甘薯病毒病的目的,也可有效降低种薯繁育和经营风险。烟粉虱是传播SPCSV的主要介体昆虫,为了明确甘薯田烟粉虱对种薯带毒的影响,本研究通过在全国烟粉虱发生量不同的地区设置试验点,明确了甘薯田烟粉虱发生量和带毒率与种薯带毒率之间的关联性,根据二者之间的关系,可以在种薯繁育过程中根据繁种田烟粉虱发生量和带毒率对种薯感染SPCSV的风险进行预测,以便及时采取措施减少SPCSV感染种薯,达到防止甘薯病毒病发生和流行的目的。
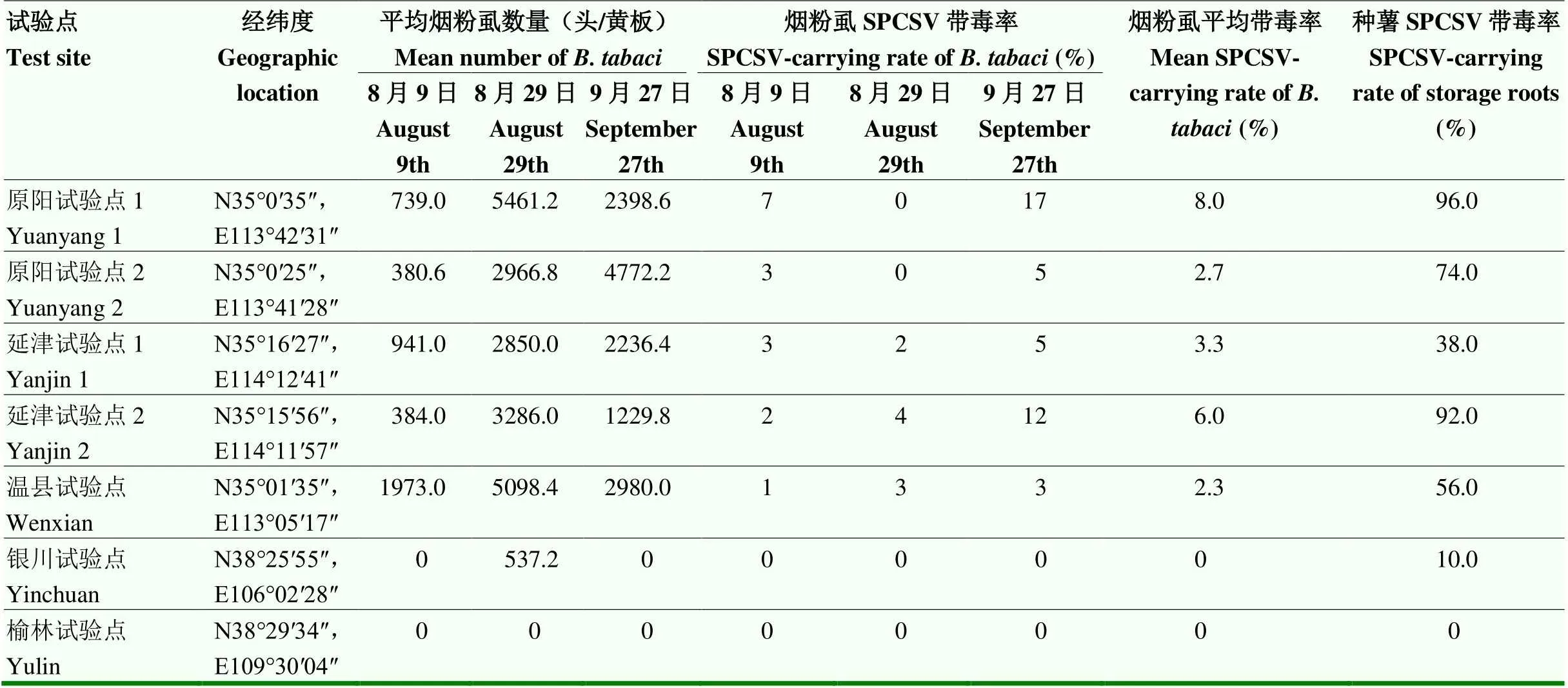
表5 2019年田间烟粉虱发生量和SPCSV带毒率与种薯带毒率之间的关系
已有报道表明,SPCSV可与马铃薯Y病毒属、菜豆金色花叶病毒属等多个属的病毒发生协生作用[22-23]。Karyeija[24]等研究表明,当SPCSV与SPFMV复合侵染甘薯植株时,SPFMV的含量比SPFMV单独侵染时增加600倍。SPCSV与SPFMV协生共侵染会引起甘薯复合病毒病(sweet potato virus disease,SPVD)的发生,导致甘薯严重减产。本研究结果显示,当甘薯种薯同时携带SPCSV与SPFMV、SPVC、SPVG、SPLV、SPV2等马铃薯Y病毒属病毒时,育苗后薯苗的病毒病严重度会显著增加,薯苗全部显症,而且症状严重度均为3级以上。当种薯同时携带SPCSV和sweepoviruses时,薯苗显症率和严重度均有所增加,症状严重度在3级以上的薯苗达60.7%,说明SPCSV与马铃薯Y病毒属和sweepoviruses病毒发生了协生作用,但SPCSV与马铃薯Y病毒属和sweepoviruses病毒在种薯内相互作用的机制还不清楚,有待进一步研究。
本研究从不同来源的种薯上检测到了8类甘薯主要病毒,而且多种病毒复合侵染现象非常普遍,说明种薯是甘薯病毒良好的储备库和主要的侵染源。带毒种薯育苗引起苗期发病,病苗移栽到大田后形成发病中心,然后通过烟粉虱等介体昆虫进行田间传播,形成新一代种薯带毒,带毒种薯引起第二年春季育苗期发病。据此可提出甘薯病毒病的病害循环特征,即甘薯病毒在种薯-薯苗-大田植株-种薯间循环传播。因此,甘薯病毒病的防控策略除了培育无病毒种薯外,还需加强苗期病毒病的识别,发现疑似病株及时拔除销毁,防止病苗栽入大田,可有效减少大田病毒病的发生和传播。
近年来烟粉虱的大发生和粉虱传甘薯病毒的增多给无病毒种薯的繁育带来严峻挑战。烟粉虱作为我国重要农业害虫[25],近10年来其发生呈现出新的特点,烟粉虱MED隐种(Mediterranean,MED)由于能快速产生抗药性及较强的竞争力而逐渐取代MEAM1隐种(Middle East-AsiaMinor1,MEAM1)成为田间优势种群[26-29],烟粉虱MED隐种的获毒和持毒能力高于烟粉虱MEAM1隐种[30]。虽然有报道防虫网可有效减少甘薯种薯因病毒引起的退化[19],但防虫网内烟粉虱的防治仍是一个难题。目前国内外在减少马铃薯种薯的病毒感染方面有比较成功的经验,一个典型的例子就是在英国实施的马铃薯证书计划,几十年来,该计划使马铃薯产量增长了2—3倍,其产量的增长主要归功于将马铃薯无病毒种薯的繁育在不利于蚜虫早期迁移和繁殖的苏格兰部分地区进行,使病毒感染率下降[31]。我国马铃薯种薯的繁育也多在西北和东北等冷凉地区进行[32-33]。因此,甘薯无病毒种薯的繁育可借鉴马铃薯的经验。李爱贤等[34]尝试在陕西榆林等冷凉地区繁育无病毒甘薯种薯,发现在陕西榆林地区繁育的种薯苗期病毒病发病率明显低于内陆地区的种苗,据此提出了甘薯种薯“东种西繁”的模式。但由于受甘薯生长特性、繁种成本以及烟粉虱北移等因素的影响,甘薯无病毒种薯繁育模式仍需进一步探索。
4 结论
种薯携带SPCSV是苗期病毒病严重发生的关键因素,当种薯同时携带SPCSV与马铃薯Y病毒属病毒时,薯苗病毒病显症率和严重度显著增加。甘薯田烟粉虱发生量和SPCSV带毒率与种薯带毒率密切相关,烟粉虱是影响种薯携带SPCSV的关键因素。
[1] CLARK C A, DAVIS J A, ABAD J A, CUELLAR W J, FUENTES S, KREUZE J F, GIBSON R W, MUKASA S B, TUGUME A K, TAIRO F D, VALKONEN J P T. Sweetpotato viruses: 15 years of progress on understanding and managing complex diseases. Plant Disease, 2012, 96(2): 168-185.
[2] FAOSTAT. Food and Agricultural Data. [2020-11-23]. http://www. fao.org/faostat/en/#data/QC/visualize.
[3] GU Y H, TAO X, LAI X J, WANG H Y, ZHANG Y Z. Exploring the polyadenylated RNA virome of sweet potato through high-throughput sequencing. PloS one, 2014, 9(6): e98884.
[4] WANJALA B W, ATEKA E M, MIANO D W, LOW J W, KREUZE J F. Storage root yield of sweetpotato as influenced by sweetpotato leaf curl virus and its interaction with sweetpotato feathery mottle virus and sweetpotato chlorotic stunt virus in Kenya. Plant Disease, 2020, 104(5): 1477-1486.
[5] 王林生, 马晓玉. 甘薯脱毒技术的研究与应用. 种子, 2005, 24(10): 51-53.
WANG L S, MA X Y. Research and application of virus-free technique on sweet potato. Seed, 2005, 24(10): 51-53. (in Chinese)
[6] JO Y, KIM S M, CHOI H, YANG J W, LEE B C, CHO W K.Sweet potato viromes in eight different geographical regions in Korea and two different cultivars. Scientific Reports, 2020, 10: 2588.
[7] 黄利利, BINHDAN P, 何芳练, 刘奕君, 刘义明, 陈保善, 廖咏梅. 广西甘薯病毒病的病原病毒种类检测. 基因组学与应用生物学, 2016, 35(5): 1213-1218.
HUANG L L, BINHDAN P, HE F L, LIU Y J, LIU Y M, CHEN B S, LIAO Y M. The pathogenic virus species detection of sweet potato viral diseases in Guangxi. Genomics and Applied Biology, 2016, 35(5): 1213-1218. (in Chinese)
[8] 李华伟, 刘中华, 张鸿, 李国良, 林赵淼, 邱思鑫. 福建甘薯病毒病病原鉴定及主要病毒多样性. 微生物学通报, 2019, 46(12): 3267-3277.
LI W H, LIU Z H, ZHANG H, LI G L, LIN Z M, QIU S X. Identification and genetic diversity analysis of sweet potato virus in Fujian Province. Microbiology China, 2019, 46(12): 3267-3277. (in Chinese)
[9] LIU Q L, WANG Y J, ZHANG Z C, LV H, QIAO Q, QIN Y H, ZHANG D S, TIAN Y T, WANG S, LI J Q. Diversity of sweepoviruses infecting sweet potato in China. Plant disease, 2017, 101(12): 2098-2103.
[10] MA S, ZHENG Q, YE J, FENG W, ZHOU G, ZHANG T. Identification of viruses infecting sweet potato in southern China by small RNA deep sequencing and PCR detection. Journal of general plant pathology, 2019, 85(2): 122-127.
[11] 姜珊珊, 谢礼, 吴斌, 辛相启, 陈剑平, 赵玖华. 山东甘薯主要病毒的鉴定及多样性分析. 植物保护学报, 2017, 44(1): 93-102.
JIANG S S, XIE L, WU B, XIN X Q, CHEN J P, ZHAO J H. Identification and genetic diversity analysis on sweet potato viruses in Shandong Province. Journal of Plant Protection, 2017, 44(1): 93-102. (in Chinese)
[12] 乔奇, 张振臣, 张德胜, 秦艳红, 田雨婷, 王永江. 中国甘薯病毒种类的血清学和分子检测. 植物病理学报, 2012, 42(1): 10-16.
QIAO Q, ZHANG Z C, ZHANG D S, QIN Y H, TIAN Y T, WANG Y J. Serological and molecular detection of viruses infecting sweet potato in China. Acta Phytopathologica Sinica, 2012, 42(1): 10-16. (in Chinese)
[13] XIE Y P, XING J Y, LI X Y, WANG X, SUN H J, ZHAO Y Q, ZHANG C L, MA D F. Survey of sweetpotato viruses in China. Acta virologica, 2013, 57(1): 81-84.
[14] 秦艳红, 王永江, 王爽, 乔奇, 田雨婷, 张德胜, 张振臣. 甘薯羽状斑驳病毒O株系和RC株系中国分离物全基因组序列分析及其遗传特征. 中国农业科学, 2020, 53(11): 2207-2218.
QIN Y H, WANG Y J, WANG S, QIAO Q, TIAN Y T, ZHANG D S, ZHANG Z C. Complete nucleotide sequence analysis and genetic characterization of the sweet potato feathery mottle virus O and RC strains isolated from China. Scientia Agricultura Sinica, 2020, 53(11): 2207-2218. (in Chinese)
[15] FAUQUET C M, STANLEY J. Geminivirus classification and nomenclature: progress and problems. Annals of Applied Biology, 2003, 142(2): 165-189.
[16] ZERBINI F M, BRIDDON R W, IDRIS A, MARTIN D P, MORIONES E, NAVAS-CASTILLOJ, RIVERA-BUSTAMANTE R, ROUMAGNAC P, VARSANI A. ICTV virus taxonomy profile:. Journal of General Virology, 2017, 98(2): 131-133.
[17] VALVERDE R A, CLARK C A, VALKONEN J P T. Viruses and virus disease complexes of sweetpotato. Plant Viruses, 2007, 1(1): 116-126.
[18] GAO F, GONG Y, ZHANG P. Production and deployment of virus-free sweetpotato in China. Crop Protection, 2000, 19(2): 105-111.
[19] 张振臣. 我国甘薯脱毒种薯种苗繁育存在的问题及建议. 植物保护, 2020, 46(6): 10-13.
ZHANG Z C. Problems and suggestions for breeding of virus-free sweet potato seed in China. Plant Protection, 2020, 46(6): 10-13. (in Chinese)
[20] OGERO K O, KREUZE J F, MCEWAN M A, LUAMBANO N D, BACHWENKIZI H, GARRETT K A, ANDERSEN K F, THOMAS- SHARMA S, VAN DER VLUGT R A A. Efficiency of insect-proof net tunnels in reducing virus-related seed degeneration in sweet potato. Plant Pathology, 2019, 68(8): 1472-1480.
[21] ADIKINI S, MUKASA S B, MWANGA R O M, GIBSON R W. Virus movement from infected sweetpotato vines to roots and reversion on root sprouts. HortScience, 2019, 54(1): 117-124.
[22] UNTIVEROS M, FUENTES S, SALAZAR L F. Synergistic interaction of sweet potato chlorotic stunt virus () with carla-, cucumo-, ipomo-, and potyviruses infecting sweet potato. Plant disease, 2007, 91(6): 669-676.
[23] CUELLAR W J, GALVEZ M, FUENTES S, TUGUME J, KREUZE J. Synergistic interactions of begomoviruses with sweet potato chlorotic stunt virus (genus) in sweet potato (L.). Molecular Plant Pathology, 2015, 16(5): 459-471.
[24] KARYEIJA R F, GIBSON R W, VALKONEN J P T. The significance of sweet potato feathery mottle virus in subsistence sweet potato production in Africa. Plant disease, 1998, 82(1): 4-15.
[25] 褚栋, 张友军. 近10年我国烟粉虱发生为害及防治研究进展. 植物保护, 2018, 44(5): 51-55.
CHU D, ZHANG Y J. Research progress on the damages and management of(Gennadius) in China over the past 10 years. Plant Protection, 2018, 44(5): 51-55. (in Chinese)
[26] CHU D, WAN F H, ZHANG Y J, BROWN J K. Change in the biotype composition ofin Shandong Province of China from 2005 to 2008. Environmental Entomology, 2010, 39(3): 1028-1036.
[27] JIU M, HU J, WANG L J, DONG J F, SONG Y Q, SUN H Z. Cryptic species identification and composition of(Hemiptera: Aleyrodidae) complex in Henan Province, China. Journal of Insect Science, 2017, 17(3): 78.
[28] WANG Z, YAN H, YANG Y, WU Y. Biotype and insecticide resistance status of the whiteflyfrom China. Pest Management Science, 2010, 66(12): 1360-1366.
[29] YUAN L, WANG S, ZHOU J, DU Y, ZHANG Y, WANG J. Status of insecticide resistance and associated mutations in Q-biotype of whitefly,, from eastern China. Crop Protection, 2012, 31(1): 67-71.
[30] PAN H, CHU D, YAN W, SU Q, LIU B, WANG S, WU Q, XIE W, JIAO X, LI R, YANG N, YANG X, XU B, BROWN J K, ZHOU X, ZHANG Y. Rapid spread of tomato yellow leaf curl virus in China is aided differentially by two invasive whiteflies. PLoS One, 2012, 7(4): e34817.
[31] 赫尔 R. 马修斯植物病毒学. 4版. 范在丰, 李怀方, 韩成贵, 李大伟, 译. 北京: 科学出版社,2007: 746.
Hull R. Matthews’ Plant Virology. 4th eds. FAN Z F, LI H F, HAN C G, LI D W, trans. Beijing: Science Press, 2007: 746. (in Chinese)
[32] 仲乃琴, 蔡冬清, 赵盼. 我国高原马铃薯种薯产业发展与精准扶贫. 中国科学院院刊, 2020, 35(10): 1308-1313.
ZHONG N Q, CAI D Q, ZHAO P. Development of potato seed industry and targeted poverty alleviation in plateau of China. Bulletin of Chinese Academy of Sciences, 2020, 35(10): 1308-1313. (in Chinese)
[33] 范宏伟, 宋雄儒, 魏兴国. 河西走廊沿山冷凉灌区马铃薯品种比较试验. 中国马铃薯, 2015, 29(2): 71-74.
FAN H W, SONG X R, WEI X G. Comparative trial of potato varieties in cold irrigated area in Hexi corridor. Chinese Potato Journal, 2015, 29(2): 71-74. (in Chinese)
[34] 李爱贤, 张立明, 王庆美, 王登良, 解备涛, 秦桢, 候夫云, 董顺旭. “东种西繁”种薯繁育模式对甘薯病毒病发生的影响. 山东农业科学, 2019, 51(12): 87-90.
LI A X, ZHANG L M, WANG Q M, WANG D L, XIE B T, QIN Z, HOU F Y, DONG S X. Effect of root seeds of east breeding in west China on occurrence of sweet potato virus disease. Shandong Agricultural Sciences, 2019, 51(12): 87-90. (in Chinese)
An investigation into key factors influencing the occurrence of virus disease in sweet potato
ZHAO Fumei,WANG Shuang, TIAN Yuting, QIAO Qi, WANG Yongjiang, ZHANG Desheng, ZHANG Zhenchen
Institute of Plant Protection, Henan Academy of Agricultural Sciences/Henan Key Laboratory of Crop Pest Control/IPM Key Laboratory in Southern Part of North China, Ministry of Agriculture and Rural Affairs, Zhengzhou 450002
【】This study aimed to clarify the relationship between sweet potato virus types in storage roots and virus incidence and severity on root sprouts, and the relationship between numbers and SPCSV-carrying rate ofand SPCSV-carrying rate of storage roots, establish the prediction method and early warning technology for viral disease in sweet potato seedlings, so as to provide the theoretical basis for virus-free storage root production, and prevention and control of virus disease in sweet potato.【】PCR and RT-PCR were performed to detect eight major sweet potato viruses including sweet potato feathery mottle virus(SPFMV), sweet potato virus C (SPVC), sweet potato virus G (SPVG), sweet potato latent virus(SPLV) and sweet potato virus 2 (SPV2) in the genus of, sweet potato chlorotic stunt virus (SPCSV) in the genus of, cucumber mosaic virus (CMV) in the genus of,and sweepoviruses in the genus ofin China in storage roots collected from different sources. The PCR-detected roots were planted in plastic pots and allowed to sprout under greenhouse conditions. The types and severity scores of viral symptoms on root sprouts were surveyed and recorded to analyze the relationship between virus species in roots and virus symptom severity on root sprouts. Virus-eliminated sweet potato cultivar Shangshu 19 (S19) plants with the same source were cultivated in the different locations in Henan, Ningxia and Shaanxi in 2018 and 2019. The number ofin each test site was calculated by using yellow sticky traps, and was sampled for SPCSV detection during the growth period of sweet potato. The roots selected randomly from each test site were used for SPCSV detection after harvesting to analyze the relationship between numbers and SPCSV-carrying rate ofand SPCSV-carrying rate of storage roots.【】Of the 665 storage roots, 463 were infected with one or more of the eight viruses. After root sprouting, visual symptoms, such as leaf chlorosis, vein-clearing, rugosity and stunting were observed on the 333 root sprouts. Virus severity scores on root sprouts ranged from 0 to 1 (60.6% for score of 0 and 31.8% for score of 1) when roots were infected with potyvirus (es). Virus severity scores on root sprouts ranged from 0 to 1 (55.3% for score of 0 and 32.9% for score of 1) when roots were infected with sweepoviruses or co-infected with sweepoviruses and potyvirus (es). Root sprouts were observed with more severe symptoms when roots carried SPCSV, especially the combination of SPCSV and potyvirus (es), which caused visible symptoms on all sprouts with severity scores from 3 to 9 (49.0% for scores of 3 and 5, 51.0% for scores of 7 and 9). Results from two successive years field trial revealed that there was a positive correlation between SPCSV-carrying rate (1) and numbers (2) ofand SPCSV-carrying rate () of storage roots, and the equation of linear regression was=9.6281+0.0082+6.537,2=0.914.【】Storage root carrying SPCSV is the key factor for serious occurrence of sweet potato viruses at seedling stage. Viral symptom appearance rate and severity scores increase significantly when roots are co-infected with SPCSV and potyvirus (es). There is a positive correlation between SPCSV-carrying rate and numbers ofand SPCSV-carrying rate of storage roots, indicating thatisthe key factor influencing the SPCSV-carrying rate of storage root.
virus disease of sweet potato; storage root;; sweet potato chlorotic stunt virus (SPCSV); forecast

10.3864/j.issn.0578-1752.2021.15.008
2020-11-25;
2021-02-07
国家甘薯产业技术体系建设专项(CARS-10-B13)、河南省农业科学院优秀青年科技基金(2020YQ23)
赵付枚,E-mail:woshifumei@163.com。通信作者张振臣,E-mail:zhangzhenchen@126.com
(责任编辑 岳梅)

