桃若干重要性状的KASP分子标记开发与应用
孟君仁,曾文芳,邓丽,潘磊,鲁振华,崔国朝,王志强,牛良
桃若干重要性状的KASP分子标记开发与应用
孟君仁,曾文芳,邓丽,潘磊,鲁振华,崔国朝,王志强,牛良
中国农业科学院郑州果树研究所/国家桃葡萄改良中心/农业部果树育种技术重点实验室,郑州 450009
【】开发一系列高通量、低成本的桃重要性状竞争性等位基因特异PCR(Kompetitive Allele Specific PCR,KASP)标记,包括果皮有毛/无毛、果形扁平/圆形、果肉硬质/非硬质、DBF(Dominant Blood Flesh)红肉/非红肉、抗/感蚜等5对性状,加速桃优良品种培育,缩短桃育种年限。本研究在控制这些性状的候选基因及位点附近300 kb内,利用已有桃种质资源的基因组序列比对,开发KASP标记,对已知表型的桃种质材料进行基因分型验证,最终获得与目标性状紧密连锁的KASP标记。利用开发的5个性状的KASP分子标记对桃杂交分离群体和自然群体进行基因型检测,结果表明,标记鉴定结果与已知表型完全一致,准确率为100%。其中,杂交群体中果皮有毛/无毛性状分离比例为30﹕30,果形扁平/圆形分离比例为31﹕29,果实硬质/非硬质分离比例为27﹕26,抗蚜/感蚜分离比例为49﹕46,均符合孟德尔遗传1﹕1的分离定律。开发的KASP标记可高效检测桃果实外观、抗性、肉质等重要性状相关基因的等位变异,在基因型鉴定、亲本选配和杂种后代的分子标记辅助选择中有很好的应用前景。
桃;KASP;分子标记辅助选择;育种
0 引言
【研究意义】果树童期长[1],且以果实为生产目的,育种中很多重要表型的观测评价都需要等到开花结果之后,这导致育种周期长,效率低下;同时,果树杂种实生苗田间定植需占用大量土地,管理成本高,也限制了育种规模的扩大。现代分子生物学技术的发展实现了可以利用与相关性状紧密连锁的分子标记来进行亲本选择或对杂种后代进行预先筛选,提高育种效率[2-3]。KASP标记可使分子检测的可视化程度大幅提升,实现高通量、低成本应用,推动分子育种的发展。【前人研究进展】桃()是原产于我国的世界性重要落叶果树[4],属于蔷薇科(Rasaceae)李属(),因其染色体数目少(2n=16)、基因组较小(约227 Mb)、童期短,成为蔷薇科果树遗传规律研究的模式植物[5]。桃很多性状的遗传均已有报道,桃果皮有毛/无毛()[6]、果形扁平/圆形()[7]、抗桃绿蚜/感蚜()[8]、红肉/非红肉()[9]、硬质/非硬质()[10]均为单基因控制的质量性状,除硬质为隐性外,其余4个性状均为显性遗传。近年来,随着桃参考基因组测序的完成[11],研究人员对很多重要性状进行了定位,并开发了相关性状的分子标记[12]。VENDRAMIN等[6]根据杂交群体毛桃品种‘Contender’×油桃品种‘Ambra’F2代的连锁分析,将桃有毛/无毛性状G位点的位置定位在第5条染色体1.1 cM(635 kb)的区间内。CAO等[13]对84份桃/油桃种质资源进行全基因组重测序,利用全基因组关联分析(genome-wide association study,GWAS)的手段,最终确定是桃果实表皮毛形成的候选基因。冯建灿等[14]开发的IndelG标记能有效地区分桃和油桃,为桃育种早期苗期的表型鉴定提供了有效工具。MICHELETTI等[15]认为扁平的桃果实形状是由一个显性等位基因介导的杂合性引起,定位在LG6的末端。郭健[16]在果形关联分析研究的基础上,结合二代测序手段,对果形紧密连锁的位点Chr:25060196(Prunus_persica V1.0)进行验证,并开发出1个ASPCR分子标记,在‘大久保’与‘油蟠1-3’杂交群体中进行验证,准确率为100%。SHEN等[9]对中国特色红肉桃品种‘五月鲜’进行红肉性状遗传规律研究时发现,红肉由显性单基因()控制,将其定位在第5连锁群的上端。ZHOU等[17]也将DBF型红肉性状定于第5号连锁群顶端约200 kb的区间,结合比较转录组学研究发掘了一个控制血桃的候选基因,该基因属于编码NAC蛋白的转录因子。PAN等[18]通过非硬质桃和硬质桃的对比,筛选出一个生长素合成路径的限速酶基因(类黄素单加氧酶基因),对该基因及其启动子区多态性位点的分析发现,其内含子中的SSR位点可以准确区分品种的基因型是否属于硬质类型。牛良等[19]利用寿星桃及其抗性后代构建遗传分离群体,对其抗性表现及遗传进行了鉴定,最终将寿星桃抗蚜性状定位于45.676—45.837 Mb,物理距离160 kb,受单基因控制,显性遗传,未开发相关分子标记。竞争性等位基因特异PCR技术是基于引物末端碱基的特异匹配来对单核苷酸多态性(single nucleotide polymorphisms,SNPs)及插入和缺失(insertions and deletions,InDels)进行高通量基因分型的方法,由LGC(Laboratory of the Government Chemist)公司(http://www.lgcgroup.com/)设计和创制,具有通量高、成本低、准确度高等优点。KASP分子标记已经成为新一代的SNP分型标记,在水稻[20-21]、小麦[22]、油菜[23]等作物的基因精细定位、分子标记辅助选择育种(Marker Assisted Selection,MAS)、种质资源鉴定等方面被广泛应用。但目前KASP标记在桃育种上的应用还鲜有报道。【本研究切入点】尽管已有很多关于控制桃主要质量性状的功能基因研究,但仍缺少能够利用到育种中的快速高效、低成本的分子标记。【拟解决的关键问题】基于控制桃果皮有毛/无毛、果形扁平/圆形、果肉硬质/非硬质、DBF红肉/非红肉、Rm3抗蚜/感蚜等5对重要农艺性状的等位基因位点及附近300 kb的SNP变异,开发设计KASP标记,对自然群体及杂交群体进行基因分型验证,为利用KASP标记进行桃亲本选配和杂种后代的早期选择提供支持,加快桃育种选择进程,提高育种效率。
1 材料与方法
1.1 植物材料
30份桃种质资源和2个桃杂交群体,均来源于中国农业科学院郑州果树研究所桃育种圃,桃种质资源即自然群体材料名称及表型见表1;杂交群体见表2。其中杂交群体1母本为‘中油20号’(果皮无毛、果实圆形、白肉、硬质、感蚜),父本为‘01-77-4’(果皮有毛、果实扁平、白肉、抗蚜);杂交群体2母本为‘中油20号’,父本为‘10新25-8’(果皮有毛、果实圆形、红肉、溶质)。2020年4月采集幼嫩叶片,液氮速冻后置于-80℃保存,提DNA备用。
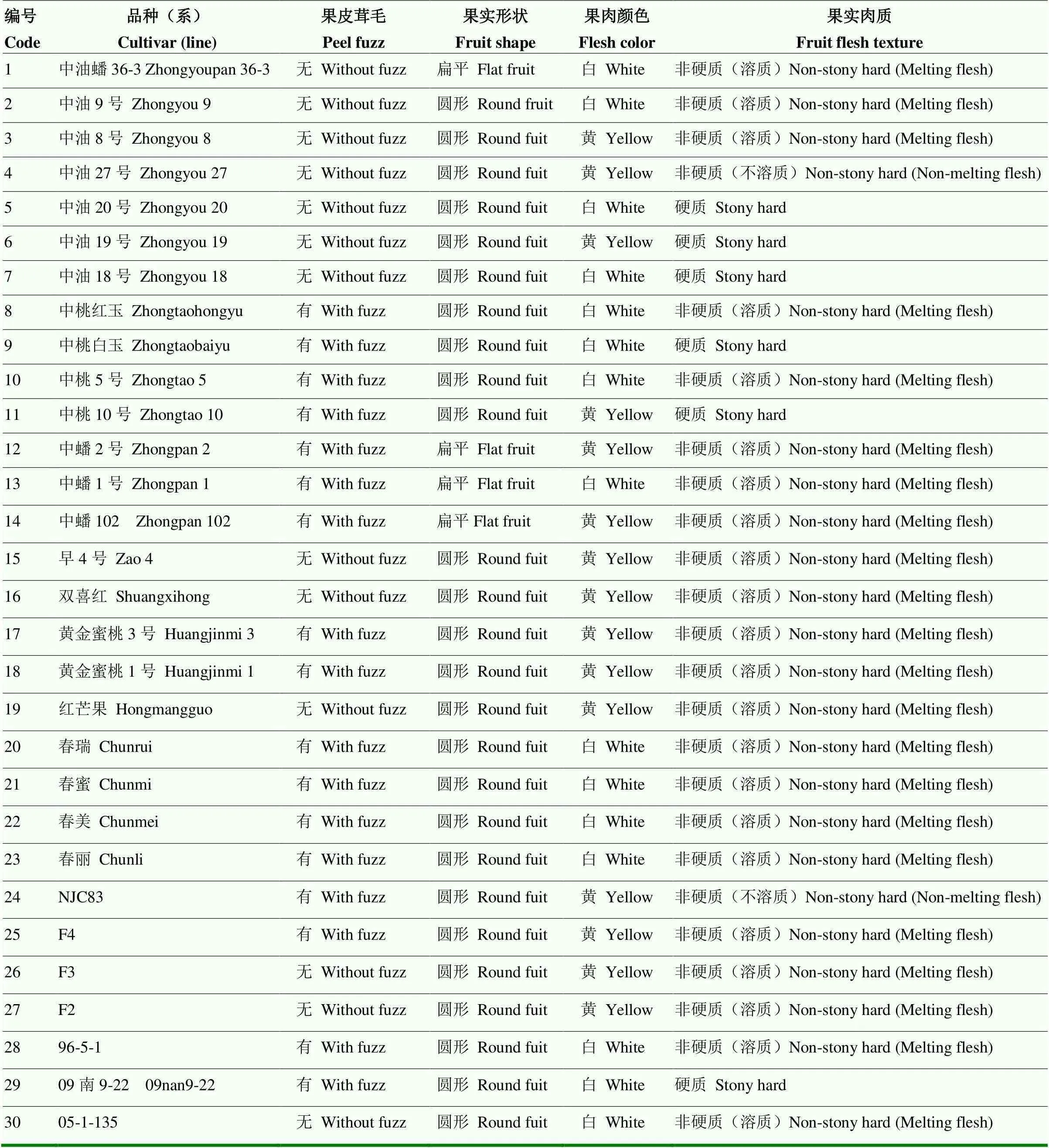
表1 本研究涉及的自然群体材料

表2 本研究涉及的杂交群体
1.2 桃叶片DNA提取
采用张南南等[24]的高通量桃DNA提取方法快速提取基因组总DNA,使用1.0%琼脂糖凝胶电泳检测DNA纯度,微量紫外分光光度计(Nanodrop 2000,Thermo)检测DNA浓度,将DNA稀释至50—100 ng∙mL-1,-20℃贮存备用。
1.3 KASP分子标记的开发
基于已有油桃品种‘中油13号’‘中油16号’,蟠桃品种‘中蟠1号’‘中蟠2号’,DBF型红肉单株‘10新25-8’等50倍基因组重测序数据,在控制各个性状位点附近300 kb内,结合基因组序列比对,选择候选的SNP位点,并从phytozome v 12.1下载候选SNP所在区域的序列。试验所需的KASP标记引物由上海艾吉析科技有限公司合成(表3),引物序列基于SNP突变位点设计。
KASP反应在LightCycler 480 (LC480)上进行,PCR扩增反应体系和反应程序参照韦宇等[25]的方法:将稀释好的DNA模板50—100 ng∙mL-1,分别加入96孔板中,配制如下反应体系进行PCR扩增反应:模板DNA 5mL,2×KASP Master mix 5mL,KASP标记引物0.14mL,每个孔的反应体系总体积为10.14mL。
在LightCycler 480(LC480)上的PCR反应程序为:(1)KASP热循环:94℃预变性15 min;94℃变性20 s;61—55℃退火延伸60 s,10个循环(每个循环降低0.6℃);94℃变性20 s;55℃退火延伸60 s,26个循环;37℃读取1 min。(2)KASP回收:94℃变性20 s;57℃延伸60 s。重复步骤(1)—(2)两次(共3次);37℃读取1 min。反应结束后,根据检测的2种荧光信号来判断样本分型情况,不同的荧光信号获得不同的基因型。
1.4 表型鉴定
遗传群体于2017年定植于中国农业科学院郑州果树研究所桃育种圃,在2019年开始结果。在果实成熟期随机选取树冠中部外围10个果实,参照王力荣等[26]编著的《桃种质资源描述规范和数据标准》调查桃果实表皮有毛/无毛、果形扁平/圆形、果肉红肉/非红肉等性状(图1)。
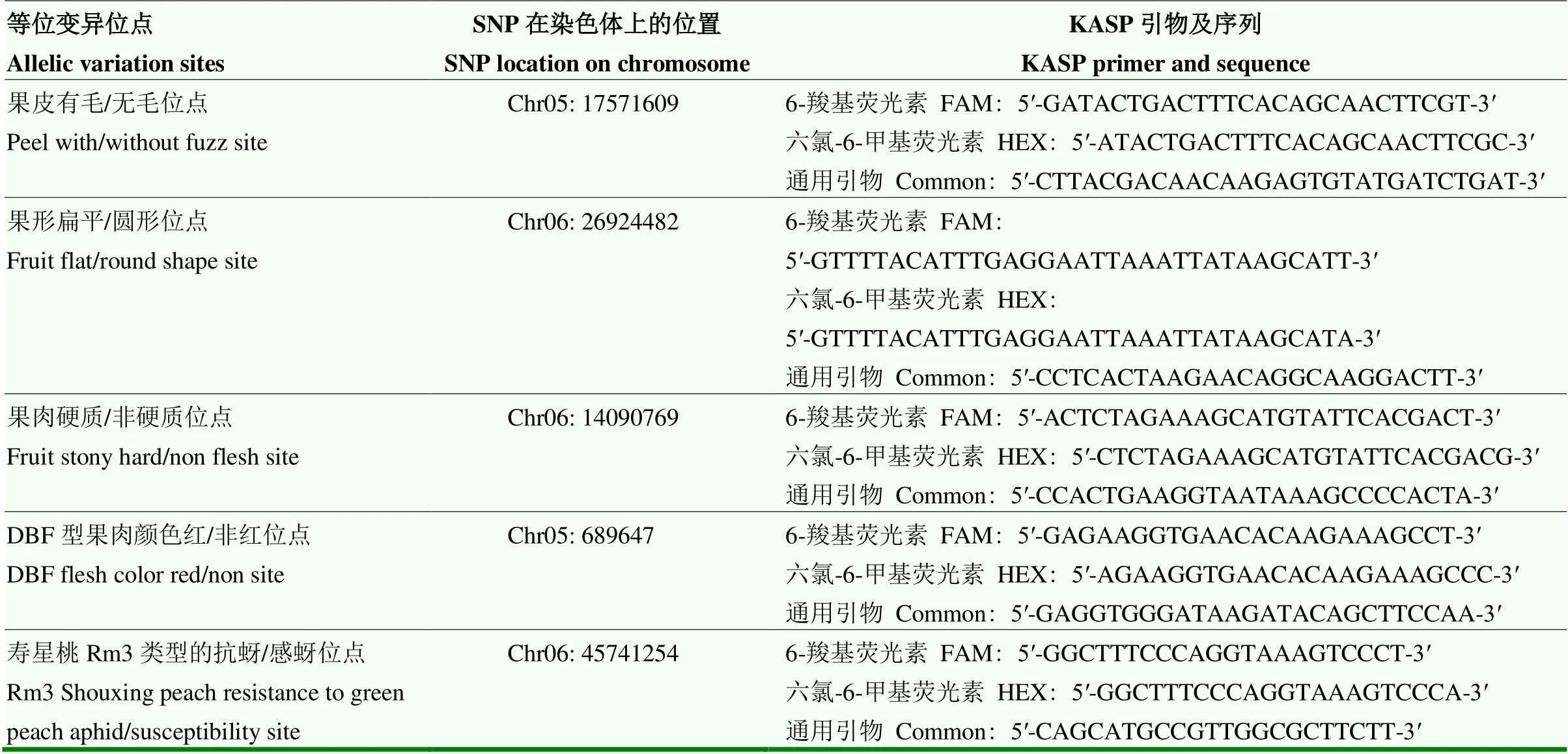
表3 桃若干性状标记引物序列

A:桃果实果肉颜色:红肉与白肉;B:桃果实形状:蟠桃与圆桃,桃果皮茸毛有无:油桃与毛桃;C:桃树感蚜、抗蚜以及蚜虫刺探后抗蚜植株产生的过敏斑点
桃果实成熟期及采后均不变软,且均不释放乙烯的为硬质桃。在果实成熟后,采集50个果实,置于25℃室温条件下储存,每3 d随机取5个桃,用数显式水果硬度计(型号:GY-4)测量果实硬度;同时将3个无病虫害、无机械损伤的桃置于2 L保鲜盒中,密封2 h后,进样针抽取1 mL气体,气相色谱仪(岛津GC-2010)检测乙烯含量。连续2周后果实不变软且不释放乙烯,即为硬质桃。选取的果子成熟度依据果皮底色来判断,一般底色已完全褪绿的溶质桃果实在5 d内会释放乙烯,果实迅速软化,乙烯释放达到高峰;果实硬度保持较高的水平,有乙烯释放,为不溶质桃。
抗桃绿蚜性状于杂种苗定植后第2年蚜虫发生盛期开展,对每个单株蚜虫为害卷叶程度单独进行评价,抗蚜标准参考牛良等[8]的方法。
1.5 基因分型与数据统计分析
利用LC480 software软件分析基因分型结果:聚合在X轴附近的基因型为连接FAM荧光标签序列的等位基因型,聚合在Y轴附近的基因型为连接HEX荧光标签序列的等位基因型,中间显示红色的基因型为两种等位基因的杂合型,左下角显示灰色的样本为不加DNA模板(以灭菌水为模板)的空白对照。
数据统计分析与作图采用Excel 2007。
2 结果
2.1 桃果皮茸毛有/无等位变异的KASP鉴定结果
从组合1中随机取60个单株,从保存的种质资源中取30份材料,利用开发的KASP分子标记对这些材料的基因型进行检测,KASP分型结果见图2和表4,共呈现出3种基因型,等位基因X和杂合型为毛桃,等位基因Y为油桃。遗传群体中后代有毛/无毛性状分离比例为30﹕30(χ2c=0<χ20.05=3.84),符合孟德尔遗传1﹕1的分离规律,且标记验证符合率为100%。30份种质资源的标记鉴定结果与表型符合率也达到100%。
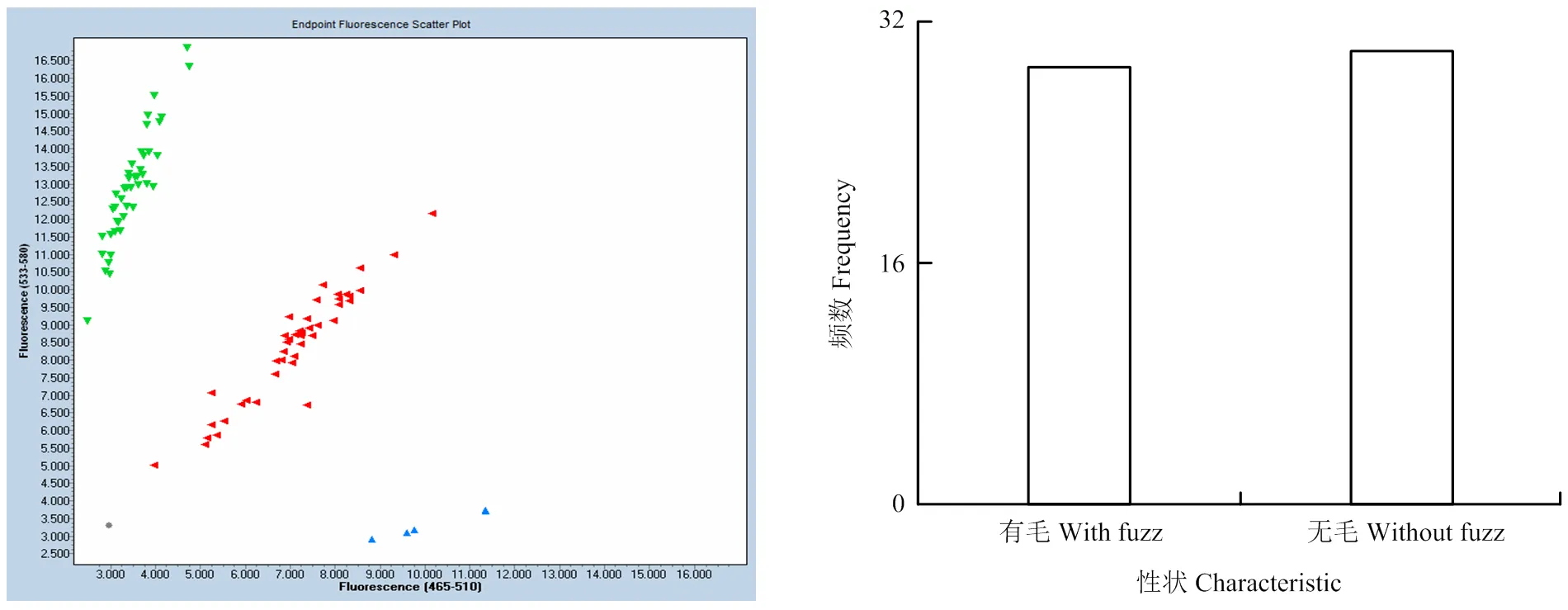
图2 90份桃种质果实有毛/无毛性状KASP基因分型图及后代群体中有毛/无毛性状分离
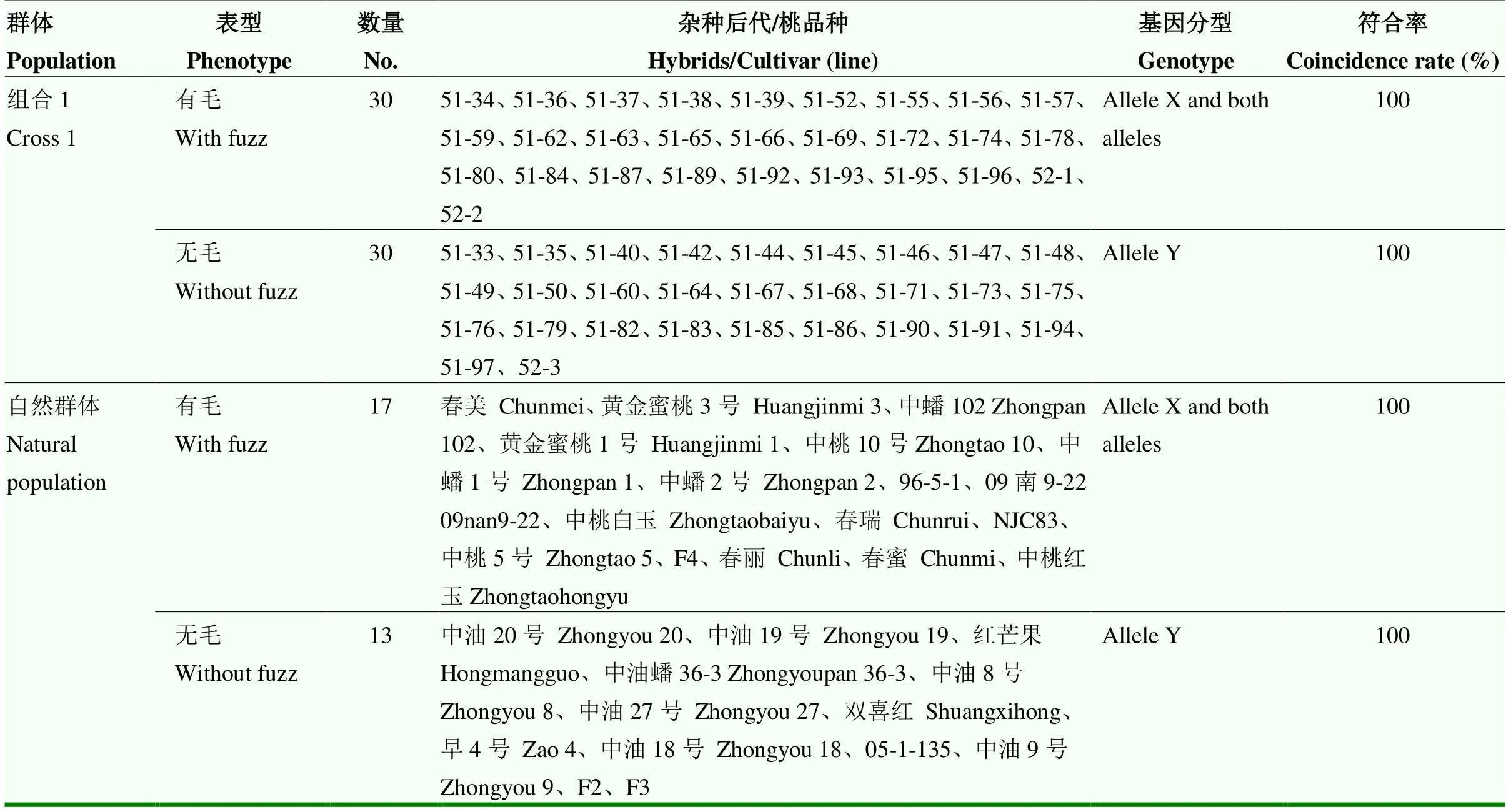
表4 利用KASP分子标记对桃种质果实有毛/无毛基因分型检测结果
2.2 桃果实扁平/圆形等位变异的KASP鉴定结果
对90份已知果形表型的组合1遗传群体和自然群体材料进行KASP标记应用发现,共呈现2种基因型,等位基因X为圆桃,杂合型为蟠桃,基因分型结果见图3和表5,标记符合率为100%。发现59份遗传群体后代中圆桃﹕蟠桃分离比例为29﹕31(χ2c=0.0667<χ20.05=3.84),符合1﹕1的孟德尔遗传分离比例。
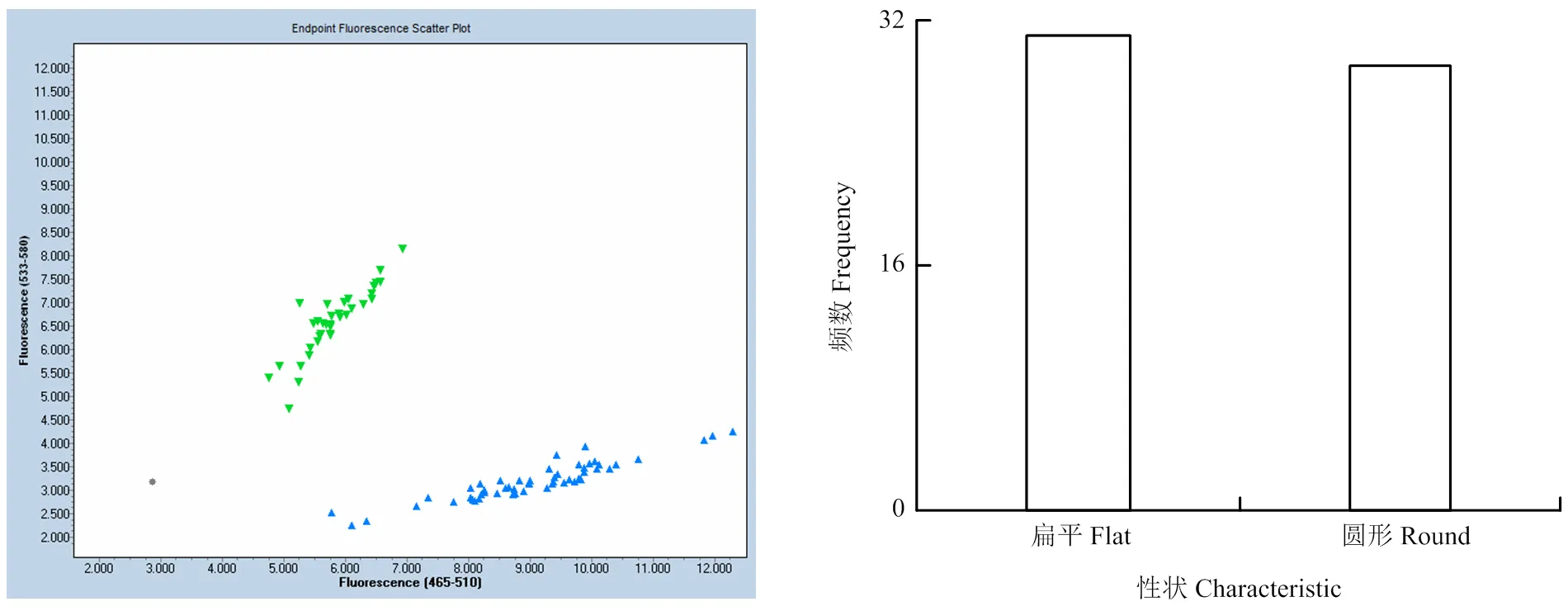
图3 90份桃种质果实扁平/圆形性状KASP基因分型图及后代群体中分离比例
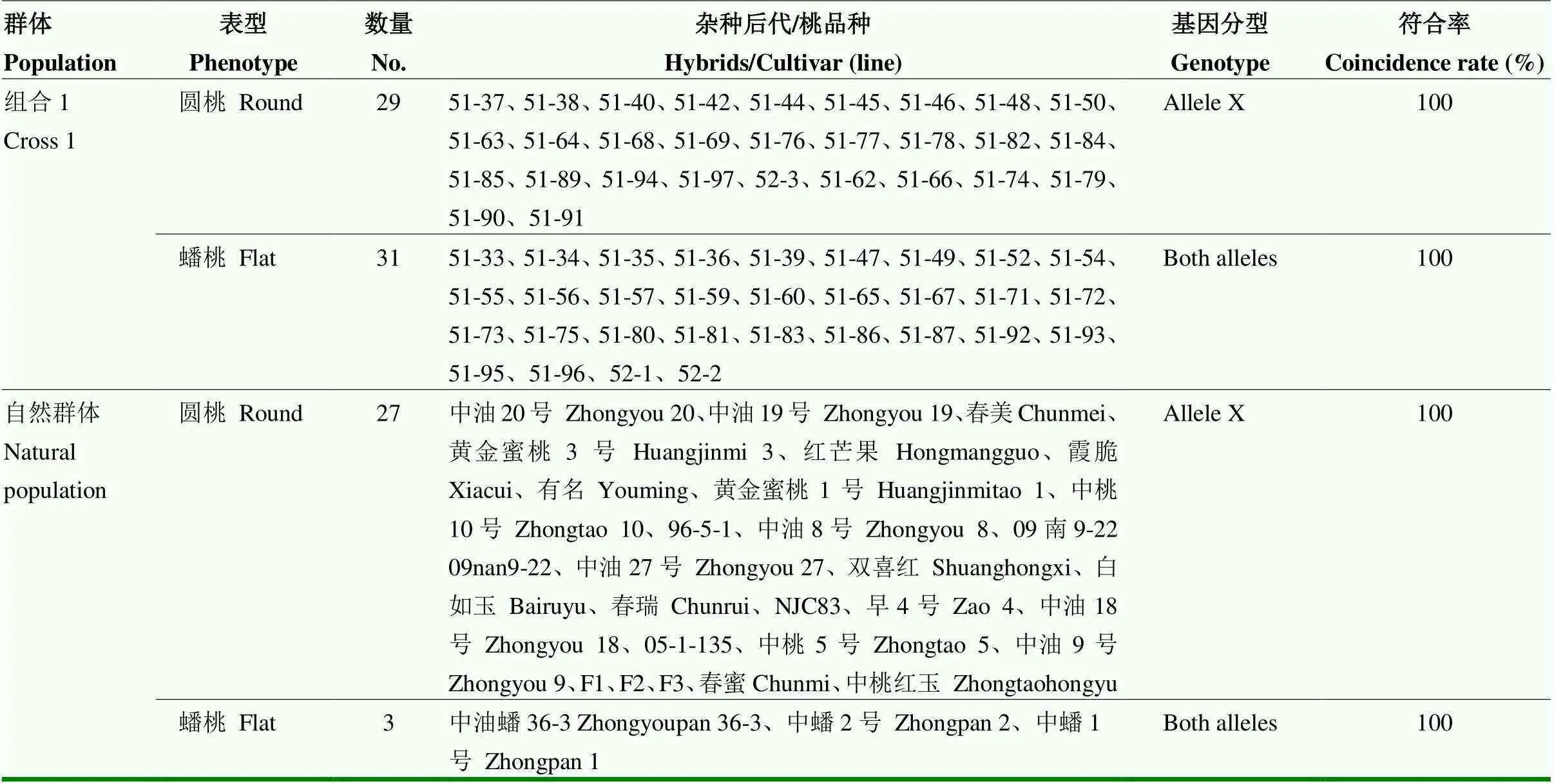
表5 桃果实扁平/圆形等位变异的KASP验证
2.3 桃果肉硬质/非硬质等位变异的KASP鉴定结果
利用硬质性状KASP标记检测组合2遗传分离群体和自然群体基因型。标记检测结果表现出3种基因型(图4、表6)。其中组合2群体共检测53个单株,有27个单株为硬质桃的隐性纯合基因型,26个单株为非硬质桃的杂合基因型,2种基因型比例符合1﹕1单基因遗传分离规律(χ2c=0.0189<χ20.05=3.84),标记检测结果与果实成熟期肉质鉴定表型完全一致,即KASP标记与硬质表型共分离,同时能检测到杂合基因型,表明标记可用于硬质桃育种的MAS选择。对22份品种资源材料的检测,与表型的符合率为100%(表6)。
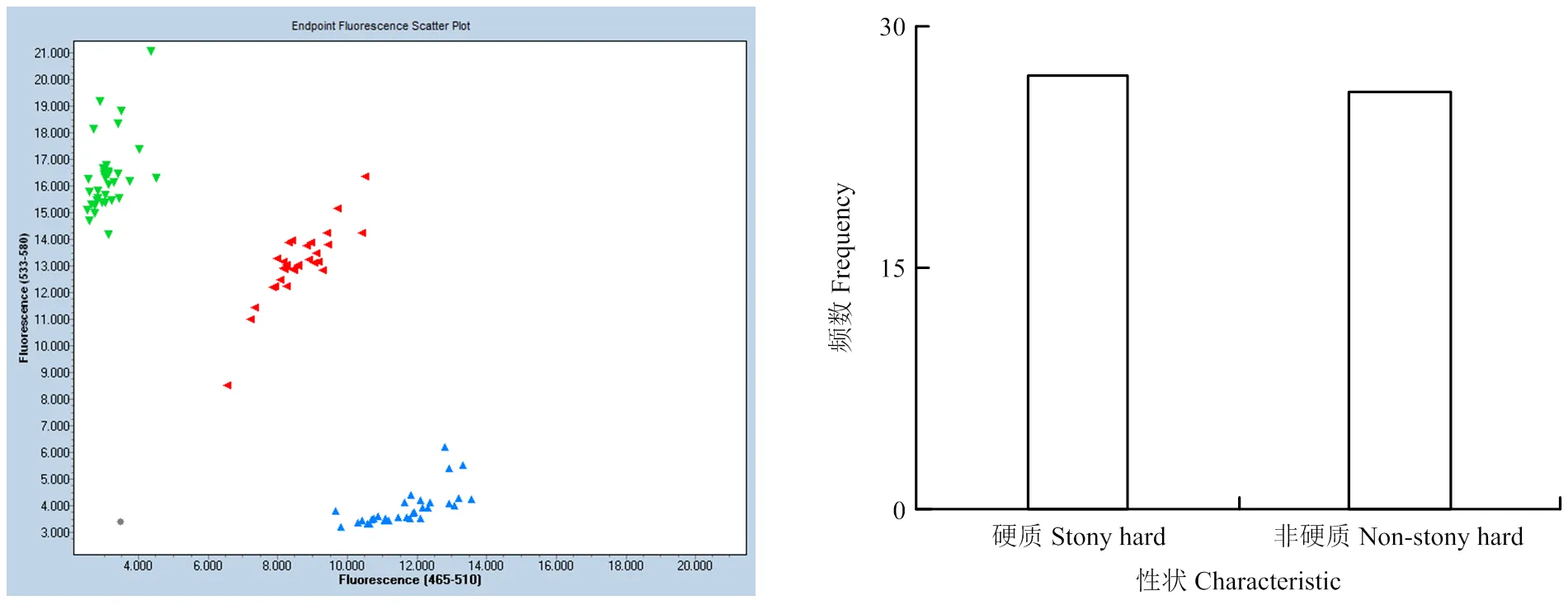
图4 桃硬质群体KASP基因分型图及后代群体中硬质/非硬质性状分离
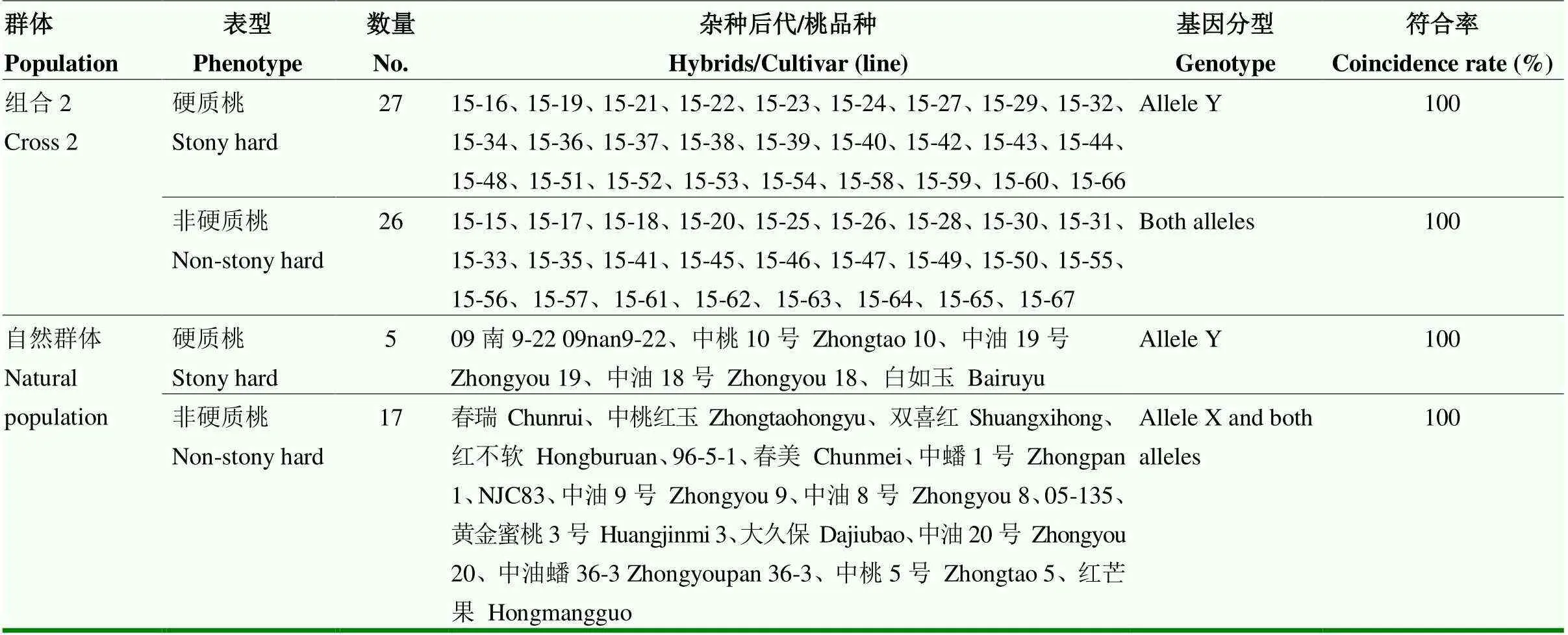
表6 桃果实硬质/非硬质等位变异的KASP验证
2.4 桃果实DBF型红肉变异的KASP鉴定结果
利用开发的DBF红肉KASP标记对组合2中53个单株及17份验证单株进行基因分型(图5、表7)。结果表明,样品基因型分型准确,且标记与表型鉴定结果的符合率达100%。其中,后代遗传群体中红肉有21个单株,非红肉32个单株。
2.5 Rm3抗蚜/感蚜分离群体的KASP鉴定结果
对组合1的95个单株进行KASP标记验证,结果表明,样品基因分型准确(图6、表8),分型结果与表型完全吻合。组合1杂交后代抗蚜:感蚜分别为49﹕46(χ2c=0.095<χ20.05=3.84),符合孟德尔遗传1﹕1的分离规律。
3 讨论
桃果实表皮茸毛、果形、红肉、抗蚜、硬质等关键农艺性状是涉及桃果实外观、品质、抗逆性、耐贮运性的关键性状。在遗传育种中,果实相关的表型评价工作需要杂种实生苗定植开花结果后开展,存在鉴定周期长、占用土地资源与人力成本高等问题,不能满足快速准确地根据育种目标进行选择的需求。因此,相关分子标记开发及应用系统的建立在桃MAS育种中显得尤为重要。KASP技术具有成本低、通量高、检测速度快、可视化好的优势,不需要每个SNP位点都合成特异的荧光引物,所有位点都使用通用荧光引物来扩增检测,大大降低了试剂成本。KASP技术仅需PCR和荧光检测两个步骤,且能实现只需加样一次,即可完成基因分型过程,轻松地将分型结果在软件中可视化。而且KASP技术除了检测单个突变位点外,还可以检测片段缺失或大片段插入等[27]。因此,在植物分子育种、医学研究等方面具有很好的应用潜力。
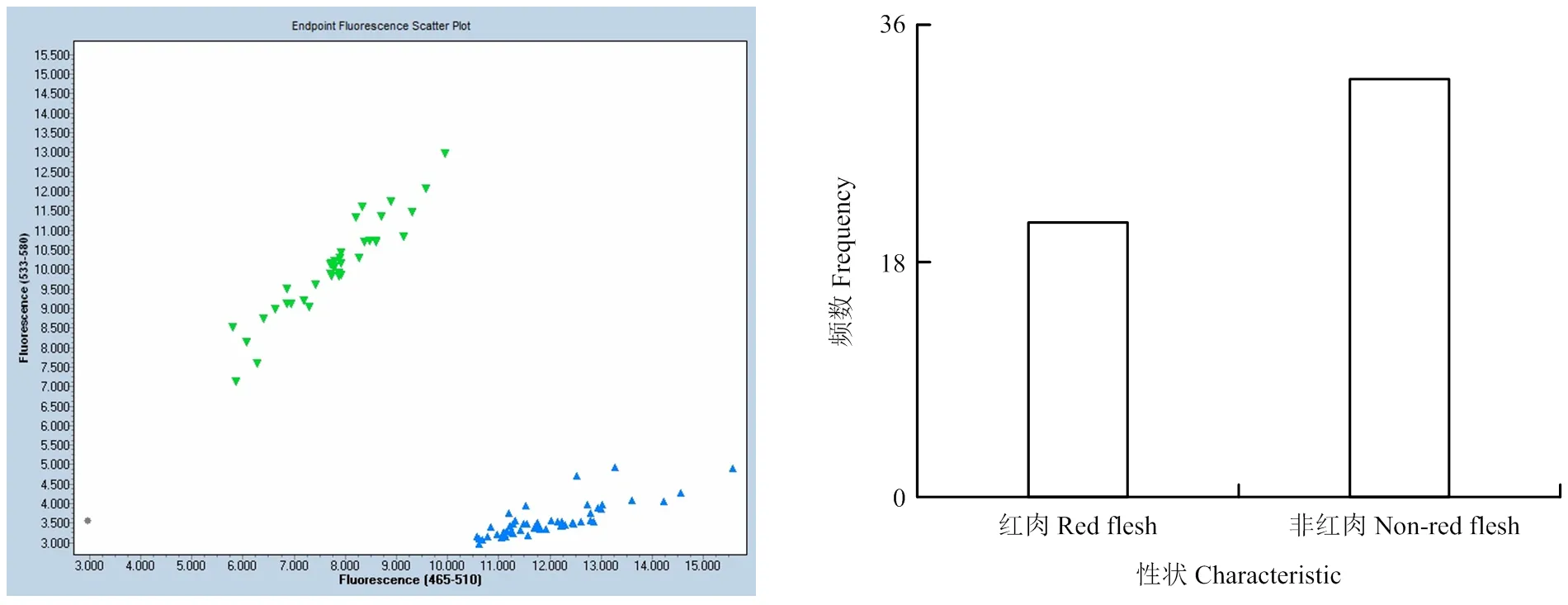
图5 桃DBF型红肉KASP基因分型图及分离遗传群体中红肉/非红肉分离情况

表7 桃果实红肉/非红肉等位变异的KASP验证
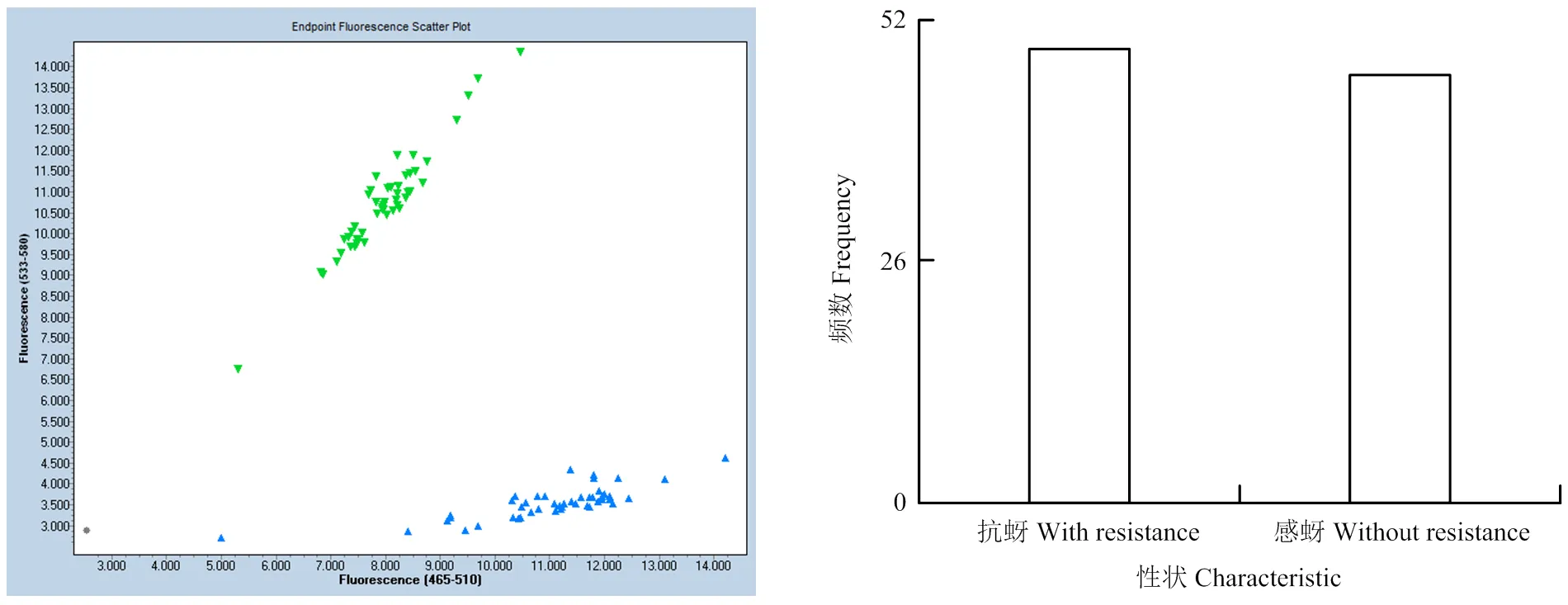
图6 组合1抗蚜分离群体KASP基因分型图及后代群体中抗蚜/感蚜分离情况

表8 抗蚜/感蚜杂交群体中的KASP验证
普通的分子标记主要依赖于PCR反应之后,仍需进行琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳分析,试验费时费力且手工点样存在误差,而本研究利用的KASP基因分型方法建立的荧光分子标记,不再需要进行电泳分析,利用96孔板即可在罗氏480仪器上完成样品的检测。本研究结果表明,KASP标记对比前人研究的桃果皮茸毛SCAR[28]、SSR标记[29]和果形ASPCR[16]、SSR标记[30],能快速准确地检测出桃果实中有毛/无毛、果形扁平/圆形等。本试验分离群体包含93个单株,而用于果皮茸毛、果形标记验证的群体数量有60个,结果相对而言比较可靠,认为可用于分子标记辅助育种。本研究对红肉/非红肉的KASP检测,结果发现红肉/非红肉分离比例为21﹕32,不符合1﹕1孟德尔遗传分离规律,推测一方面是红肉性状与成熟期相关联,导致分离出现偏差;另一方面可能与亲本复杂且尚不清楚的遗传背景有关。对硬质/非硬质性状的检测显示,分型效果好,符合率高,相较于曾文芳等[31]通过两对引物(PF1、PR1与PF2、PR2)的扩增确定硬质性状位点基因型,KASP标记能够更加简便地检测HD/hd基因型。另外,本研究基于寿星桃类型的抗蚜新基因首次开发了抗蚜/感蚜KASP分子标记,为将抗蚜性加入到新品种选育目标中提供了早期选择工具,可为提高育种效率提供参考。
尽管KASP标记自发展以来在育种中体现出很大的便捷性,但它也有自身的缺点。由于正向引物末端必须存在位点的变异,导致设计引物有一定局限性,影响引物质量,存在非特异扩增,导致分型失败。由于KASP技术的高通量特性,加上LGC公司反应试剂,若检测样品较少,相对地单个样本的检测成本会较高。另外,KASP技术目前多用于对质量性状的功能基因进行高通量检测。而对桃来说,数量性状QTL如果实含糖量、成熟期等在育种中同样具有重要意义。相反,随着基因组测序技术的不断完善和发展,SNP信息爆发性的增长,大量潜在的SNP标记均可以用于品种改良。近年来,已经利用基因分型从小麦中成功筛选出有价值的QTLs以及与性状关联的标记[32-34]。LIU等[35]成功将小麦中与产量、品质和抗病相关的数量性状位点转化为KASP标记。何中虎等[36]综述了小麦条锈病和白粉病成株抗性的系统研究和育种实践,表明聚合4—5个微效基因可以培育出持久抗性品种,可有效减少产量损失。综上所述,使用低成本、高效率的KASP基因分型技术进行分子辅助育种,在材料中导入重要农艺性状,是育种工作者更加值得研究的问题。
4 结论
基于KASP技术对桃果皮茸毛有/无、果形扁平/圆形、果肉硬质/非硬质、DBF红肉/非红肉、Rm3抗蚜/感蚜等5对桃重要农艺性状进行基因分型,获得了与性状共分离的准确分子标记,这些KASP标记可适用于相关品种基因型鉴定、杂交亲本辅助选择及杂种单株的早期选择等。
[1] ZIMMERMAN R H. Juvenility and flowering of fruit trees. Acta Horticulturae1973, 34: 139-142.
[2] FLACHOWSKY H, PEIL A, SOPANEN T, ELO A, HANKE V. Overexpression offrom silver birch (Roth.) induces early-flowering in apple (Borkh.). Plant Breeding, 2007, 126: 137-145.
[3] FLACHOWSKY H, LE ROUX P M, PEIL A, PATOCCHI A, RICHTER K, HANKE M V. Application of a high-speed breeding technology to apple (×) based on transgenic early flowering plants and marker-assisted selection. The New Phytologist, 2011, 192(2): 364-377.
[4] 马之胜, 贾云云, 马文会. 我国桃育种目标的演变、育种成就及目标展望. 河北农业科学, 2003, 7(s1): 99-102.
MA Z S, JIA Y Y, MA W H. Evalution of breeding objects, achievements and prospects on peach in China. Journal of Hebei Agricultural Sciences, 2003, 7(s1): 99-102.(in Chinese)
[5] ABBOTT A G, LECOULS A C, WANG Y, GEORGI L, SCORZA R, REIGHARD G. Peach: The model genome for Rosaceae genomics. Acta Horticulturae, 2002, 592: 199-209.
[6] VENDRAMIN E, PEA G, DONDINI L, PACHECO I, DETTORI M T, GAZZA L, SCALABRIN S, STROZZI F, TARTARINI S, BASSI D, VERDE I, ROSSINI L. A unique mutation in a MYB gene cosegregates with the nectarine phenotype in peach. PLoS ONE, 2014, 9(3): e112032.
[7] 姜全, 郭继英, 郑书旗, 赵剑波. 蟠桃果形遗传分析. 果树科学, 2000(S1): 1-4.
JIANG Q, GUO J Y, ZHENG S Q, ZHAO J B. Genetic analysis of fruit shape of flat peach. Journal of Fruit Science, 2000(S1): 1-4. (in Chinese)
[8] 牛良, 鲁振华, 曾文芳, 崔国朝, 潘磊, 徐强, 李国怀, 王志强. ‘粉寿星’对桃绿蚜抗性的遗传分析. 果树学报, 2016, 33(5): 578-584.
NIU L, LU Z H, ZENG W F, CUI G C, PAN L, XU Q, LI G H, WANG Z Q. Inheritance analysis of resistance to green peach aphids (Sulzer) for peach cultivar ‘Fen Shouxing’ (var.). Journal of Fruit Science, 2016, 33(5): 578-584. (in Chinese)
[9] SHEN Z J, CONFOLENT C, LAMBERT P, POËSSEL J L, BÉNÉDICTE Q T, YU M L, MA R J, Pascal T. Characterization and genetic mapping of a new blood-flesh trait controlled by the single dominant locusin peach. Tree Genetics and Genomes, 2013, 9(6): 1435-1446.
[10] GOFFREDA J C. Stony hard gene of peach alters ethylene biosynthesis, respiration, and other ripening related characteristics. HortScience, 1992, 27(6): 610.
[11] VERDE I, ABBOTT A G, SCALABRIN S, JUNG S, SHU S Q, MARRONI F, ZHEBENTYAYEVA T, DETTORI M T, GRIMWOOD J, CATTONARO F, ZUCCOLO A, ROSSINI L, JENKINS J, VENDRAMIN E, MEISEL L A, DECROOCQ V, SOSINSKI B, PROCHNIK S, MITROS T, POLICRITI A,. The high-quality draft genome of peach () identifies unique patterns of genetic diversity, domestication and genome evolution. Nature Genetics, 2013, 45(5): 487-494.
[12] 连晓东, 谭彬, 郑先波, 陈谭星, 王婷, 栗焕楠, 冯建灿. 桃主要性状的分子标记与功能基因定位研究进展. 果树学报, 2018, 35(3): 334-346.
LIAN X D, TAN B, ZHENG X B, CHEN T X, WANG T, LI H N, FENG J C. Progress in molecular markers and localization of functional genes of main traits in peach. Journal of Fruit Science, 2018, 35(3): 334-346. (in Chinese)
[13] CAO K, ZHOU Z K, WANG Q, GUO J, ZHAO P, ZHU G R, FANG W C, CHEN C W, WANG X W, WANG X L, TIAN Z X, WANG L R. Genome-wide association study of 12 agronomic traits in peach. Nature Communications, 2016, 7: 13246.
[14] 冯建灿, 张梦洋, 李敏, 程钧, 方伟超, 牛良, 郑先波, 叶霞, 谭彬. 桃果皮茸毛性状IndelG标记基因分型与应用. 河南农业大学学报, 2019, 53(1): 64-72.
FENG J C, ZHANG M Y, LI M, CHENG J, FANG W C, NIU L, ZHENG X B, YE X, TAN B. Analysis and application of genotypes on peel fuzz trait in peach resources with IndelG molecular marker. Journal of Henan Agricultural University, 2019, 53(1): 64-72. (in Chinese)
[15] MICHELETTI D, DETTORI M T, MICALI S, ARAMINI V, PACHECO I, DA SILVA LINGE C, FOSCHI S, BANCHI E, BARRENECHE T, QUILOT-TURION B, LAMBERT P, PASCAL T, IGLESIAS I, CARBÓ J, WANG L R, MA R J, LI X W, GAO Z S, NAZZICARI N, TROGGIO M, BASSI D, ROSSINI L, VERDE I, LAURENS F, ARÚS P, ARANZANA M J. Whole-genome analysis of diversity and SNP-major gene association in peach germplasm. PLoS ONE, 2015, 10(9): e0136803.
[16] 郭健. 蟠桃果形基因发掘及生理机制探讨[D]. 北京: 中国农业科学院, 2016.
GUO J. Gene discovery of fruit shape and physiological mechanism investigation in flat peach [D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese)
[17] ZHOU H, KUI L W, WANG H L, GU C, DARE A P, ESPLEY R V, HE H P, ALLAN A C, HAN Y P. Molecular genetics of blood-fleshed peach reveals activation of anthocyanin biosynthesis by NAC transcription factors. The Plant Journal, 2015, 82(1): 105-121.
[18] PAN L, ZENG W F, NIU L, LU Z H, LIU H, CUI G C, ZHU Y Q, CHU J F, LI W P, FANG W C, CAI Z G, LI G H, WANG Z Q., a strong candidate gene for the stony hard phenotype in peach (L. Batsch), participates in IAA biosynthesis during fruit ripening. Journal of Experimental Botany, 2015, 66(22): 7031-7044.
[19] 牛良. 寿星桃抗蚜性鉴定及分子机制解析[D]. 武汉: 华中农业大学, 2019.
NIU L. Identification of resistance to green peach aphids of shouxing peach and its molecular mechanism [D]. Wuhan: Huazhong Agricultural University, 2019. (in Chinese)
[20] 程萌杰, 闫双勇, 施利利, 孙宁, 张欣, 丁得亮, 边嘉宾, 王松文. 利用KASP标记评价水稻品种多态性. 天津农学院学报, 2018, 25(4): 13-16, 23.
CHENG M J, YAN S Y, SHI L L, SUN N, ZHANG X, DING D L, BIAN J B, WANG S W. Evaluation of rice variety polymorphisms using KASP markers. Journal of Tianjin Agricultural University, 2018, 25(4): 13-16, 23. (in Chinese)
[21] 牛付安, 周继华, 曹黎明, 程灿, 涂荣剑, 胡雪娇, 杨佳, 孙滨, 罗忠永, 赵志鹏, 王新其, 储黄伟. 水稻低直链淀粉含量基因Wxmq的KASP标记开发与利用. 分子植物育种, 2019, 17(24): 8125-8131.
NIU F A, ZHOU J H, CAO L M, CHENG C, TU R J, HU X J, YANG J, SUN B, LUO Z Y, ZHAO Z P, WANG X Q, CHU H W. Development and utilization of KASP marker for low amylose content gene, Wxmq, in rice (L.). Molecular Plant Breeding, 2019, 17(24): 8125-8131. (in Chinese)
[22] 单子龙, 班进福, 赵彦坤, 曹巧, 田国英, 何明琦, 高振贤. 河北省小麦品质相关基因的KASP标记检测. 作物杂志, 2020(4): 64-71.
SHAN Z L, BAN J F, ZHAO Y K, CAO Q, TIAN G Y, HE M Q, GAO Z X. Detection of quality-related genes in the wheat varieties authorized in Hebei Province by KASP markers. Crops, 2020(4): 64-71. (in Chinese)
[23] 胡茂龙, 程丽, 郭月, 龙卫华, 高建芹, 浦惠明, 张洁夫, 陈松. 油菜抗咪唑啉酮类除草剂基因标记的开发与应用. 作物学报, 2020, 46(10): 1639-1646.
HU M L, CHENG L, GUO Y, LONG W H, GAO J Q, PU H M, ZHANG J F, CHEN S. Development and application of the marker for imidazolinone-resistant gene in.Acta Agronomica Sinica, 2020, 46(10): 1639-1646. (in Chinese)
[24] 张南南, 牛良, 崔国朝, 潘磊, 曾文芳, 王志强, 鲁振华. 一种高通量提取桃DNA方法的建立与应用. 中国农业科学, 2018, 51(13): 2614-2621.
ZHANG N N, NIU L, CUI G C, PAN L, ZENG W F, WANG Z Q, LU Z H. Establishment and application of a high-throughout protocol for peach () DNA extraction. Scientia Agricultura Sinica, 2018, 51(13): 2614-2621. (in Chinese)
[25] 韦宇, 李孝琼, 何新柳, 陈红操, 陈颖, 黄克宁, 卢东长城, 郭嗣斌. 基于KASP技术的稻瘟病抗性基因Pi9分子标记的开发与评价. 西南农业学报, 2019, 32(6): 1216-1222.
WEI Y, LI X Q, HE X L, CHEN H C, CHEN Y, HUANG K N, LU D C C, GUO S B. Development and evaluation of rice blast resistance gene (Pi9) SNP molecular markers based on KASP technology. Southwest China Journal of Agricultural Sciences, 2019, 32(6): 1216-1222. (in Chinese)
[26] 王力荣, 朱更瑞. 桃种质资源描述规范和数据标准. 北京: 中国农业出版社, 2005.
WANG L R, ZHU G R. Descriptors and Data Standard for Peach (L.). Beijing: Chinese Agriculture Press, 2005. (in Chinese)
[27] RASHEED A, WEN W E, GAO F M, ZHAI S N, JIN H, LIU J D, GUO Q, ZHANG Y J, DREISIGACKER S, XIA X C, HE Z H. Development and validation of KASP assays for genes underpinning key economic traits in bread wheat. Theoretical and Applied Genetics, 2016, 129(10): 1843-1860.
[28] 姜立杰, 杨英军, 张晓明, 李文生, 张开春. 桃果实有毛/无毛性状的SCAR标记. 园艺学报, 2005, 32(6): 1003-1007.
JIANG L J, YANG Y J, ZHANG X M, LI W S, ZHANG K C. SCAR marker linked to the peach/nectarine in peach. Acta Horticulturae Sinica, 2005, 32(6): 1003-1007. (in Chinese)
[29] 张妤艳, 马瑞娟, 俞明亮, 宋宏峰. 桃肉色、果皮茸毛性状的SSR标记筛选. 南方农业学报, 2014, 45(7): 1160-1165.
ZHANG Y Y, MA R J, YU M L, SONG H F. Screening on SSR markers linked to flesh colour gene and nectarine gene of(L.) Batsch. Journal of Southern Agriculture, 2014, 45(7): 1160-1165. (in Chinese)
[30] 张妤艳, 马瑞娟, 俞明亮, 许建兰. 桃果形性状的SSR标记. 江苏农业学报, 2012, 28(6): 1424-1428.
ZHANG Y Y, MA R J, YU M L, XU J L. Molecular marker linked to peach fruit shape by simple sequence repeat (SSR). Jiangsu Journal of Agricultural Sciences, 2012, 28(6): 1424-1428. (in Chinese)
[31] 曾文芳, 丁义峰, 潘磊, 王小贝, 牛良, 鲁振华, 崔国朝, 王志强. 桃硬质性状可能源于PpYUC11基因启动子区域CACTA型转座子的插入. 果树学报, 2017, 34(10): 1239-1248.
ZENG W F, DING Y F, PAN L, WANG X B, NIU L, LU Z H, CUI G C, WANG Z Q. A CACTA transposable element in a PpYUC11 gene promoter is associated with the stony hard phenotype in peach. Journal of Fruit Science, 2017, 34(10): 1239-1248. (in Chinese)
[32] CURRY J D. Key trait screening on global wheat accessions using KASP genotyping markers-A new open resource for the wheat breeding community [EB/OL]. 2016. https://pag.confex.com/pag/ xxiv/webprogram/Paper20333.html.
[33] GROGAN S M, BROWN-GUEDIRA G, HALEY S D, MCMASTER G S, REID S D, SMITH J, BYRNE P F. Allelic variation in developmental genes and effects on winter wheat heading date in the US great Plains. PLoS ONE, 2016, 11(4): e0152852.
[34] PEREZ-LARA E, SEMAGN K, CHEN H, TRAN V A, CIECHANOWSKA I, IQBAL M, N’DIAYE A, POZNIAK C, STRELKOV S E, HUCL P J, GRAF R J, RANDHAWA H, SPANER D. Allelic variation and effects of 16 candidate genes on disease resistance in western Canadian spring wheat cultivars. Molecular Breeding, 2017, 37(3): 23.
[35] LIU Y N, HE Z H, APPELS R, XIA X C. Functional markers in wheat: Current status and future prospects. Theoretical and Applied Genetics, 2012, 125(1): 1-10.
[36] 何中虎, 兰彩霞, 陈新民, 邹裕春, 庄巧生, 夏先春. 小麦条锈病和白粉病成株抗性研究进展与展望. 中国农业科学, 2011, 44(11): 2193-2215.
HE Z H, LAN C X, CHEN X M, ZOU Y C, ZHUANG Q S, XIA X C. Progress and perspective in research of adult-plant resistance to stripe rust and powdery mildew in wheat. Scientia Agricultura Sinica, 2011, 44(11): 2193-2215. (in Chinese)
Development and Application of KASP Molecular Markers of Some Important Traits for Peach
MENG JunRen, ZENG WenFang, DENG Li, PAN Lei, LU ZhenHua, CUI GuoChao, WANG ZhiQiang, NIU Liang
Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences/ National Peach and Grape Improvement Center/Key Laboratory of Fruit Breeding Technology of Ministry of Agriculture, Zhengzhou 450009
【】In order to improve breeding efficiency based on the marker-assisted selection in peach, a series of high-throughput and low-cost KASP markers for important traits (such as fruit skin fuzz, fruit shape, stony hard fruit texture, DBF blood-flesh and resistance to green peach aphids) of peach were developed. 【】Based on the resequenced genome information of some peach cultivars, multiple sequence alignment was used to find specific SNP within 300 kb of both flanks of target genes or loci for related traits. KASP markers were developed according to the differences of SNPs, and the close link between KASP markers and the target characteristics was confirmed by genotyping.【】The developed KASP molecular markers for five traits were utilized to detect the genotypes of peach hybrid populations and natural populations. The results showed that the markers identification was completely consistent with the known phenotypes, and the accuracy was 100%. In the hybrid populations of CN20 × 01-77-4, the segregation ratio of peach peel with fuzz/without fuzz, flat fruit/round fruit, and the segregation ratio of resistance to green peach aphids/susceptibility was 30﹕30, 31﹕29, and 49﹕46, respectively, which were in accordance with the 1﹕1 of Mendel’s first law. In population of CN20 × 10 xin 25-8, the high-throughput KASP molecular marker was used to detect genotypes of 53 offspring, and the results showed that genotypes of 27 were G/G appeared stony hard peach and 21 were T/C appeared DBF blood-flesh fruit, which were consistent with the phenotype identification results.【】The KASP marker could be efficiently used to detect allelic variations of genes related to important traits, such as peach fruit appearance, resistance, and fruit texture. It had a good application prospect in genotypic identification, parents apolegamy and hybrid progenies marker-assisted selection.
peach; KASP; marker-assisted selection; breeding

10.3864/j.issn.0578-1752.2021.15.013
2020-08-30;
2020-11-13
国家重点研发计划(2019YFD1000801)、国家自然科学基金(31872085)、中国农业科学院科技创新工程专项经费项目(CAAS-ASTIP-2020-ZFRI)
孟君仁,E-mail:82101186035@caas.cn。通信作者王志强,E-mail:wangzhiqiang@caas.cn。通信作者牛良,E-mail:niuliang@caas.cn
(责任编辑 赵伶俐)

