药物涂层球囊在急性ST段抬高型心肌梗死中应用的有效性及安全性研究
马曹,杨新颖,吴晓光,史永恩,周豪杰,张卫杰,张凯,陶锋,郑晓晖
直接经皮冠状动脉介入治疗(PPCI)是目前国内外指南推荐的急性ST段抬高型心肌梗死(STEMI)再灌注治疗的主要手段,与静脉溶栓相比具有明显优势[1],研究显示金属裸支架和药物洗脱支架都能在一定程度上降低支架内再狭窄率及靶血管再血管化率,却不能显著降低再发心肌梗死(心梗)及死亡风险[2,3];支架的长期存在始终无法完全避免支架内血栓的发生并影响罪犯血管的舒缩功能[4,5]。药物涂层球囊以“介入无植入”的形式为冠状动脉(冠脉)病变提供了一种新的介入治疗理念和技术,无金属植入物存在,不改变靶血管的生理结构、不影响靶血管的舒缩功能,理论上可降低支架内血栓的发生,目前在STEMI中研究较少。STEMI主要发病机制是冠脉粥样斑块破裂或侵蚀基础上的血栓形成,明显的冠脉血栓会影响药物涂层球囊表面的药物向冠脉壁的渗透,从病理生理机制上讲,药物涂层球囊也适用于经过充分预处理后没有明显血栓的STEMI患者。本试验目的是探讨药物涂层球囊在STEMI中应用的有效性及安全性。
1 资料与方法
1.1 研究对象及分组本研究回顾性分析阜外华中心血管病医院于2018年1月至2019年6月明确诊断为STEMI并行急诊介入治疗的患者195例,符合该研究纳入条件并有效随访患者106例,其中药物洗脱支架(DES)组72例,药物涂层球囊(DCB)组34例。入选标准:①年龄>18岁;②胸痛症状持续时间>30 min;③心电图两个以上导联ST段抬高(肢体导联>1 mV胸导>2 mV)或新发的左束支传导阻滞;④发病12 h以内。排除标准:①对造影剂、阿司匹林、氯吡格雷或替格瑞洛过敏者;②活动性出血或近期出血史;③心源性休克并长时间心肺复苏者;④生存期预计<12月;⑤造影显示左主干病变者;⑥造影显示支架内再狭窄患者。
1.2 药物应用所有患者术前均口服负荷剂量阿司匹林片300 mg、替格瑞洛片180 mg,术后均长期口服双重抗血小板药物阿司匹林片(100 mg qd)和替格瑞洛片(90 mg bid),及他汀类药物。
1.3 手术过程所有的患者均经桡动脉途径,经鞘管给予普通肝素100 IU/kg,根据冠脉造影结果,由术者决定是否进行血栓抽吸、是否应用糖蛋白ⅡbⅢa受体拮抗剂、是否使用切割球囊或棘突球囊,药物涂层球囊及药物洗脱支架的大小也根据术者经验自行决定。为增加后期随访可比性,DCB组只应用DCB扩张并统一选用德国贝朗SeQuent,严格按照标准操作,应用前无明显肉眼可见的血栓,在管腔内停留时间<120 s、扩张时间60~120 s、长度完全覆盖预处理部位两端各2~3 mm;DES组仅植入支架,统一选择第二代雷帕霉素药物洗脱支架。手术成功标准:DCB组梗死相关血管术后即刻的TIMI前向血流3级且残余狭窄≤30%,DES组梗死相关血管术后即刻的TIMI前向血流3级且残余狭窄≤20%,冠脉造影及手术结果由两名经验丰富的术者共同判读。
1.4 随访和研究终点术后1月、6月门诊随访,10月住院复查冠脉造影。主要终点事件包括:晚期管腔丢失率(LLL)、靶病变再血管化率(TLR)及靶血管再血管化率(TVR),次要终点事件包括:再发心绞痛、再发心梗、晚期管径直径获得、心源性猝死、卒中及全因死亡。
1.5 统计学分析采用EpiData 3.0软件建立数据库,采用盲法双录入。采用SPSS 20.0统计软件,符合正态分布的计量资料以平均数±标准差()描述,组间比较采用t检验,不符合正态分布的计量资料采用中位数(第一四分位数Q1,第三四分位数Q3)描述,组间比较采用非参数检验。计数资料以百分比表示,组间比较采用χ2检验,采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床基线资料比较本研究共纳入患者106例,两组临床基线资料比较,差异无统计学意义(表1)。
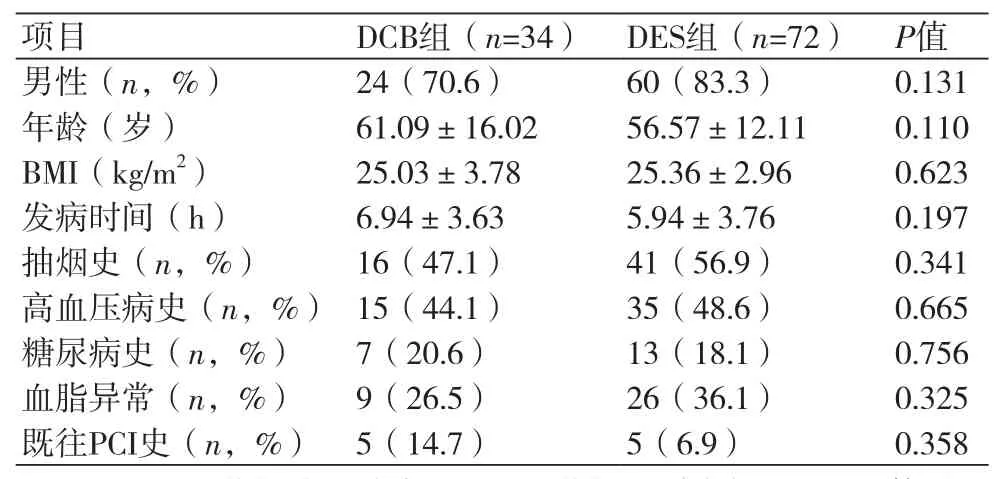
表1 两组临床基线资料比较
2.2 两组患者围手术期参数比较介入干预前的造影结果比较,差异无统计学意义,介入术后即刻的参数比较:两组术后前向血流TIMI分级均为3级血流,DCB组的残余狭窄明显高于DES组[(9.76±5.06%vs. 2.26±3.21%),P<0.05],差异有统计学意义(表2)。

表2 两组患者围术期参数比较
2.3 两组患者随访结果比较经过10个月随访,两组均无再发心梗、卒中事件发生,DCB组再发心绞痛2例, DES组再发心绞痛6例、因心功能差术后死亡1例,差异无统计学意义;两组均无TVR事件发生,DCB组1例术后夹层再次植入支架1枚,DES组1例支架边缘夹层补入支架1枚,1例支架内再狭窄应用DCB治疗。复查冠脉造影显示:DCB组的靶病变最小管腔直径较手术即刻稍增大(2.88±0.36 mmvs. 2.85±0.39 mm),DES组的靶病变最小管腔较手术即刻减小(3.02±0.50 mmvs. 3.11±0.47 mm),DCB组的晚期管腔直径获得优于DES组(0.03±0.13 mmvs. -0.04±0.35 mm,P>0.05),DCB组的晚期管腔直径丢失明显优于DES组(-0.04±0.07 mmvs. 0.14±0.36 mm,P<0.05)(表3)。
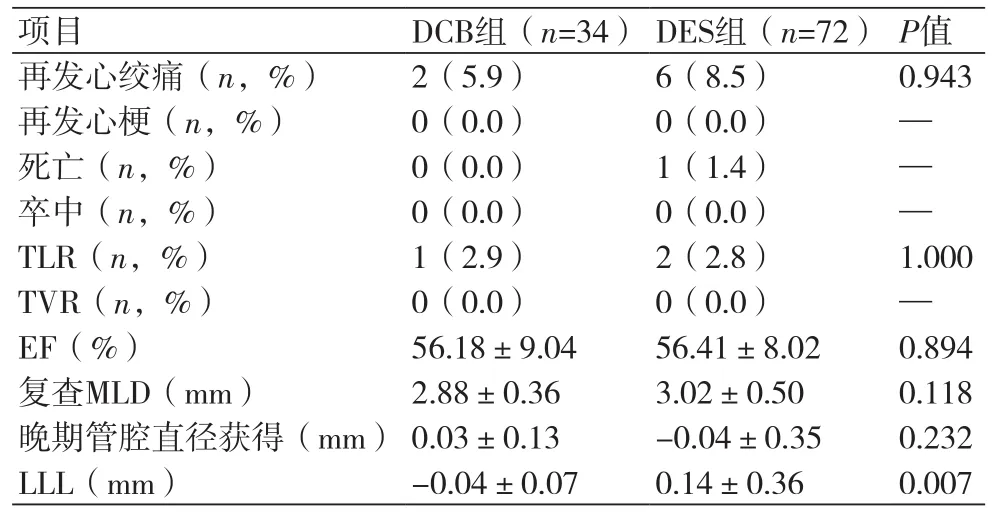
表3 两组患者随访比较
3 讨论
STEMI是冠心病的严重类型,致残致死率高,及时的再灌注治疗可明显降低死亡率。PPCI是STEMI患者的首选治疗手段,受到国内外指南的一致推荐[6]。目前药物涂层球囊主要推荐应用于支架内再狭窄、分叉病变及小血管病变,STEMI中应用研究较少。
本研究通过10个月的随访,主要终点事件:两组TVR、TLR事件发生率无明显差异,DCB组在LLL方面显示出优于DES组的结果。本研究次要终点事件方面:两组相比无明显统计学差异,初步显示出药物涂层球囊在STEMI中应用的安全性。
单纯普通球囊扩张成形术存在较高的罪犯血管的再狭窄、再次闭塞可能[7],随着金属裸支架和药物洗脱支架的逐步使用,虽然支架内再狭窄率及靶血管再血管化率逐渐下降,但再发心梗及死亡风险并未降低,同时支架内血栓及支架内再狭窄仍是临床面临的严峻挑战[2-4],这一系列不良反应和支架表面的多聚物反应及支架梁和周围空白区域药物浓度不均一等因素有关。药物涂层球囊做为一种新的介入治疗技术,弥补了普通球囊扩张后缺少抑制内皮细胞增殖药物的空白,减少了金属网格的植入及聚合物基质的残留,降低了血栓形成的风险及内膜的炎症反应,通过半顺应性球囊将抗增殖药物更快速、更均匀的向病变部位的冠状动脉血管壁释放,达到抑制血管内膜增生的效果[8]。Kleber等[9,10]研究显示DCB有正性重构作用,晚期管腔获得更多,与本研究结果相似,弥补了DCB组术后残余狭窄偏重的劣势, 解释了DCB组LLL优于DES组的原因。
本研究显示术后即刻最小管腔直径及残余狭窄,DCB组劣于DES组,与DCB没有金属钢梁的支撑、缺乏有效的后扩张及血管壁的弹性回缩相关[11],为了尽可能降低残余狭窄程度,DCB组切割球囊的使用比例明显高于DES组,切割球囊能够缓慢而均匀地切开血管内、中膜,使斑块均匀撕裂,最大程度避免了斑块移位和内膜夹层,同时解除了血管壁的环匝应力,有效解决了球囊扩张后弹性回缩的问题[12]。切割球囊的预处理使罪犯血管管腔获得更多、管壁微夹层有助于涂层药物更快速渗透入血管壁,使药物更快速起效。
STEMI患者多存在罪犯血管的痉挛及炎症刺激,影响正常管腔直径、支架大小的判断及支架的精准定位[13],DES永久植入物改变了冠脉的生理解剖、影响血管正常舒缩功能[14,15],DCB能够维持冠脉血管的正常生理结构及舒缩功能[16,17],因此在STEMI患者中应用DCB是可行的。
支架内抗增殖药物的长期、持续释放导致内皮化延迟[18,19],既往实验室研究发现,药物与血管平滑肌短时间接触就能够起到长期抑制管壁内皮细胞增殖的作用,意味着长期的药物持续释放是不必要的[20]。单次药物释放即可抗平滑肌细胞增殖超过14 d,治疗后4周内均可抑制血管内膜增生,药物涂层球囊短时间的药物存在更有助于冠脉病变部位的内皮化,可以缩短双抗药物的使用时间,降低出血风险。因此在高出血风险患者中应用DCB具有明显的优势。
该研究结果显示DCB组无死亡、再发心梗、卒中病例,再发心绞痛病例低于DES组,显示出DCB在急性心肌梗死患者中应用的安全性,与2019年发表的PAPPA研究初步显示的DCB在急性STEMI患者中应用的有效性与安全性结果一致。
本研究为回顾性、单中心、小样本研究,可能存在病例选择的偏倚,如本研究DCB组仅1例因夹层影响血流行补救性支架植入,与REVELATION研究中显示的18%的补救性支架植入相比明显偏低,随访时间较短,需更多RCT研究的长期随访结果证实。同时本研究缺少冠脉内影像学数据支持,后期需增加影像学的客观数据。

