克唑替尼联合化疗治疗间变性淋巴瘤激酶阳性晚期非小细胞肺癌的临床疗效及安全性
王辉,刘宽,杨叶叶
三门峡市中心医院呼吸与危重症医学科,河南 三门峡 472000
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的一种类型,占肺癌的80%~85%。NSCLC 的病理类型较多,包括鳞状细胞癌、腺癌、大细胞癌等。与小细胞肺癌相比,NSCLC 的癌变速度较慢,发生扩散、转移的时间较晚,因此早期积极治疗可获得较好预后。NSCLC 早期以发热、咳嗽、胸痛为主要症状,但由于症状不典型,难以被重视及察觉,绝大多数患者就诊时已发展至中晚期,肿瘤已发生远处转移,因此错过了手术治疗的“黄金时间”。目前临床常采用药物化疗、系统放疗及生物免疫治疗等综合手段治疗晚期NSCLC,以延长患者的生存时间。随着靶向治疗在NSCLC 中的应用与发展,患者的生活质量得到不断提高。间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)是NSCLC 重要的分子靶点,3%~5%的NSCLC 患者存在ALK
基因重排,ALK
可与其他基因融合,棘皮动物微管相关蛋白样4(echinoderm microtubule associated protein like 4,EML4)-ALK
融合基因是其主要类型,参与并促进NSCLC 的发生和发展。因此,针对ALK
基因进行靶向治疗,对改善NSCLC 患者预后具有积极意义。克唑替尼是一种腺苷三磷酸(adenosine triphosphate,ATP)竞争性酪氨酸激酶抑制剂,通过靶向抑制ALK,调控肝细胞生长因子受体(c-met)、ROS1 信号通路,进而发挥遏制肿瘤进展的作用。由于较传统化疗具有更高的疗效,克唑替尼已获国家食品药品监督管理局批准成为治疗晚期NSCLC 的常用化疗药物。目前克唑替尼在临床应用中尚存在耐药性,本研究探讨了克唑替尼与化疗联合对ALK 阳性晚期NSCLC 患者的治疗效果,以期为晚期NSCLC 治疗方案的选择提供一定指导,现报道如下。1 资料与方法
1.1 一般资料
选取2015 年1 月至2017 年12 月三门峡市中心医院收治的NSCLC 患者。纳入标准:①符合晚期NSCLC 的诊断标准,并经病理证实为NSCLC;②TNM 分期为Ⅲ~Ⅳ期;③经聚合酶链反应(polymerase chain reaction,PCR)检测ALK
为阳性;④无手术适应证;⑤卡氏功能状态评分﹥60 分;⑥生存期至少3 个月;⑦近1 个月内未接受过放疗或化疗;⑧病历资料及相关检查资料完整;⑨均具有4个完整疗程。排除标准:①伴有转移;②具有ALK针对性治疗史;③合并其他系统恶性肿瘤,具有抗肿瘤治疗史;④合并癌性脑膜炎、软脑膜疾病或心力衰竭、心绞痛等心血管疾病;⑤化疗不耐受;⑥对研究中涉及药物过敏;⑦特殊时期(妊娠期或哺乳期)女性。根据纳入和排除标准,本研究共纳入90 例患者,依据治疗方式不同分为对照组(n
=45)和观察组(n
=45)。对照组予以单纯化疗,观察组予以化疗联合克唑替尼靶向治疗。两组患者的年龄、性别、病理类型等临床特征比较,差异均无统计学意义(P
﹥0.05)(表1),具有可比性。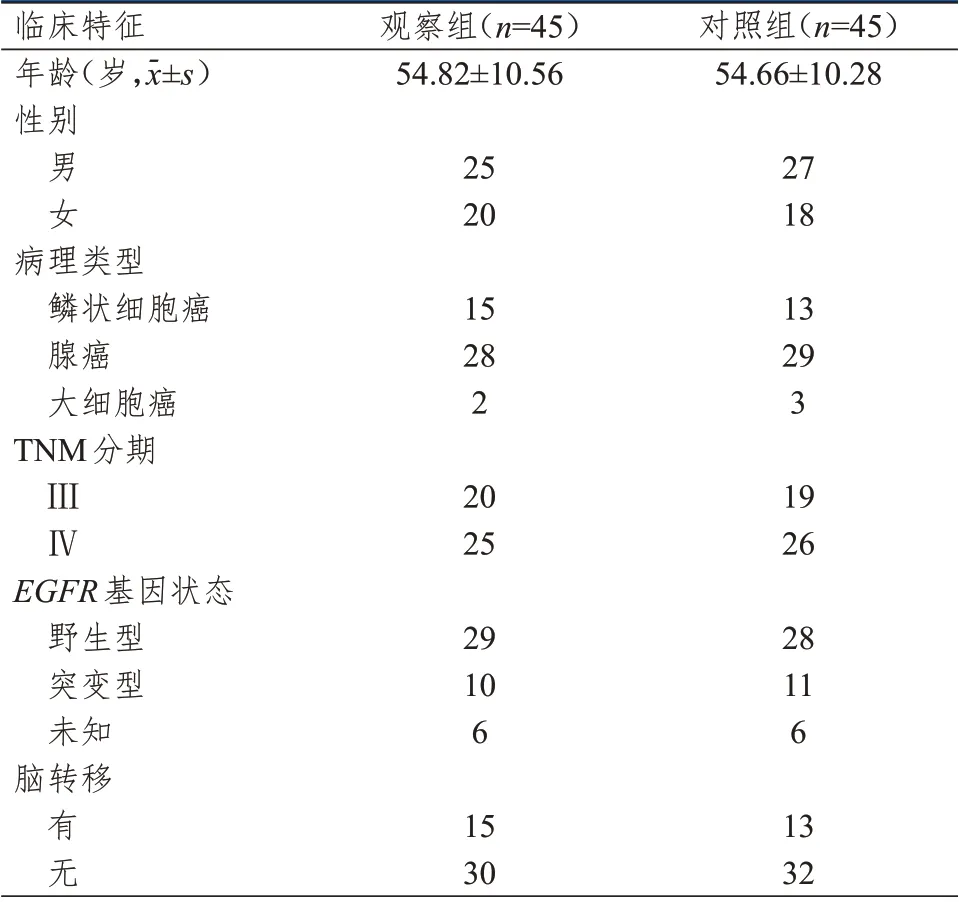
表1 两组患者的临床特征
1.2 治疗方法
对照组予以单纯化疗,均选择吉西他滨+顺铂(GP)方案化疗,于化疗开始第1 天及第8 天分别静脉滴注吉西他滨,单次剂量为1000 mg/m,用法:溶于100 ml 生理盐水中,滴注时间≤50 min。同时于化疗开始第2~4 天静脉滴注顺铂,单次剂量为25 mg/m,用法:溶于250 ml生理盐水中,滴注时间≤60 min。21 天为一个疗程,共化疗4 个疗程。
观察组予以化疗联合克唑替尼靶向治疗,即在对照组的基础上联合克唑替尼治疗,口服克唑替尼,每次250 mg,每天2 次,连用42 天。化疗方案及疗程与对照组相同。
两组患者均定期复查心电图、肝肾功能、血常规及CT 等。
1.3 随访
两组患者均随访2 年(门诊、微信或家访等形式),第1 年每个月1 次,第2 年每3 个月1 次。随访过程中无患者失访。
1.4 观察指标及评价标准
1.4.1 临床疗效 根据实体瘤疗效评价标准评价两组患者的临床疗效。完全缓解:肿瘤病灶全部消失,维持4 周及以上;部分缓解:靶病灶最大径之和减少30%及以上,并维持4 周及以上;疾病稳定:靶病灶最大径之和减少未达30%或增加未达20%;疾病进展:出现新病灶或靶病灶最大径之和增加20%及以上。疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。
1.4.2 血清肿瘤标志物 分别于治疗前后清晨6:00点抽取患者静脉血3~4 ml,采用电化学发光法检测两组患者的血清肿瘤标志物水平,包括癌胚抗原(carcinoembryonic antigen,CEA)、细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)及神经元特异性烯醇化酶(neuron specific enolase,NSE)。
1.4.3 不良反应 观察并记录两组患者的不良反应发生情况,包括恶心呕吐、腹泻、便秘、脱发、肝功能不全及视觉障碍。
1.4.4 生存情况 观察并记录两组患者治疗后1年和2 年生存情况。
1.5 统计学方法

2 结果
2.1 临床疗效的比较
治疗后,观察组患者的疾病控制率为82.22%(37/45),高于对照组的57.78%(26/45),差异有统计学意义(χ
=6.402,P
=0.011)。(表2)
表2 两组患者的临床疗效[n(%)]*
2.2 血清肿瘤标志物水平的比较
治疗前,两组患者的血清CEA、CYFRA21-1 及NSE 水平比较,差异均无统计学意义(P
﹥0.05)。治疗后,两组患者的上述指标均低于本组治疗前,且观察组患者的上述指标均低于对照组,差异均有统计学意义(P
﹤0.05)。(表3)
表3 治疗前后两组患者血清肿瘤标志物水平的比较(μg/ml,x-±s)
2.3 不良反应发生情况的比较
治疗期间观察组患者的不良反应总发生率为42.22%(19/45),与对照组患者的48.89%(22/45)比较,差异无统计学意义(χ
=0.403,P
=0.525)。(表4)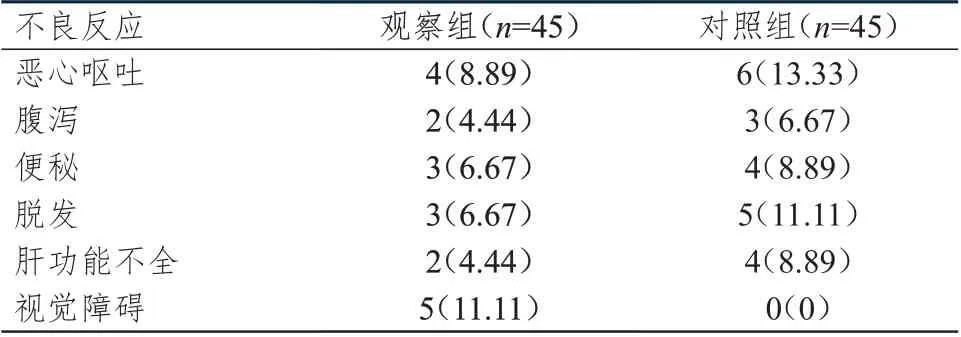
表4 两组患者的不良反应发生情况[n(%)]
2.4 生存情况的比较
观察组患者的1 年生存率为77.78%(35/45),高于对照组的57.78%(26/45),差异有统计学意义(χ
=4.121,P
=0.042);观察组患者的2 年生存率为55.56%(25/45),高于对照组的31.11%(14/45),差异有统计学意义(χ
=5.475,P
=0.019)。3 讨论
NSCLC 是一种高危恶性疾病,其病程发展至晚期可使患者出现刺激性咳嗽、咯血,进而诱发呼吸困难、声音嘶哑,部分患者可出现胸腔积液、腹部肿块及淋巴结肿大等,严重威胁人们的生命健康。临床对于晚期NSCLC常以放化疗作为主要治疗手段,但既往研究证实,放化疗治疗仅适用于局部症状可控的NSCLC,且难以获得较好疗效。此外,长期进行放化疗时,其药物的不良反应也给患者生理、心理带来沉重负担。分子靶向治疗可通过药物特异性结合致癌位点发挥抗肿瘤作用,相较于放化疗具有不良反应更少的优点。EML4-ALK 是一种新型分子靶点,在NSCLC 中的表达水平异常升高,已被证实与NSCLC 的恶性进展密切相关。因此,通过调控EML4-ALK 水平靶向作用于肿瘤基因,以抑制肿瘤的发生发展,正成为目前临床医学研究和努力的方向。
本研究结果显示,治疗后观察组患者的疾病控制率高于对照组,与梁红格等研究结果一致,表明克唑替尼联合化疗治疗ALK 阳性晚期NSCLC具有显著的临床疗效,对晚期NSCLC 的控制率更高。CEA 一般存在于正常胚胎的消化道组织中,也可微量存在于健康者的血清中,作为一种广谱肿瘤标志物,已被证实可直接反映NSCLC 病情进展、治疗效果及预后水平等。CYFRA21-1 是一种特异性肿瘤标志物,对检测、诊断NSCLC 具有重要意义。血清NSE 是神经元和神经内分泌细胞特有的一种酸性蛋白酶,在肿瘤中呈高水平表达,常被用于NSCLC 的鉴别诊断及病情监测。本研究结果显示,治疗后,两组患者的上述肿瘤标志物水平均低于对照组,表明克唑替尼可通过调节血清肿瘤标志物水平抑制NSCLC 病情发展。这主要是因为克唑替尼作为一种酪氨酸激酶受体抑制剂,可抑制NSCLC 细胞中ALK 的磷酸化进程,避免致癌蛋白的激活或失调。另外,克唑替尼可抑制肿瘤细胞G/S 期的转换速度,进而抑制肿瘤细胞的增殖、分化。此外,克唑替尼可通过抑制ALK
基因表达,调控NOTCH 信号通路中细胞凋亡分子的表达,进而促进NSCLC 细胞的凋亡。本研究还发现,观察组与对照组患者的不良反应总发生率比较无明显差异,与庄桂宝和王明元的研究结果相似,表明在传统GP 化疗方案的基础上口服克唑替尼无不良反应增加的风险,具有较好的药物安全性。但同时本研究结果显示,传统GP 化疗常见的不良反应为胃肠道不良反应及放射性损害,而给予克唑替尼治疗后11.11%的患者出现视觉障碍。克唑替尼的不良反应主要包括视觉异常、恶心、腹泻、便秘、水肿、转氨酶升高以及疲乏等,中性粒细胞减少和血小板减少较为少见。因此,在晚期NSCLC 的临床治疗中,需充分评估患者病情,精准用药用量,以降低不良反应发生率。本研究结果还显示,观察组患者的1 年生存率和2 年生存率分别为77.78%和55.56%,分别高于对照组的57.78%和31.11%,差异均有统计学意义(P
﹤0.05)。表明克唑替尼联合化疗可显著延长ALK阳性晚期NSCLC 患者的生存期,对患者预后具有积极意义。本研究的不足之处在于样本量较少以及缺乏预后因素分析,且临床资料来源单一,随访时间较短,有待于进一步的前瞻性随机对照研究加以验证。综上所述,克唑替尼联合化疗治疗ALK 阳性晚期NSCLC 的临床疗效显著,可降低血清肿瘤标志物水平,提高患者生存率,且安全性较高。

