传统凝血功能试验和血栓弹力图在弥散性血管内凝血诊断中的一致性分析
周东铭,张苏伟
汕头市中心医院检验科,广东汕头515031
弥散性血管内凝血(DIC)继发于感染性疾病、血液病、肿瘤、病理产科及创伤等多种基础疾病,病情发展快,大致分成高凝状态期、消耗性低凝期、继发性纤溶期,各期治疗的策略也不一样[1]。尽管临床表现是怀疑DIC 的重要线索,但由于分期和疾病不同,导致DIC的临床表现呈多样化。因此,临床越来越重视凝血指标在DIC 诊断评估上的价值,但仍没有一个指标能高度特异和足够敏感[2]。若指标与临床表现不一致时,需结合其他指标重新评判DIC,以便综合评估DIC 及其分期。血栓弹力图(TEG)和传统凝血功能试验(CCTs)均是评估凝血功能的相关检查,对DIC 的诊断具有重要意义。炎症和肝功能是常见的影响凝血功能的相关因素,但既往研究多未排除炎症指标和肝功能指标对凝血功能的影响。本研究对疑似DIC患者匹配炎症指标和肝功能指标后,分析TEG 和CCTs 在诊断DIC 和评估DIC低、高凝状态的一致性,为临床医师进行DIC的临床诊断及分期评估提供依据。
1 资料与方法
1.1 临床资料 选择2019 年3 月—2020 年9 月汕头市中心医院重症医学科收治的疑似DIC 患者341例。纳入标准:①具有DIC 基础诱因,如感染、肿瘤、病理产科、手术、创伤等;②存在严重出血倾向、休克、不明原因肺脑肾功能衰竭等疑似DIC 表现。排除标准:①年龄<14 岁;②合并血液疾病、原发性抗磷脂综合征;③检查前输过血液制品;④临床资料不全。患者第一次出现疑似DIC 表现时进行中国弥散性血管内凝血诊断积分系统(CDSS)评分[1],分为DIC 组91 例(CDSS 评分≥7 分)和非DIC 组250例(CDSS 评分<7 分),根据其年龄、性别、血常规中炎症和肝功能指标等基线资料,采用1∶1 最邻近匹配法(容差为0.05)进行匹配,最终得到DIC 组[男42 例、女26 例,年龄(60.69 ± 19.97)岁]、非DIC 组[男39 例、女29 例,年龄(61.48 ± 18.50)岁]各68例。两组性别、年龄、白细胞总数(WBC)、中性粒细胞(NE)、淋巴细胞计数(LY)、总胆红素(TBIL)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰胺转移酶(GGT)比较均无统计学差异(P均>0.05)。见表1。
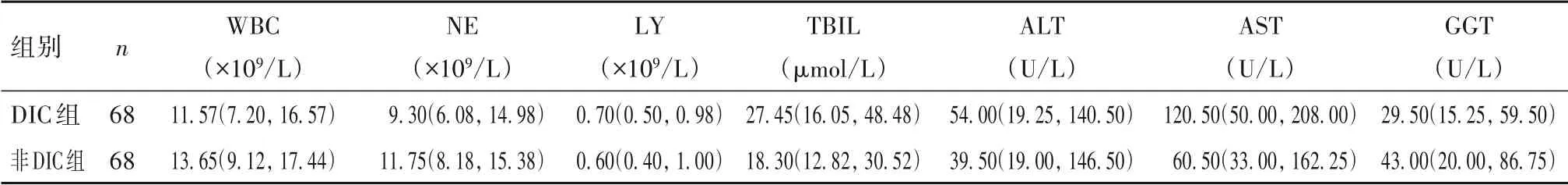
表1 资料匹配后的两组临床参数[M(P25,P75)]
1.2 CCTs 检查 抽取患者清晨空腹静脉血,使用Sysmex CS5100 全自动凝血分析仪及配套试剂进行CCTs 检查,记录血小板(PLT)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原浓度(FIB)、D-二聚体(D-D)。参照CCTs说明书,CCTs相关参数(D-D 除外)对高凝、低凝的评价标准:①PLT<125×109/L 为低凝,>350×109/L 为高凝;②PT>16.2 s 为低凝,<9.4 s 为高凝;③APTT>48 s 为低凝,<22.5 s为高凝;④FIB<1.8 g/L为低凝,>4.88 g/L为高凝。
1.3 TEG检查 抽取患者清晨空腹静脉血,使用乐普西芬斯血栓弹力图仪(CFMS LEPU 8880)及其配套试剂进行TEG 检查。在样品测定杯中加入CaCl2及促进剂,通过测定血液开始凝固后杯体和杯盖间产生的切应力,描绘出血块强度随时间变化的曲线。记录凝块反应时间(R)、凝块形成时间(K)、凝固角(Angle)、血栓最大振幅(MA),R 为从开始至曲线幅度开口到2 mm 的时间、K 为血凝块强度到20 mm 的时间、Angle 为纤维蛋白形成及相互联结的速度、MA 为曲线上两侧之间的最宽距离。参照TEG 说明书,TEG 相关参数对高凝、低凝的评价标准:①R>10 min 为低凝,<5 min 为高凝;②K>3 min为低凝,<1 min 为高凝;③Angle<53°为低凝,>72°为高凝;④MA<50 mm为低凝,>70 mm为高凝。
1.4 统计学方法 采用SigmaPlot12.5 和Stata12.0统计软件。符合正态分布的计量资料以±s表示,组间比较采用t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验Mann-WhitneyU检验。绘制CCTs 和TEG 相关指标诊断DIC 的ROC 曲线,采用Delong法比较曲线下面积(AUC)。采用Kappa值评估CCTs和TEG 相关参数评价DIC组患者低、高凝状态的一致性,Kappa 值<0.4 表示一致性较差,0.4~0.75表示一致性一般,>0.75表示一致性较好。P<0.05为差异有统计学意义。
2 结果
2.1 两组CCTs 相关指标比较 DIC 组PLT、FIB 均低于非DIC 组,PT、APTT、D-D 均高于非DIC 组(P均<0.05)。见表2。

表2 两组CCTs相关指标比较[M(P25,P75)]
2.2 两组TEG相关指标比较 DIC组R、K均高于非 DIC组,Angle、MA均低于非DIC组(P均<0.05)。见表3。

表3 两组TEG相关指标比较[M(P25,P75)]
2.3 CCTs和TEG相关指标诊断DIC的ROC曲线分析结果 PLT、PT、APTT、FIB、D-D 诊断DIC 的AUC分别为0.78、0.77、0.79、0.60、0.77,R、K、Angle、MA 诊断DIC 的AUC 分别为0.63、0.72、0.68、0.72;R 与PT、APTT、PLT、D-D 的AUC 比较,K、MA 与FIB的AUC 比较,Angle 与APTT 的AUC 比较,差异均有统计学意义(P均<0.05)。
2.4 CCTs 和TEG 相关指标评价DIC 患者低、高凝状态的一致性分析结果 APTT 与R,FIB 与MA,在评估DIC 低凝状态时具有一致性(P均<0.05),其他均不具有一致性(P均>0.05);FIB 与R 在评估高凝状态时具有一致性(P<0.05),其他均不具有一致性(P均>0.05)。本研究中有统计学意义的Kappa 值均<0.4,一致性较差。见表4。
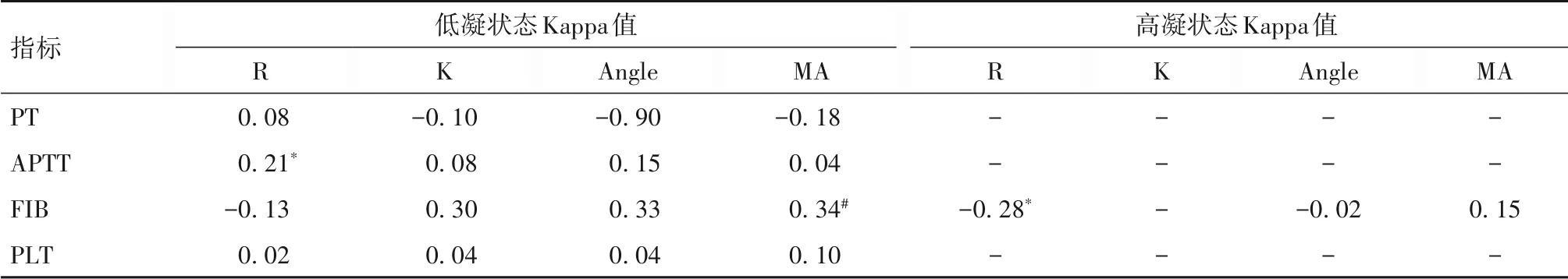
表4 CCTs和TEG相关指标评价DIC患者低、高凝状态的一致性分析结果
3 讨论
DIC 病情凶险,尽早诊断、评估低高凝状态能极大改善患者预后,但如何确诊及评估凝血状态仍是临床的一大挑战。CDSS 评分于2017 年发布,突出了疾病和临床表现的重要性。尽管有CDSS 评分指标本地化代替国际血栓与止血委员会DIC 评分标准,但该评分仍有待补充完善,临床诊疗行为中也需要其他实验室指标协助,以便更充分掌握DIC 全貌和分期。 CCTs 包括PT、APTT、FIB、D-D 和PLT。PLT 是常用止凝血功能检查项目之一,反映了机体出血倾向,PT、APTT、FIB、D-D 是基于瀑布学说对凝血纤溶进程的分阶段检测,PT、APTT 分别检测外、内源性凝血系统,FIB 和D-D 则是纤维蛋白阶段的检测[3]。TEG可体外动态模拟凝血纤溶过程[4]。
理想的止凝血功能试验应该能准确反映机体凝血纤溶状态,但现实中常受到其他因素影响,如炎症、肝功能等,均会导致DIC的假阳性率。炎症与感染级联交叉,可导致凝血功能障碍,也会导致凝血指标及DIC 评分的升高,而此时患者可能尚未发生DIC[6-8]。肝脏能合成、降解凝血相关物质,患者肝病程度的不同使得肝细胞也会发生不同程度的受损或坏死,导致部分凝血因子合成减少,从而打乱凝血和抗凝平衡机制[9];专家共识也特别提出DIC 要与严重肝病鉴别诊断,以免造成误判[1]。血常规中WBC、NE、LY 是最常用的炎症指标,感染炎症时WBC 升高,NE 随之发挥免疫防御作用,LY 则通过分泌抗体抵御感染。TBIL、ALT、AST、GGT 是常用于评估肝脏受损程度的灵敏指标。本研究通过匹配DIC组和非DIC 组的性别、年龄、WBC、NE、LY、TBIL、ALT、AST、GGT 等基线水平,使回顾性实验接近随机实验结果,基本可以还原DIC 患者本身凝血指标的真实水平。本研究结果显示,匹配后的DIC 组PLT、FIB、Angle、MA 均明显低于非DIC 组,PT、APTT、D-D、R、K均明显高于非DIC组,与王影等[5]的结果一致。
本研究结果显示,K 和MA 对DIC的诊断性能与CCTs 相关指标(除了FIB)接近,而FIB 和R 的诊断性能在各自组合中是最低的。AUC 为0.5~0.7 提示诊断性能较低,>0.7~0.9 提示诊断性能为中等,可见单项K、MA 和PT、APTT、D-D、PLT 对DIC 的诊断性能均为中等,而FIB、R、Angle 对DIC 的诊断性能较低。针对目前的临床需求,CCTs 仍是诊断DIC的常用方法,且操作简便易行。从本研究结果可以看出,CCTs 的大部分单项指标诊断DIC 的AUC 较大,诊断性能中等。以往有报道显示,TEG 指标对DIC 的诊断优于CCTs 指标,这可能跟DIC 评分标准不同有关[10]。
D-D 作为交联纤维蛋白降解的特征性产物,一般用于纤溶系统的评估,不用于凝血系统的评估;但其是CDSS 评分的一个实验室指标,因此本研究只观察了D-D 对DIC 的诊断价值,并未观察其与TEG检查指标评估低、高凝状态的一致性。本研究结果显示,APTT 和R、FIB 和MA 在评估DIC 低凝状态时具有一致性,FIB 和R 在评估高凝状态时具有一致性,其他均不具有一致性;且有统计学意义的Kappa值均<0.4,表明一致性较差。提示TEG 作为评价凝血功能的新型实验室方法,对DIC低、高凝状态的评估与CCTs存在很多不一致的地方,即使有一致性的地方,一致性程度均很低,这与之前报道接近[11]。笔者认为可能与以下几点有关:①TEG 是以细胞学为基础的全血标本检测,而CCTs 中的PT、APTT、FIB、D-D 检测均使用血浆,只有PLT 是全血标本检测;②TEG 综合了凝血激活、纤维蛋白形成及最后纤溶的全部影响,而CCTs是凝血纤溶过程中的分段量化再相加;③CCTs 能反映内皮损伤引起凝血因子的改变,而TEG 则无法监测内皮细胞损伤。本研究DIC患者经 匹 配 后,PLT 均<350×109/L,PT 均>9.4 s,APTT 均>22.5 s,K 均>1 min,即K、PLT、PT 和APTT在DIC 患者中无法评估高凝状态;因此,CCTs 中只有FIB 能够评估DIC 的高凝状态,而TEG 中有R、Angle、MA 三个单项指标可以评估。以往报道结果显示,创伤后呈高凝状态的患者,其CCTs 指标可能均无异常,容易造成误诊[12]。也有研究显示,DIC 分期治疗能够显著改善患者预后,TEG 比CCTs更能准确评估DIC 患者的高凝状态,更有助于临床全面评估DIC[13-14]。
综上所述,CCTs 和TEG 对DIC 的诊断性能接近,但评估DIC 患者凝血状态时的一致性较低;CCTs 是诊断DIC 的第一选择,在分期时要兼顾TEG进行全面评估。本研究排除炎症和肝功能的影响后,TEG 中的K 和MA 对DIC 的诊断性能不比CCTs低,且在高凝状态评估上MA 还能协助评估分期,这提示我们应重视MA 的临床价值。又因为DIC 囊括了出血、凝血、纤溶的相互影响,在不同阶段对各参数的影响不一,机体代偿反应也不一样,因此有必要重视TEG 与CCTs 临床价值的差异,互相补充完善,这对DIC分期的全面评估无疑是有益处的。本研究局限性在于单中心研究,未纳入C 反应蛋白等其他炎症指标和白蛋白等其他肝功能指标进行评估,有待进一步完善。

