阿法骨化醇治疗儿童过敏性紫癜的前瞻性随机对照研究
付强 石明芳 陈颖
(宜宾市第一人民医院儿科,四川宜宾 644000)
过敏性紫癜(Henoch‐Schönlein purpura,HSP)是一种以免疫复合物介导的全身系统性小血管炎为主要病理改变的自身免疫性疾病,好发于3~14岁的儿童,临床表现主要包括:非血小板减少性可触性皮肤紫癜、腹痛、消化道出血、关节肿痛并伴有活动障碍及肾脏受累等[1]。HSP病程常呈自限性,但易复发,部分病例病情迁延,少数可发 展 为 紫 癜 性 肾 炎 (Henoch‐Schönlein purpura nephritis,HSPN)、慢性肾脏疾病甚至肾功能不全,2%的患儿最终发展为终末期肾病,其预后主要取决于肾脏是否受累及肾脏损害的严重程度[2]。目前,HSP的病因及发病机制尚未完全明确,可能与感染、炎症、免疫紊乱和基因多态性等密切相关[3]。研究表明,维生素D除了调节钙磷代谢、促进骨的矿化等作用外,还能通过多种途径调节免疫功能及炎症反应,维生素D缺乏与支气管哮喘、反复呼吸道感染、1型糖尿病及某些自身免疫病的发生发展有一定关系[4]。25羟基维生素D3[25‐(OH)D3]是维生素D在血液中的主要存在形式,稳定性好且半衰期较长,能有效反映体内维生素D的水平。研究证实,HSP患儿存在低水平25‐(OH)D3状态,合并消化道、关节症状及HSPN者更为显著,25‐(OH)D3水平下降可能预测HSP是否合并其他系统损害[5]。但补充维生素D对HSP有无治疗作用,能否缩短病程,改善远期预后仍无定论。阿法骨化醇是一种活性维生素D类似物,与维生素D结合蛋白亲和力强,在肝脏经肝微粒体羟基化酶作用后形成具有活性的1,25‐(OH)2D3而发挥作用。本研究将阿法骨化醇应用于HSP患儿中,以观察其对免疫功能预后的影响。
1 资料与方法
1.1 一般资料
前瞻性选取2018年6月至2020年6月宜宾市第一人民医院儿科收治的诊断为HSP的患儿200例为研究对象。纳入标准:所有病例均符合《诸福堂实用儿科学》第8版[6]中HSP的诊断标准;所有患儿均为首次发病且为初诊;病程<2周;年龄<14岁;近4周未服用过肝素、抗过敏药物、糖皮质激素或免疫抑制剂等;近6个月内未补充维生素D及其类似物者。排除标准:严重消化道出血需较长时间禁食或外科手术干预者;存在高钙血症、高磷酸盐血症、高镁血症;既往合并自身免疫性疾病、风湿性疾病、遗传代谢性疾病、免疫缺陷性疾病;合并慢性肝肾及消化道疾病或肝肾功能异常;合并严重感染;其他原因引起的皮肤紫癜;对本研究所使用的药物有过敏史或过敏反应。入院时根据患儿病情进行分型(无论有无肾损害):单纯型:仅有皮肤紫癜,无其他脏器受累证据;腹型:皮肤紫癜伴有腹痛、呕吐、腹泻、便血等消化道症状;关节型:皮肤紫癜伴有关节肿、痛或活动受限;混合型:皮肤紫癜伴有消化道及关节症状。在HSP病程6个月内,患儿出现血尿和/或蛋白尿,符合中华医学会儿科学分会肾脏病学组《紫癜性肾炎诊治循证指南(2016)》[7]中的标准诊断,则诊断为HSPN。所有患儿按照随机数字表法分为观察组及对照组各100例。患儿家长均签署知情同意书,本研究经医院伦理委员会审核通过。
1.2 方法
对照组给予维生素C、芦丁片、双嘧达莫、西咪替丁、钙剂等治疗,有急性期呼吸道及胃肠道等感染者给予抗感染治疗,急性期合并消化道及关节症状者加用醋酸泼尼松片口服1周,剂量为每日1 mg/kg,1周后减量,疗程2~4周。肾脏受累患儿若为非肾病水平蛋白尿给予糖皮质激素治疗6个月,肾病水平蛋白尿、肾病综合征患儿予以激素联合环磷酰胺治疗。观察组在对照组基础上加用阿法骨化醇软胶囊(批准文号:国药准字H20000065,生产企业:南通华山药业有限公司)0.25μg/d,睡前口服,疗程4周。在服用阿法骨化醇治疗的过程中,至少每周进行1次血钙和尿钙水平的检测。如果在服用期间出现高血钙或高尿钙,立即停止服用阿法骨化醇。
1.3 观察指标
于治疗前及治疗4周后留取患儿静脉血:(1) 采用ELISA法检测血清25‐(OH)D3水平;(2)采用流式细胞仪检测两组患儿治疗前后的CD3+、CD4+、CD8+等T淋巴细胞亚群指标及NK细胞百分率。(3)采用ELISA双抗体夹心法检测血清白细胞介素 (interleukin,IL) ‐6、IL‐17、IL‐21、肿瘤坏死因子‐α(tumor necrosis factor,TNF‐α)水平进行比较。随访6个月,统计患儿复发次数及6个月内的肾损害发生率(不包括入院时已合并肾损害患儿)。
1.4 统计学分析
采用SPSS21.0统计软件对数据进行统计学分析,符合正态分布的计量资料用均数±标准差(±s)表示,两组间比较采用两样本t检验;计数资料用频数或百分率(%)表示,两组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料
随访过程中,观察组失访3例,对照组失访2例,最终纳入观察组97例,对照组98例,随访6~12个月。两组性别、年龄、入院时病程、分型、是否合并肾损害、是否使用糖皮质激素等指标比较,差异无统计学意义(P>0.05)。见表1。
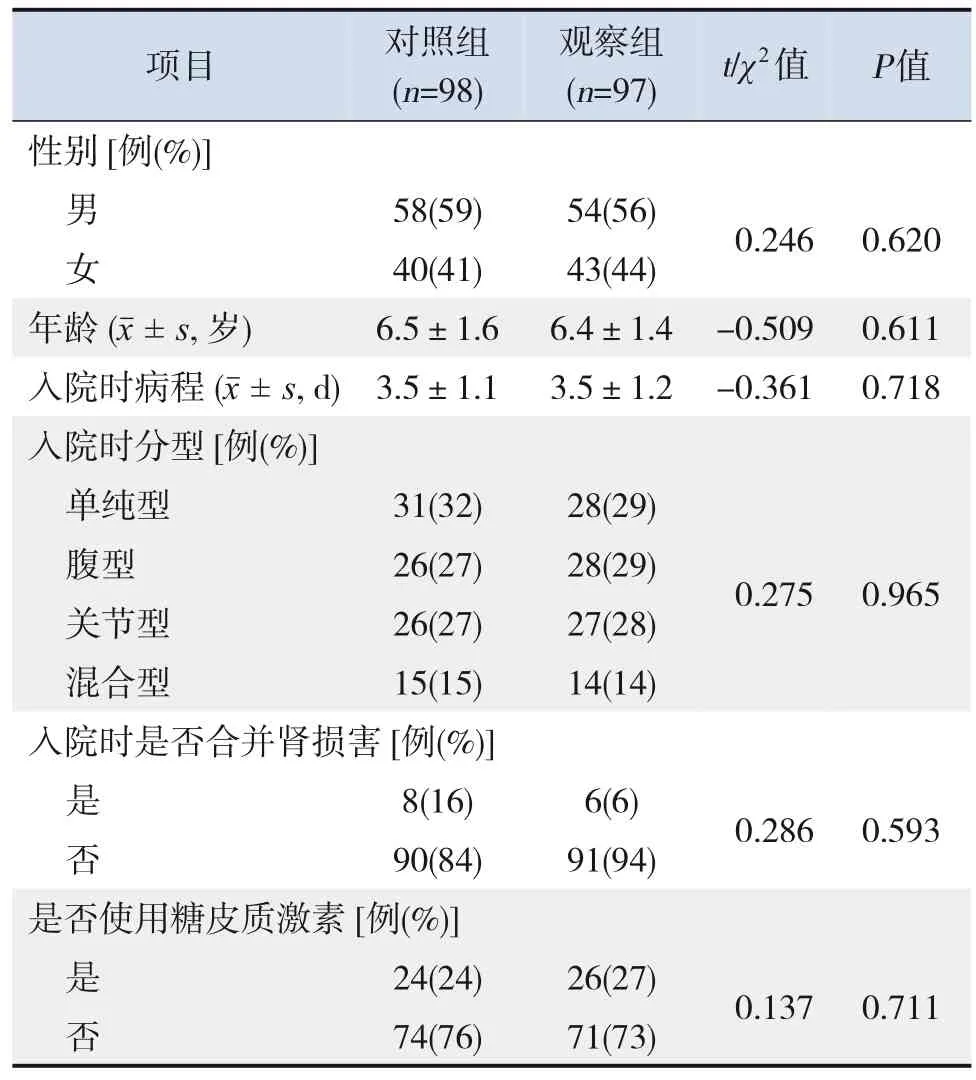
表1 两组临床资料比较
2.2 两组治疗前后25‐(OH)D3水平变化
治疗前,观察组25‐(OH)D3水平与对照组比较,差异无统计学意义(P>0.05);治疗后,观察组25‐(OH)D3水平高于本组治疗前(P<0.05),对照组25‐(OH)D3水平与本组治疗前比较,差异无统计学意义(P>0.05);治疗后,观察组25‐(OH)D3水平高于对照组(P<0.05)。见表2。
表2 两组治疗前后25‐(OH)D3水平比较(±s,ng/mL)
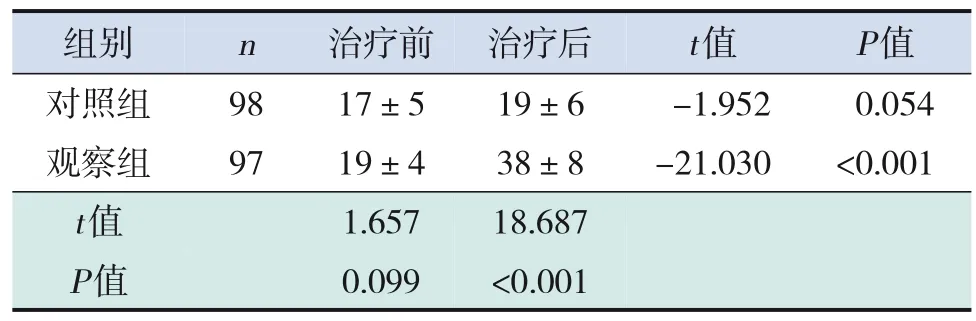
表2 两组治疗前后25‐(OH)D3水平比较(±s,ng/mL)
组别n治疗前 治疗后t值P值对照组9817±519±6-1.9520.054观察组9719±438±8-21.030<0.001 t值1.65718.687 P值0.099<0.001
2.3 两组治疗前后T淋巴细胞亚群和NK细胞水平变化
治疗前,两组CD3+、CD4+、CD8+和NK细胞水平比较,差异均无统计学意义(P>0.05)。治疗后,两组CD8+水平与本组治疗前比较,差异无统计学意义(P>0.05);且观察组CD8+水平与对照组比较,差异无统计学意义(P>0.05)。治疗后,对照组CD3+、CD4+和NK细胞水平与本组治疗前比较差异均无统计学意义(P>0.05)。治疗后,观察组CD3+、CD4+和NK细胞水平均高于本组治疗前(P<0.05);且观察组CD3+、CD4+和NK细胞水平均高于对照组(P<0.05)。见表3。
表3 治疗前后两组T淋巴细胞亚群和NK细胞水平比较 (±s,%)
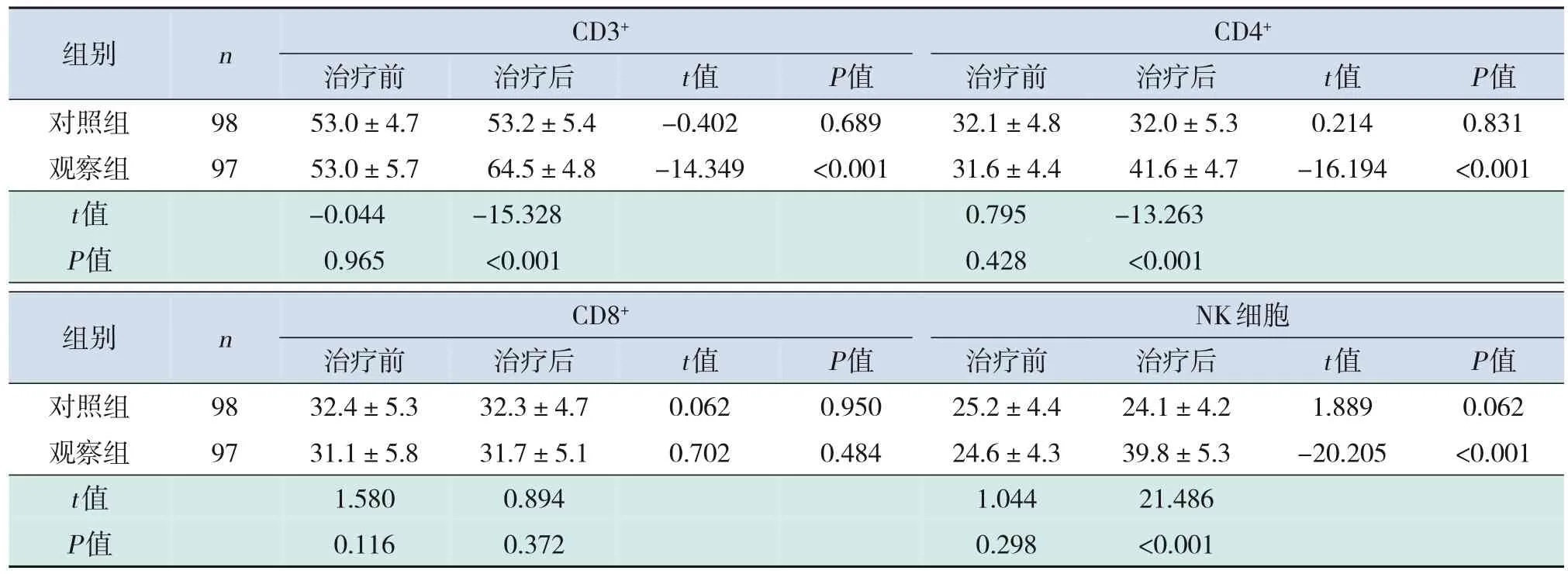
表3 治疗前后两组T淋巴细胞亚群和NK细胞水平比较 (±s,%)
组别nCD3+CD4+治疗前 治疗后t值P值 治疗前 治疗后t值P值对照组9853.0±4.753.2±5.4-0.4020.68932.1±4.832.0±5.30.2140.831观察组9753.0±5.764.5±4.8-14.349<0.00131.6±4.441.6±4.7-16.194<0.001 t值-0.044-15.3280.795-13.263 P值0.965<0.0010.428<0.001组别nCD8+NK细胞治疗前 治疗后t值P值 治疗前 治疗后t值P值对照组9832.4±5.332.3±4.70.0620.95025.2±4.424.1±4.21.8890.062观察组9731.1±5.831.7±5.10.7020.48424.6±4.339.8±5.3-20.205<0.001 t值1.5800.8941.04421.486 P值0.1160.3720.298<0.001
2.4 两组治疗前后炎性因子水平变化
治疗前,两组IL‐6、IL‐17、IL‐21、TNF‐α 水平比较,差异无统计学意义(P>0.05)。治疗后,两组IL‐6、IL‐17、IL‐21、TNF‐α水平均低于本组治疗前 (P<0.05);且观察组IL‐6、IL‐17、IL‐21、TNF‐α水平均低于对照组(P<0.05)。见表4。
表4 治疗前后两组炎性因子水平比较 (±s)
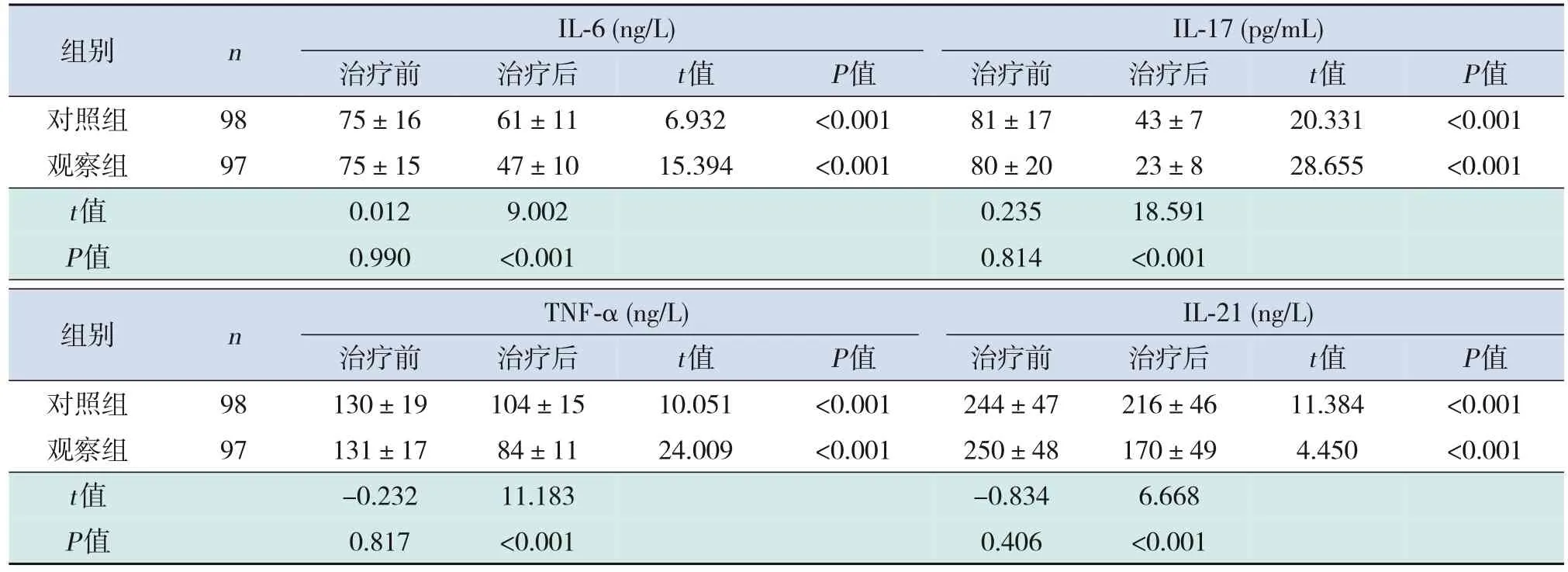
表4 治疗前后两组炎性因子水平比较 (±s)
注:[IL]白细胞介素;[TNF‐α]肿瘤坏死因子‐α。
组别nIL‐6(ng/L)IL‐17(pg/mL)治疗前 治疗后t值P值 治疗前 治疗后t值P值对照组9875±1661±116.932<0.00181±1743±720.331<0.001观察组9775±1547±1015.394<0.00180±2023±828.655<0.001 t值0.0129.0020.23518.591 P值0.990<0.0010.814<0.001组别nTNF‐α(ng/L)IL‐21(ng/L)治疗前 治疗后t值P值 治疗前 治疗后t值P值对照组98130±19104±1510.051<0.001244±47216±4611.384<0.001观察组97131±1784±1124.009<0.001250±48170±494.450<0.001 t值-0.23211.183-0.8346.668 P值0.817<0.0010.406<0.001
2.5 两组随访6个月内复发率及肾损害发生率情况
随访6个月内,观察组复发率及肾损害发生率均低于对照组(P<0.05),见表5。
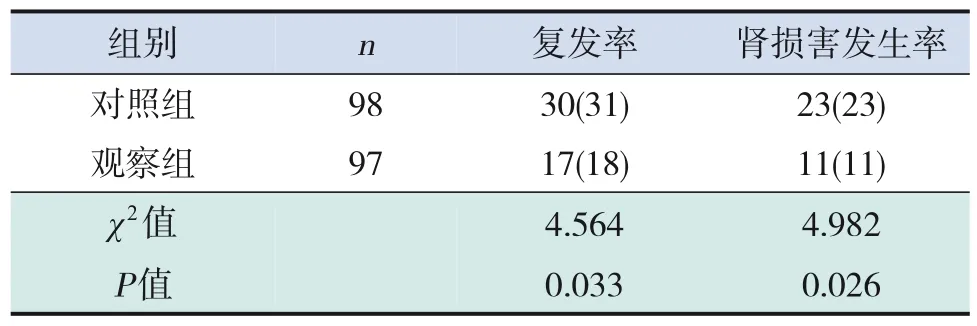
表5 两组6个月内复发率及肾损害发生率比较[例(%)]
3 讨论
HSP是儿童时期常见的血管炎性疾病,以非血小板减少性皮肤出血性皮疹、腹痛、胃肠道出血、关节炎及肾脏损害为临床特征。在我国,HSP每年的发病率为(11.8~13.4)/10万,且有增长趋势[8]。HSP病情易反复,其中约20%~55%的患儿出现肾脏受累即HSPN,HSPN中约15%~20%进展至终末期肾病[9]。HSP的病因及发病机制尚未阐明,可能与感染、疫苗接种、食物、药物及遗传因素有关,主要发病机制可能为B细胞多克隆增殖致IgA及免疫复合物异常释放增多、补体激活,沉积于全身小血管壁,导致炎症反应。另外,T细胞功能紊乱,细胞因子、黏附因子异常表达和炎性介质释放增加也参与其中[10]。
维生素D是一种多效类固醇激素,其主要生理作用是调节钙磷代谢,促进骨骼健康和维持神经肌肉功能。25‐(OH)D3是维生素D在体内的主要贮存形式,可反映体内维生素D的营养状态。25‐(OH)D3经羟化形成的1,25‐(OH)2D3是维生素D的主要活性代谢物,与组织中广泛存在的维生素D受体结合而发挥作用。随着维生素D受体和25‐(OH)D‐1‐α羟化酶在骨外组织尤其是免疫细胞中被发现,维生素D在自身免疫病、恶性肿瘤、心血管疾病、糖尿病等中的作用被逐渐重视,维生素D对固有免疫及适应性免疫的调控作用已被证实[11]。
T淋巴细胞是参与机体细胞免疫的主要效应细胞,同时还能通过分泌各种细胞因子调节体液免疫。CD3是成熟T细胞特有的表面标志,可分为CD4+T细胞和CD8+T细胞两个亚群。NK细胞能够与辅助性T细胞膜上的CD4+发生免疫黏附,激活巨噬细胞,增强T细胞免疫效应。林珊等[12]研究发现,HSP患儿CD3+、CD4+及NK细胞水平明显下降,CD4+/CD8+比值显著下降。谭琼等[2]研究表明,维生素D联合西咪替丁可提高HSP患儿CD3+、CD4+及NK细胞水平并降低CD8+水平。Th1/Th2失衡、Treg/Th17失衡、Th2和Th17异常激活都与HSP及HSPN的发病有关[13]。研究认为,维生素D能促使CD4+T细胞分化为Th2,上调Th2活性,促进Th2分泌IL‐4、IL‐5和IL‐10,抑制Th1产生IL‐2和IFN‐γ并促进Th1细胞向Th2细胞转化,限制Th1引起的免疫反应[14]。研究发现,HSP患儿Th17水平较正常对照组高,且Treg水平较低,而Th17可分泌促炎因子IL‐17,IL‐17通过诱导内皮细胞、上皮细胞、成纤维细胞等分泌IL‐6、TNF‐α、IL‐1β等炎性因子,参与并扩大炎性反应[15]。吴敏等[16]研究表明,HSP患儿补充阿法骨化醇,可有效降低Th17细胞比例并提高Treg细胞比例,部分纠正Th17/Treg细胞失衡。IL‐21来源于CD4+T淋巴细胞、滤泡辅助型T细胞(follicular helper Tcells,Tfh细胞)及NK细胞,可调节T、B及NK细胞的活化和增殖,促进Th17的分化并抑制Treg介导的免疫反应[17]。Xie等[18]研究发现,HSP患儿中IL‐21及IL‐6等Tfh细胞相关细胞因子明显升高。邹敏书等[19]研究表明,维生素D可降低Tfh细胞百分率及IL‐21水平。阿法骨化醇是维生素D活性衍生物,口服后由肠道迅速吸收入血,在肝内转化为具有活性的1,25‐(OH)2D3,与分布于骨及其他靶组织内的受体结合而发挥作用。本研究结果表明,治疗后,观察组25‐(OH)D3水平高于对照组;观察组CD3+、CD4+和NK细胞水平高于对照组;观察组IL‐6、IL‐17、IL‐21、TNF‐α 水平低于对照组。随访6个月,观察组复发人次及肾损害发生率低于对照组。结果提示,对HSP患儿加用阿法骨化醇治疗4周,可明显提高患儿体内25‐(OH)D3水平,改善细胞免疫功能及炎性因子水平,降低复发及肾损害发生率。
综上所述,对HSP患儿加用阿法骨化醇,能提高血清25‐(OH)D3水平并改善细胞免疫功能及炎症因子水平,降低复发及肾损害发生率。本研究样本量较少,可能导致结果偏倚,维生素D制剂对HSP患儿的影响,还需长期随访及大样本、多中心的研究来进一步证实。

