近红外光谱技术对有血流动力学意义的动脉导管未闭早产儿肠道组织氧饱和度监测价值的前瞻性研究
黄循斌 钟晓 刘婷 程国强 丘惠娴
(1.深圳市龙岗中心医院新生儿科,广东深圳 518116;2.复旦大学附属儿科医院新生儿科,上海 201102)
动脉导管未闭(patent ductus arteriosus,PDA)是早产儿常见的心脏异常,胎龄(gestational age,GA)越小,出生体重(birth weight,BW)越低,其发生率越高[1]。PDA发生率在GA<32周的早产儿中约30%,在极低出生体重儿中约25%,在超低出生体重儿中高达40%~60%[2]。当动脉导管(ductus arteriosus,DA)左向右分流量增加,超过体循环的50%时,可出现肺血流增多,体循环血流减少,引起体循环各脏器灌注减少,出现显著的血流动力学变化,称为有血流动力学意义的PDA(hemodynamically significant patent ductus arteriosus,hsPDA)[3-5]。极低出生体重儿由于肠道功能发育不成熟,肠道血流自主调节功能差,血流动力学变化明显时易导致潜在的肠道缺血缺氧[6-7]。超声是目前检测脉管血流灌注的常用技术,但不能连续监测,亦不能及时反映组织氧供应和消耗情况。近红外光谱技术(near‐infrared spectroscopy,NIRS)是一种无创、实时性地监测局部组织氧饱和度(regional oxygen saturation,rSO2)的技术,可连续监测组织灌注及微循环功能,同时监测局部组织氧合情况[8]。目前,尚未有前瞻性研究hsPDA对早产儿肠道组织氧合的影响。本研究利用NIRS持续监测hsPDA早产儿肠道组织rSO2在诊断后及治疗后随时间的变化趋势,初步探索NIRS技术行肠道组织rSO2监测在指导临床治疗hsPDA及预防肠道损伤中的作用。
1 资料与方法
1.1 研究对象
选择2017年10月至2020年10月在深圳市龙岗中心医院新生儿科住院的PDA早产儿为研究对象。纳入标准:(1)GA<32周和/或BW<1 500 g;(2)日龄3~14 d;(3)研究对象父母知情同意加入本研究。排除标准:(1)喂养不耐受或坏死性小肠结肠炎者;(2)败血症者;(3)重度以上贫血(血红蛋白<90 g/L)或48 h内有输血史者;(4)宫内生长受限者和小于胎龄儿;(5)先天性疾病者(染色体异常、胃肠道先天性畸形、引起血流动力学不稳的心脏疾病、腹疝等)。
本研究通过深圳市龙岗中心医院医学伦理委员会批准(批准文号:2017ECYJ079),并获得患儿监护人知情同意。
1.2 诊断标准
hsPDA的诊断标准是指符合以下6项临床表现中的3项及3项超声心动图标准[9]。6项临床表现:(1)胸骨左缘闻及收缩期或连续性杂音;(2)心前区搏动增强;(3)水冲脉;(4)安静时心率>180次/min;(5)无法解释的呼吸状况恶化;(6)胸片显示肺血管影增多及心脏扩大,或肺水肿征象。3项超声心动图诊断标准:(1)DA直径≥1.5 mm;(2)左心房内径/主动脉根部内径(left atrial/aortic root diameter,LA/AO)≥1.5;(3)降主动脉舒张期血流倒置。
1.3 治疗方案
hsPDA早产儿在肠道组织rSO2下降趋于稳定时给予口服布洛芬混悬滴剂(规格:15 mL∶0.6 g,批号:190413198,上海强生制药有限公司)。剂量:首剂10 mg/kg,第2、3剂5 mg/kg,每次间隔24 h,疗程3 d。
1.4 分组
根据hsPDA的诊断标准将PDA早产儿分为hsPDA组和无血流动力学意义的动脉导管未闭(non‐hemodynamically significantpatentductusarteriosus,nhsPDA)组。将hsPDA组早产儿根据布洛芬治疗后动脉导管关闭情况分为hsPDA关闭亚组和hsPDA未闭亚组。
1.5 NIRS监测
采用苏州爱琴生物医疗电子有限公司EGOS‐600A近红外光谱监测仪,获《中华人民共和国医疗器械注册证》(注册证编号:苏械注准20142210631)。工作原理为利用波长700~900 nm的近红外光对人体组织有良好的穿透性,而人体组织对该段光的吸收主要源于微细血管血液中还原血红蛋白和氧合血红蛋白两种吸收体,利用两者吸收谱的差异,通过修正的双波长朗伯-比尔定律,可求出组织中血红蛋白浓度随时间的变化量,从而得到rSO2,反映局部组织氧合情况[10]。监测方法:患儿取仰卧位,肠道组织rSO2测量时将B型探头(探测深度1~1.5 cm)放置在新生儿腹中线,脐下0.5~1 cm位置,用3M透明敷料固定避免漏光。NIRS监测仪每2 s采集1次肠道组织rSO2数据,数值相对稳定(波动不超过2%)保持5 min左右,取双侧平均值,重复上述过程3次,取3次的平均值作为测量当时患儿的肠道组织rSO2。
1.6 血流动力学指标测定
选用飞利浦IE33多功能超声诊断仪,以及配套的心脏超声探头。对入组早产儿在出生后3~7 d,每间隔24 h进行床旁超声心动图检查,若存在动脉导管开放,同时监测其血流动力学指标。对hsPDA组患儿口服布洛芬治疗结束24 h后复查超声心动图,同时监测其血流动力学指标。血流动力学指标包括导管底部最窄处测量DA直径、LA/AO、舒张期降主动脉血流量、左室射血分数(left ventricular ejection fraction,LVEF)、短轴缩短率(fractional shortening,FS),上述指标均进行5个心动周期的测量,并对测量结果取平均值。
1.7 统计学分析
采用SPSS22.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用两样本t检验;偏态分布的计量资料以中位数(范围)表示,组间比较采用Mann‐WhitneyU秩和检验;计数资料以例数和百分率(%)表示,组间比较采用χ2检验。对重复测量的计量资料采用重复测量设计资料的方差分析,不符合球形分布假设时采用Greenhouse‐Geisser方法进行校正,对于存在交互效应的结果进行单独效应检验,组间两两比较采用Bonferroni法,取校正后P值。P<0.05为差异有统计学意义。
2 结果
2.1 患儿基本信息
符合纳入标准的病例共268例,其中18例患儿出生7 d内放弃治疗,9例资料不全,被剔除出研究组,最终241例PDA早产儿纳入研究组。241例PDA早产儿的GA和BW分布情况如下:GA<26周13例(5.4%),26~27+6周29例(12.0%),28~29+6周66例(27.4%),30~31+6周133例(55.2%);BW<750 g 18例 (7.5%),750~<1 000 g 31例(12.9%),1 000~<1 250 g 69例(28.6%),1 250~<1 500 g 123例(51.0%)。hsPDA组55例,nhsPDA组186例,2组患儿GA、BW、性别、机械通气、1 min和5 min Agpar评分比较,差异均无统计学意义(P>0.05),见表1。
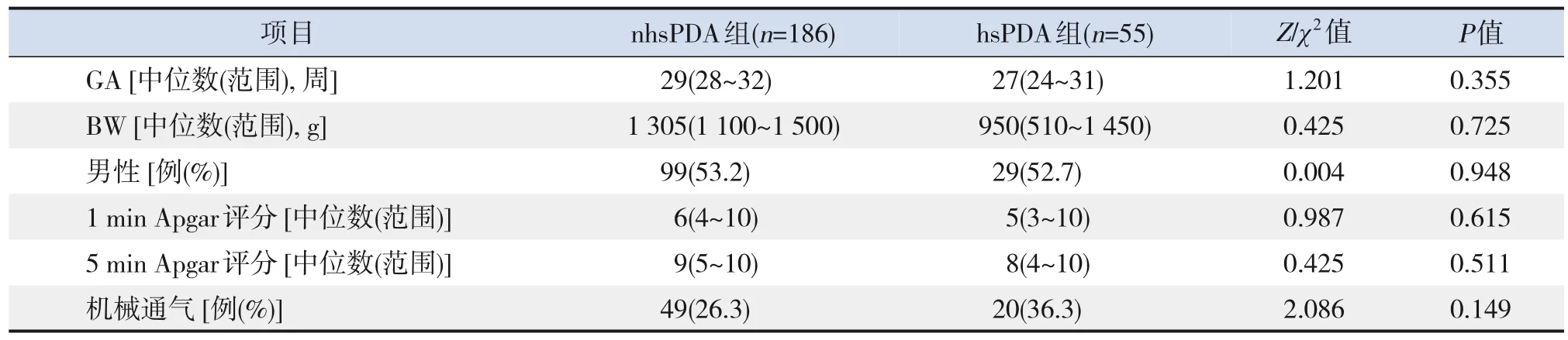
表1 hsPDA组与nhsPDA组早产儿的基本情况比较
2.2 hsPDA组与nhsPDA组早产儿血流动力学指标比较
hsPDA组LA/AO值和DA直径均大于nhsPDA组(P<0.001),hsPDA组LVEF值和FS值均低于nhsPDA组(P<0.001),见表2。
表2 hsPDA组与nhsPDA组早产儿在诊断时血流动力学指标比较 (-±s)
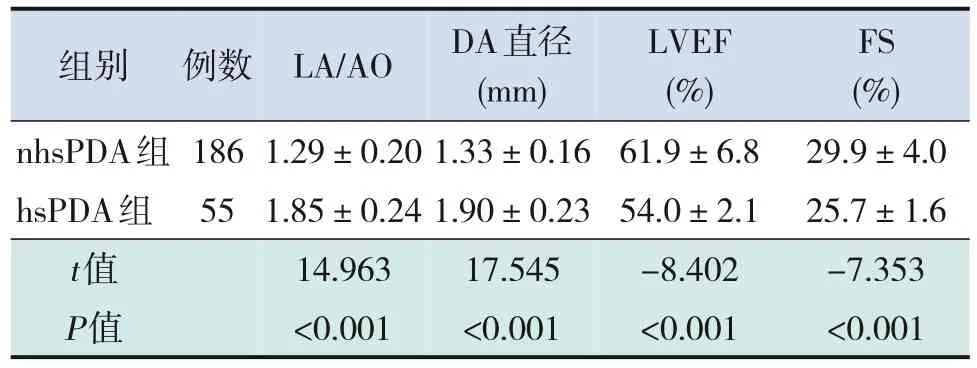
表2 hsPDA组与nhsPDA组早产儿在诊断时血流动力学指标比较 (-±s)
注:[hsPDA]有血流动力学意义的动脉导管未闭;[nhsPDA]无血流动力学意义的动脉导管未闭;[LA/AO]左心房内径/主动脉根部内径;[DA]动脉导管;[LVEF]左室射血分数;[FS]短轴缩短率。
组别 例数LA/AODA直径LVEFFS(mm)(%)(%)nhsPDA组1861.29±0.201.33±0.1661.9±6.829.9±4.0 hsPDA组551.85±0.241.90±0.2354.0±2.125.7±1.6 t值14.96317.545-8.402-7.353 P值<0.001<0.001<0.001<0.001
2.3 hsPDA组与nhsPDA组早产儿肠道组织rSO2的动态变化
采用重复测量设计资料的方差分析比较两组早产儿肠道组织rSO2随时间的变化趋势。数据不符合球形分布(P<0.001),采用Greenhouse‐Geisser方法进行校正。结果显示,不同组间不同时点肠道组织rSO2差异有统计学意义(组间效应:F=324.345,P<0.001;时间效应:F=37.531,P<0.001),时间和组间存在交互作用(F=67.623,P<0.001)。
hsPDA组早产儿肠道组织rSO2在诊断后1、2、4、6 h均低于nhsPDA组,差异均有统计学意义(均P<0.001),见表3。
hsPDA组早产儿肠道组织rSO2随时间呈下降趋势,至6 h时达最低值,其随时间变化差异有统计学意义(F=45.003,P<0.001)。两两比较结果显示诊断后2、4、6 h的rSO2均低于诊断后1 h(P<0.001),其他时间点间比较差异无统计学意义(P>0.05)。见表3。
nhsPDA组早产儿肠道组织rSO2随时间变化不明显(F=0.599,P=0.616),见表3。
表3 两组早产儿在诊断后不同时间肠道组织rSO的变化 (-±s)2
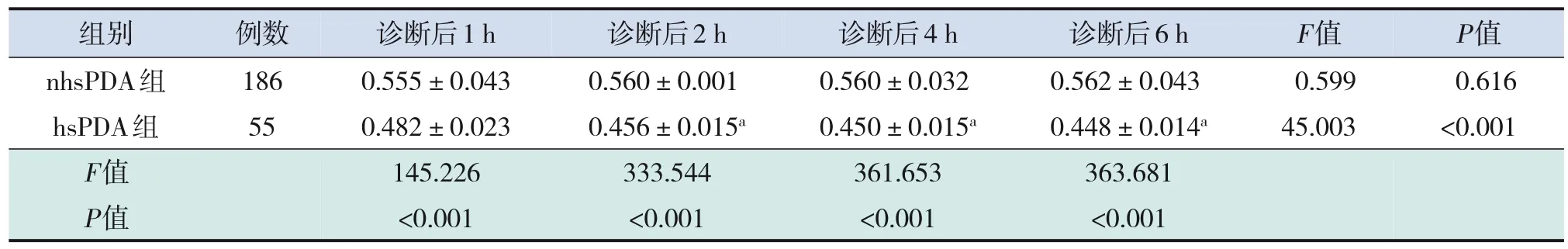
表3 两组早产儿在诊断后不同时间肠道组织rSO的变化 (-±s)2
注:a示与诊断后1 h比较,P<0.05。[hsPDA]有血流动力学意义的动脉导管未闭;[nhsPDA]无血流动力学意义的动脉导管未闭。
组别 例数 诊断后1 h诊断后2 h诊断后4 h诊断后6 hF值P值nhsPDA组1860.555±0.0430.560±0.0010.560±0.0320.562±0.0430.5990.616 hsPDA组550.482±0.0230.456±0.015a0.450±0.015a0.448±0.014a45.003<0.001 F值145.226333.544361.653363.681 P值<0.001<0.001<0.001<0.001
2.4 hsPDA关闭亚组和hsPDA未闭亚组早产儿血流动力学指标比较
hsPDA关闭亚组LA/AO值、LVEF值和FS值均恢复正常,与hsPDA未闭亚组各指标比较差异均有统计学意义(P<0.001),见表4。
表4 hsPDA关闭亚组与hsPDA未闭亚组早产儿血流动力学指标比较 (-±s)
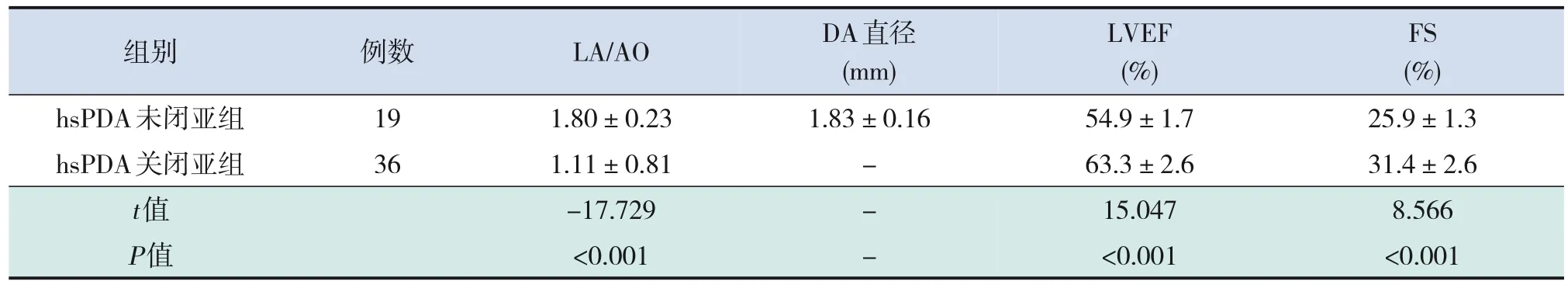
表4 hsPDA关闭亚组与hsPDA未闭亚组早产儿血流动力学指标比较 (-±s)
注:[hsPDA]有血流动力学意义的动脉导管未闭;[LA/AO]左心房内径/主动脉根部内径;[DA]动脉导管;[LVEF]左室射血分数;[FS]短轴缩短率。
组别 例数LA/AODA直径LVEFFS(mm)(%)(%)hsPDA未闭亚组191.80±0.231.83±0.1654.9±1.725.9±1.3 hsPDA关闭亚组361.11±0.81-63.3±2.631.4±2.6 t值-17.729-15.0478.566 P值<0.001-<0.001<0.001
2.5 hsPDA关闭亚组和hsPDA未闭亚组早产儿肠道组织rSO2的动态变化
采用重复测量方差分析两亚组早产儿肠道组织rSO2随时间的变化趋势。数据不符合球形分布(P<0.001),采用Greenhouse‐Geisser法进行校正。结果显示,不同组间不同时点肠道组织rSO2差异有统计学意义(组间效应:F=118.095,P<0.001;时间效应:F=147.452,P<0.001);时间和组间存在交互作用(F=38.543,P<0.001)。
hsPDA关闭亚组早产儿肠道组织rSO2在治疗后48、72、96 h均高于hsPDA未闭亚组,差异均有统计学意义(P<0.001);在治疗时和治疗后24 h,两组间的肠道组织rSO2差异均无统计学意义(P>0.05)。见表5。
hsPDA关闭亚组早产儿肠道组织rSO2从治疗24 h后随时间呈上升趋势,至96 h达最高值,其随时间变化差异有统计学意义(P<0.001)。两两比较结果显示,除了治疗时和治疗后24 h,治疗后72 h和96 h间肠道组织rSO2差异无统计学意义(分别P=1.000、0.510)外,其他时间点两两间差异均存在统计学意义(P<0.001)。见表5。
hsPDA未闭亚组早产儿肠道组织rSO2不同时间点间差异具有统计学意义(F=19.865,P<0.001)。两两比较显示,治疗后72 h和96 h的肠道组织rSO2值高于其他时间点(P<0.001),其他时间点两两比较差异无统计学意义(P>0.05)。见表5。
表5 hsPDA关闭亚组和hsPDA未闭亚组早产儿肠道组织rSO的变化 (-±s)2
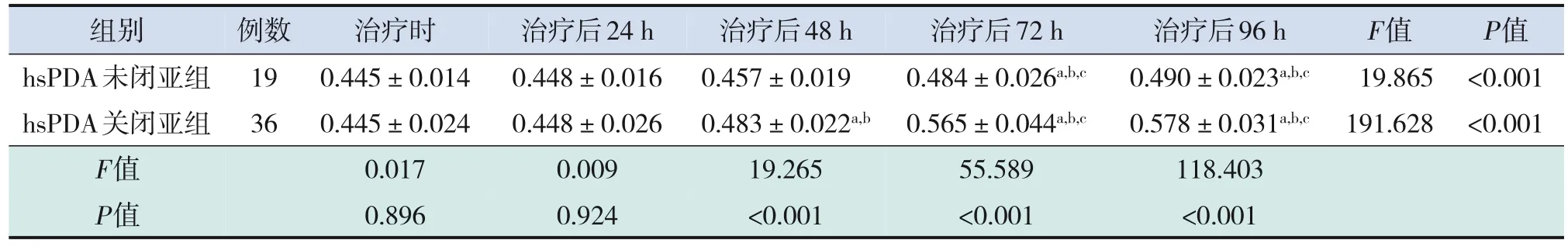
表5 hsPDA关闭亚组和hsPDA未闭亚组早产儿肠道组织rSO的变化 (-±s)2
注:a示与治疗时比较,P<0.05;b示与治疗后24 h组比较,P<0.05;c示与治疗后48 h组比较,P<0.05。[hsPDA]有血流动力学意义的动脉导管未闭。
组别 例数 治疗时 治疗后24 h治疗后48 h治疗后72 h治疗后96 hF值P值hsPDA未闭亚组190.445±0.0140.448±0.0160.457±0.0190.484±0.026a,b,c0.490±0.023a,b,c19.865<0.001 hsPDA关闭亚组360.445±0.0240.448±0.0260.483±0.022a,b0.565±0.044a,b,c0.578±0.031a,b,c191.628<0.001 F值0.0170.00919.26555.589118.403 P值0.8960.924<0.001<0.001<0.001
3 讨论
hsPDA的左向右持续分流量较大,体循环血流量减少,引起各脏器灌注减少,早产儿重要器官(如颅脑、胃肠道、肾脏等)对低灌注敏感,常导致这些重要器官缺血缺氧性损伤[11]。Kim等[12]研究发现PDA早产儿的肠系膜上动脉(superior mesenteric artery,SMA)血流灌注量低于无PDA的早产儿。符俊娟等[13]通过超声心动图检测hsPDA早产儿血流动力学指标,发现hsPDA组早产儿的DA直径和LA/AO值均大于nhsPDA组,LVEF值低于nhsPDA组。本研究中,hsPDA组早产儿DA直径和LA/AO值均大于nhsPDA组,LVEF值和FS值均低于nhsPDA组。其原因可能是早期早产儿、极低出生体重儿左心室心肌发育不成熟,心脏代偿功能有限,左心容量负荷增加时,易发生充血性心力衰竭,出现心排出量减少时,体内血液出现重新分配,肺、肾、胃肠道等器官受损。
早产儿肠道黏膜代谢率高,接受约80%的肠道血流量,当hsPDA患儿出现心排出量减少时,腹主动脉血流减少,SMA血流灌注障碍,肠道黏膜因缺血损伤,严重者可导致新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)甚至穿孔[14]。早期早产儿、极低出生体重儿肠道血流自主调节能力差,围生期体循环低灌注时,进一步削弱肠道组织携氧能力,引起肠道组织可利用氧减少,导致潜在的肠道缺血,易促进NEC发生[15-16]。目前NEC发病隐匿,病情进展迅速,病死率高,早期诊断和干预尤为重要。NIRS能无创、实时地监测rSO2,反映局部灌注情况,可能是一种能用于评估NEC发生风险的技术[17]。Zabaneh等[18]应用NIRS分别测定NEC和无NEC双胎早产儿的肠道组织rSO2,发现NEC早产儿肠道组织rSO2明显低于无NEC早产儿。本研究利用NIRS持续监测hsPDA早产儿肠道组织rSO2在诊断后及经过布洛芬治疗后随时间的变化趋势,初步评估了利用NIRS持续监测肠道组织rSO2对hsPDA早产儿肠道损伤及指导临床治疗的作用。
Gillam‐Krakauer等[19]应用NIRS连续3 d监测18例GA 25~31周早产儿的腹部rSO2,将喂养前10 min和喂养后60~120 min腹部rSO2值与多普勒显示的SMA血流速度变化进行了比较,发现腹部rSO2的变化与SMA速度的变化显著相关。Patel等[20]利用NIRS监测美国2家医院2007年1月至2008年11月出生的100例GA<32周、BW<1 500 g的早产儿肠道组织rSO2发现:患有PDA的早产儿肠道组织rSO2显著低于无PDA的早产儿;NEC组肠道组织rSO2明显低于非NEC组。本研究利用NIRS持续监测PDA早产儿肠道组织rSO2的变化,发现hsPDA组早产儿肠道组织rSO2在诊断后6 h内各时间点(1、2、4、6 h)均低于nhsPDA组;hsPDA组早产儿肠道组织rSO2随时间呈下降趋势,至6 h时达最低值。这一结论与Patel等[20]研究结果相似,研究结果提示hsPDA早产儿在诊断后6 h内即存在肠道组织灌注不足及氧合障碍,建议利用NIRS持续监测hsPDA早产儿肠道组织rSO2,若发现肠道组织rSO2出现下降趋势时应予以干预和治疗,改善肠道缺血,避免进展为NEC。
目前国际上早产儿PDA的治疗主要是针对hsPDA[21]。因为hsPDA的左向右持续分流量较大,可导致肺出血、充血性心力衰竭、颅内出血、NEC等并发症,严重时危及生命[22]。姚芒等[23]研究表明,hsPDA早产儿口服布洛芬治疗可以明显降低其LA/AO值,提高LVEF值,促进DA闭合。本研究中,hsPDA组早产儿给予布洛芬口服治疗24 h后肠道组织rSO2随时间呈上升趋势,hsPDA关闭亚组患儿肠道组织rSO2在治疗后48~96 h内各时间点(48、72、96 h)均高hsPDA未闭亚组,至96 h时肠道组织rSO2处于最高值;hsPDA关闭亚组早产儿LA/AO值、LVEF值和FS值均恢复正常。本研究结果显示,GA<32周和/或BW<1 500 g的hsPDA早产儿给予布洛芬口服治疗3 d后,约65%患儿DA关闭,药物起效时间在给药24 h后,有效者肠道组织rSO2持续上升,至治疗后96 h达最高值;效果差者肠道组织rSO2随时间上升趋势不明显。因此,我们认为hsPDA早产儿经过布洛芬治疗后行NIRS监测显示持续的肠道组织rSO2上升,预示着DA闭合可能,可用于指导治疗。
综上所述,本研究表明利用NIRS持续监测hsPDA早产儿肠道组织rSO2,当出现持续下降趋势时,提示存在肠道组织氧合障碍,此时需要积极干预和治疗,促使DA关闭,以稳定肠道血流,减少肠道组织损伤。因此,可通过NIRS持续监测hsPDA早产儿肠道组织rSO2变化趋势来指导临床管理。本研究仍存在一些不足之处,作为单中心前瞻性队列研究,样本量不是很大,为获得更具有说服力的结论,需进行多中心大样本研究。

