缝隙连接阻断剂对大鼠癫痫后海马涟波振荡能量变化的影响
易妍君 冉晓 向敬 李昕阳 蒋莉 陈恒胜 胡越
(1.重庆医科大学儿童医院神经内科/儿童发育疾病研究教育部重点实验室/国家儿童健康与疾病临床医学研究中心/儿童发育重大疾病国家国际科技合作基地/儿科学重庆市重点实验室,重庆 400136;2.美国辛辛那提儿童医院脑磁图中心,俄亥俄州辛辛那提 45229;3.北京师范大学-香港浸会大学联合国际学院理工科技学部,广东珠海 519087)
神经网络中存在广泛的高频振荡(high‐frequency oscillations,HFOs)。HFOs是指频率在40~500 Hz的脑电活动,包括γ振荡(40~80 Hz)、涟波(ripple)振荡(80~200 Hz)、快速涟波(fast ripples,FRs)振荡(250~500 Hz)。生理状态下,HFOs与感官信息处理、海马记忆功能有关[1];而病理性HFOs与癫痫密切相关[2]。
目前HFOs的产生机制还不完全清楚。ripple可能是由γ‐氨基丁酸受体介导的兴奋性神经元产生的抑制性突触后电位同步化形成[3]。FRs可能是由于具有病理性连接的兴奋性神经元短暂、高度同步化、突发式放电形成的场电位[3]。我们之前的研究已经证实发作期FRs的平均能量和最大能量可以作为癫痫发作早期预警的定量指标[4-5]。但FRs对脑电图仪器要求高,数据采集困难,临床应用受限。那么ripple是否具有与FRs相似的敏感性和特异性,从而应用于癫痫的临床研究?这为降低HFOs分析难度,使其未来作为癫痫诊疗的常规手段提供依据。
本研究选择癫痫持续状态(status epilepticus,SE)成年大鼠模型为研究对象,通过对比不同缝隙连接(gap junction,GJ)阻断剂奎宁(quinine,QUIN)、甘珀酸(carbenoxolone,CBX)与一线抗癫痫药物丙戊酸(valproate sodium,VPA)对癫痫活动及海马ripple能量的动态影响,阐明ripple能量分析是否具有与FRs类似的对癫痫发作的预测价值,明确GJ是否对癫痫的发生发展起关键作用,从而为针对性选择抗癫痫治疗的新靶点提供理论依据。
1 材料与方法
1.1 癫痫模型的建立与脑电记录
选用24只清洁级Sprague‐Dawley成年大鼠(购自重庆医科大学动物中心),体重(200±20)g。术前腹腔注射青霉素1 mL(16万单位/mL)预防感染,10%水合氯醛(3 mL/kg)镇静后,采用大鼠脑立体定位仪(深圳瑞沃德生命科技公司)定位插入颅内电极[6],记录位置包括双侧海马CA1区、CA3区、齿状回,以双侧顶叶硬膜下作为参考电极,左侧前额硬膜下作为地线。
术后第3天开始描记正常深部脑电信号,连续5 d(5~8 h/d),术后第9天建立氯化锂-匹罗卡品(pilocarpine,PILO)SE模型[7]。建模成功后,每天记录大鼠脑电信号5~8 h至SE后3 d。采样频率1 kHz,高通0.16 Hz,低通500 Hz。
24只大鼠随机分为4组(n=6)。每只大鼠腹腔注射氯化锂127 mg/kg,18~20 h后腹腔注射PILO。在癫痫发作1 h时腹腔注射水合氯醛。除模型组外,VPA组、QUIN组和CBX组需在注射PILO前3 d行预处理。VPA组:VPA 200 mg/kg,每天2次,连续灌胃3 d;QUIN组:QUIN 50 mg/kg,每天2次,连续腹腔注射3 d;CBX组:CBX 50 mg/kg,每天2次,连续腹腔注射3 d。实验过程中如出现动物死亡则替补新的实验大鼠入组。
1.2 脑电图分析
采集建模前1 d,PILO注射后10、20、30、40、50、60、70、80 min,推注水合氯醛(止痫)前后及止痫后1、2、3 h,SE后1 d、SE后3 d,共16个时间点各10 min的原始脑电图。
对以上各时间点采集的10 min脑电信号分别进行HFOs信号定量分析。本研究采用Morlet小波算法[8],提取ripple(80~200 Hz)脑电信号,包括平均能量分析和最大能量分析。
ripple振荡平均能量是指整个观察时间窗口的所有能量平均;ripple振荡最大能量是指整个观察时间窗口内某一时间点的能量,为该观察时间窗口的最高能量[9]。
定义ripple振荡能量波动最大的导联为责任导联[5]。
1.3 统计学分析
采用SPSS23.0统计软件对实验数据进行统计学分析。计量资料采用均数±标准差(±s)表示,多组或多时间点数据比较采用单因素方差分析,组间两两比较采用LSD‐t法。P<0.05为差异有统计学意义。
2 结果
2.1 ripple振荡能量定量分析
24只大鼠成功建立模型。造模前,正常大鼠海马CA1、CA3区及齿状回均可见ripple振荡表达。VPA组、QUIN组和CBX组,均以CA1和CA3区ripple振荡能量波动最大(n=6),模型组中,4只以CA1和CA3区ripple振荡能量波动最大,2只以齿状回区ripple振荡能量波动最大。进一步对ripple振荡平均能量及最大能量进行统计分析,结果见表1~2和图1~2。
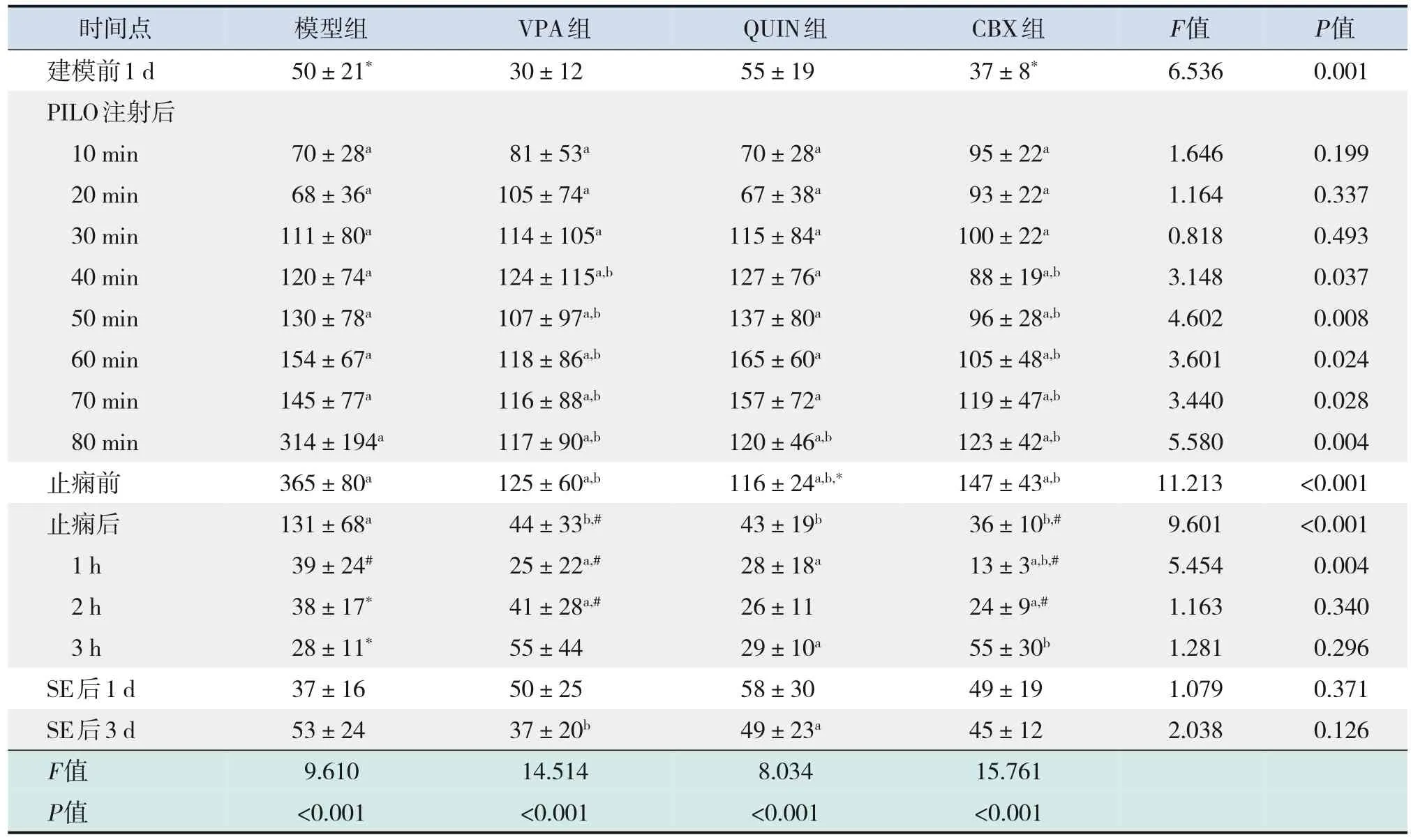
表1 癫痫发作前后各组ripple振荡平均能量的动态变化 (n=6)
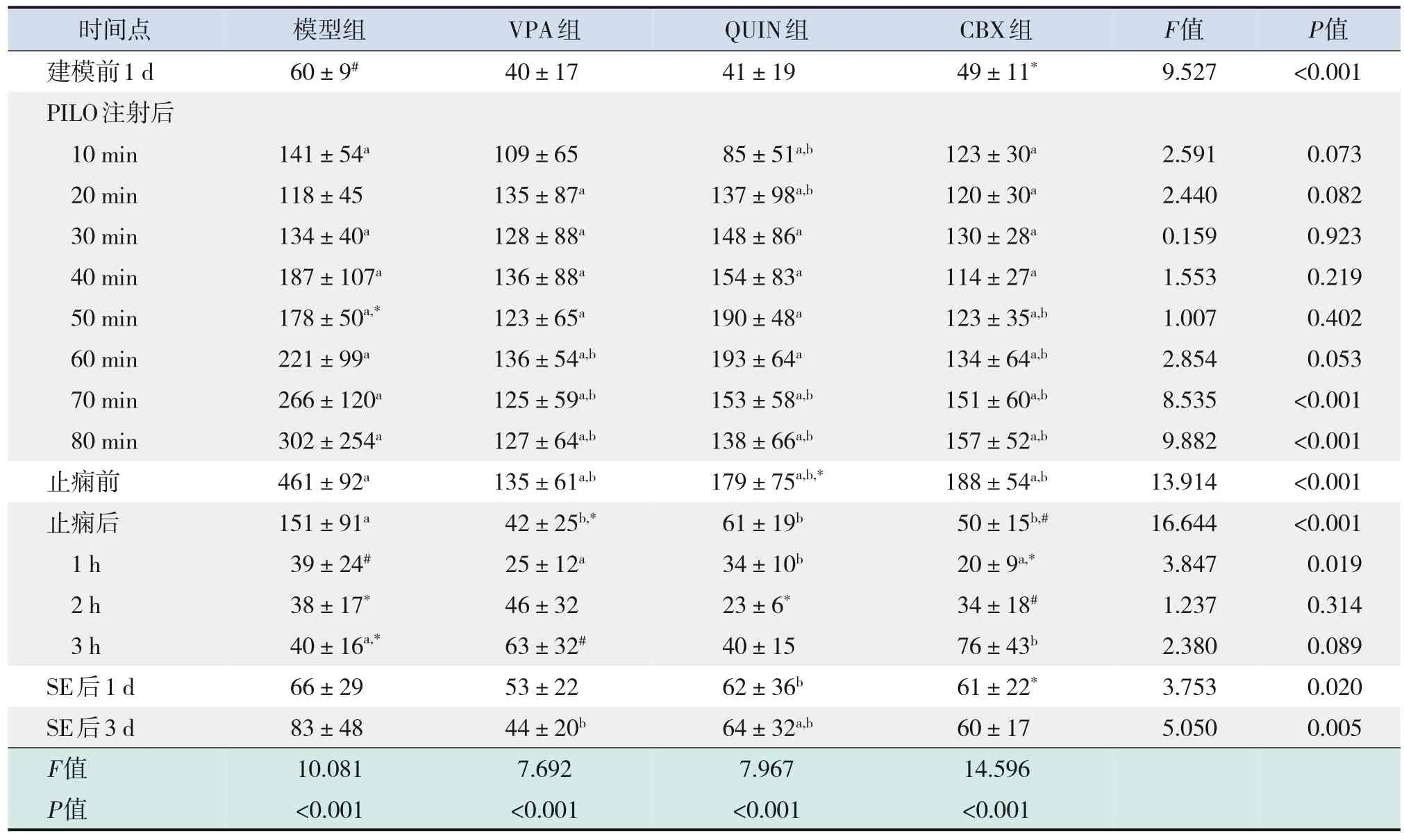
表2 癫痫发作前后各组ripple振荡最大能量的动态变化 (n=6)
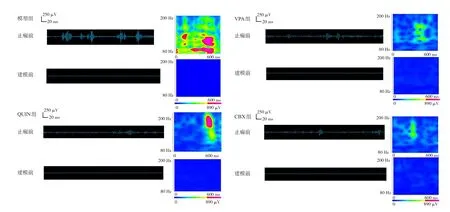
图1 各组癫痫前后CA1区ripple振荡能量和时间特性 左侧波形图采用80~200 Hz的带通滤波器进行滤波。右侧频谱图反映了相应波形的累积时频。以上数据证明癫痫发作伴随ripple振荡能量的增加,而VPA、QUIN和CBX进行预处理可以降低ripple振荡能量并减轻癫痫发作的程度。ripple振荡的特征是节律性爆发,与系统伪迹(如电源噪声及其谐波)不同。
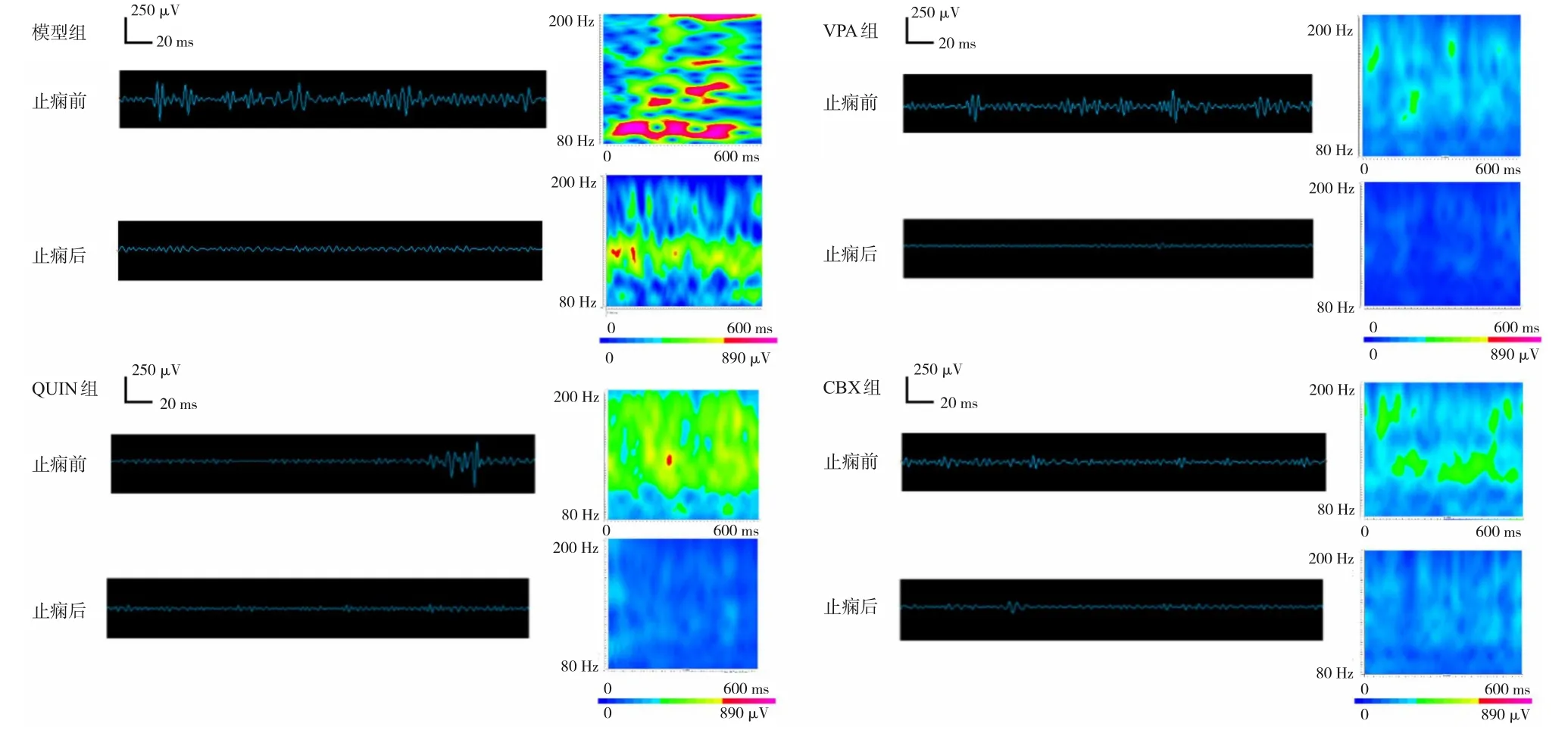
图2 各组止痫前后CA1区ripple振荡能量和时间特性 左侧波形图采用80~200 Hz的带通滤波器进行滤波;右侧频谱图反映了相应波形的累积时频。结果表明,癫痫终止伴随ripple振荡能量的下降,而VPA、QUIN和CBX进行预处理可以降低ripple振荡能量,并减轻癫痫发作的程度。ripple振荡的特征是节律性爆发,与系统伪迹(如电源噪声及其谐波)不同。
注射PILO后,各实验组ripple振荡平均能量逐渐增强,模型组、VPA组和CBX组在止痫前达到最高峰,QUIN组在PILO注射后60 min达到最高峰,与建模前1 d相比,差异均有统计学意义(P<0.05)。止痫后,VPA组、QUIN组、CBX组ripple振荡平均能量恢复至建模前1 d水平(P>0.05);模型组在止痫后1 h ripple振荡平均能量降至建模前1 d水平(P>0.05);且各组均持续正常水平至SE后3 d。CBX组与VPA组在注射PILO后40 min,QUIN组在注射PILO后80 min开始,ripple振荡平均能量明显低于模型组(P<0.05),并持续至止痫后1 h。
ripple振荡最大能量的变化趋势与ripple振荡平均能量的变化趋势类似。
3 讨论
相对常频脑电信号,HFOs信号更为微弱,波幅低且持续时间短[10],传统时域分析或频域分析均不能准确表达HFOs的特征。随着对HFOs研究的深入,HFOs的采集技术、自动检测技术及新的分析与量化算法正得到快速的发展[11]。时频分析法中的小波变换是近20年来新发展起来的信号分析理论[12],其在信号奇异性检测、时变滤波、模式识别等信号分析和处理方面具有广泛的应用。小波变换中的Morlet小波具有良好的时间分辨率,可实现HFOs在癫痫脑组织中的定量分析[8]。
既往有报道显示[13],海马区生理性HFOs多为ripple。本研究显示,ripple和FRs可以同时出现在正常或癫痫海马组织中,两种状态下的主要区别在于ripple表达能量不同。因此,我们认为HFOs的频率并非区分生理和病理状态的必要条件。PILO注射后10 min,即使此时各组均未诱导出Ⅳ级痫性发作,ripple振荡平均能量仍较发作前相比明显增加,止痫后,ripple振荡平均能量迅速下降。对ripple最大能量进行分析,得出类似的结果。这说明ripple能量变化与癫痫发作的状态吻合[14]。颞叶癫痫患者中,HFOs产生区与器质性脑损害区一致[15],多发生在CA1、CA3、齿状回区[16]。本研究显示:ripple平均/最大能量变化在双侧海马呈非对称性,同侧海马不同区域其平均/最大能量变化也并非完全一致。癫痫大鼠责任导联集中在CA1、CA3、齿状回区。因此,责任导联所在区域可能与致痫灶密切相关。ripple平均/最大能量变化可较好地反映脑功能状态的变化,二者适用于癫痫预测或脑功能状态的检测。
增强的细胞间GJ通讯可能参与癫痫产生[17]。CBX是广谱GJ阻断剂,通过改变GJ通道蛋白构象,从而关闭GJ通道[18]。体内和体外实验均证实了CBX具有抗癫痫作用[19],但由于类盐皮质激素的不良反应而使其应用受限。QUIN选择性阻断CX36和CX50介导的细胞间GJ,具有剂量依赖性,低剂量有抗癫痫作用,而高剂量具有神经毒性[20]。VPA可诱导CX43及CX26的表达[21]。本研究发现,GJ阻断剂包括CBX和QUIN,均可阻断ripple振荡,减轻癫痫发作程度,与一线抗癫痫药物VPA具有类似的抗癫痫作用。止痫后10 min,3个干预组ripple振荡平均及最大能量均恢复至正常水平,并持续至SE后3 d,提示GJ阻断剂及VPA,对发作间期HFOs无明显影响。尽管近20年有多种新型抗癫痫药物应用于临床,却并未改变癫痫治疗原则,降低难治性癫痫发生率。因此,进一步探索抗癫痫药物的不同类型作用靶点,针对性阻断GJ的作用靶点,减少病理性HFOs形成,具有重要的临床意义。

