米曲菌胰酶片治疗肝硬化伴消化不良的疗效观察
任振宇,郝英霞
(1.承德医学院 河北 承德 067000;2.保定市第一中心医院 消化内科,河北 保定 071000)
在我国,约有80%肝硬化患者有一种或多种相关的胃肠道症状[1]。其中,出现腹胀、腹痛、打嗝、腹泻及便秘的患者分别约为49.5%、24.0%、18.7%、13.3% 及8.0%[2]。米曲菌胰酶片含有米曲菌酶和胰酶的复合制剂,对治疗消化不良的疗效较好[3-4]。本研究对肝硬化患者进行Child-Pugh 分级并进行分层研究,分析米曲菌胰酶片治疗肝硬化伴消化不良患者的疗效观察,现报道如下。
1 资料与方法
1.1 一般资料
选取2019 年12 月至2020 年8 月在保定市第一中心医院治疗的80 例合并消化不良症状的患者,采用随机数字表法分为实验组和对照组,每组40 例。实验组男性28 例,女性12 例;年龄39~73 岁,平均(53.6±7.5)岁;病程1~10 年,平均(5.3±0.5)年。对照组男性26 例,女性14例;年龄41~75 岁,平均(54.1±7.2)岁;病程1~10 年,平均(5.9±0.8)年。将肝硬化患者进行Child-Pugh 分级并进行分层研究,Child-Pugh 分级分为A 级、B 级及C 级。所有患者经临床确诊为肝硬化,消化不良症状根据2017 年美国胃肠病学院临床指南《消化不良的管理》。本研究通过医院伦理委员会批准。患者及其家属知情同意。两组性别、年龄、病程等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 研究方法
1.2.1 对照组 给予针对患者肝硬化并发症及常规保肝药物治疗,出现急诊手术指征的进行剔除。
1.2.2 实验组 在常规治疗基础上加米曲菌胰酶片:2 片/次,3 次/d,疗程4 周。剔除标准为患者终止临床研究治疗的原因可归入以下方面:①1 周未服药次数≥3 次;②研究期间服用其他影响消化酶分泌、释放和排泄的药物或服用胃动力的药物;③发生严重药物不良反应;④失访或死于肝硬化并发症,被终止的研究资料仍纳入疗效和安全性分析。
1.3 评价指标
1.3.1 消化不良症状严重程度评估计分标准 治疗前和治疗4 周后参照胃肠道症状评分(GSRS)对7 个常见消化不良症状(反酸、嗳气、上腹痛、上腹烧灼感、恶心、腹胀、早饱)分别进行评分,每个症状积分=症状严重程度计分×发生频率。症状严重程度判定标准:无症状计0 分;患者偶尔轻微症状、平时无明显不适感觉计1 分;有不适症状但不影响日常生活计2 分;有不适症状、且影响日常生活计3 分。记录1 周内各种消化不良症状出现的天数。记录1 周各种症状积分之和。症状积分改善率=[(治疗前症状积分-治疗后症状积分)/治疗前症状积分]×100%。消化不良疗效评估采用百分比:症状积分改善率>75%为显效;50%~75% 为有效;25%~<50% 为有进步;<25%为无效;症状积分增高为恶化。总有效率=[(有效例数+显效例数)/总例数]×100%。临床疗效判定:根据GSRS 的改善情况临床疗效判断分为显效、有效、有进步、无效和恶化。
1.3.2 生活质量评估量表选择 采用世界卫生组织推荐的健康调查简易量表(SF-36)测评问卷,该量表由36 个单项组成,包括8 个维度:①生理机能;②生理职能;③躯体疼痛;④一般健康状况;⑤精力;⑥社会功能;⑦情感职能;⑧精神健康。各维度计分采用李克累加法,按最后题值计算原始分数,再以标准公式计算转换分数,各维度得分为0(最差)~100 分(最好)。
1.3.3 肝功能指标及Child-Pugh 评分 比较两组治疗前后肝功能指标及Child-Pugh 评分变化。
1.4 统计学方法
数据分析采用SPSS 16.0 统计软件。符合正态分布的计量资料以均数±标准差()表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前后腹胀症状积分比较
两组治疗前腹胀症状积分比较,差异无统计学院意义(P>0.05)。实验组治疗第2、4 周后腹胀症状积分较对照组降低,差异有统计学意义(P<0.05)。见表1。
表1 两组治疗前后腹胀症状积分比较(n=40,,分)
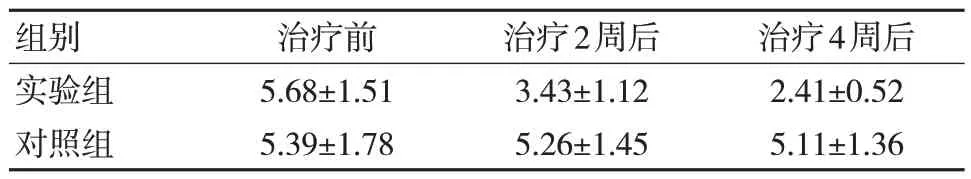
表1 两组治疗前后腹胀症状积分比较(n=40,,分)
2.2 两组米曲菌胰酶片治疗4 周后消化不良症状总有效率比较
实验组米曲菌胰酶片治疗4 周后消化不良症状总有效率高于对照组,差异有统计学意义(χ2=26.776,P<0.001)。见表2。

表2 两组米曲菌胰酶片治疗4 周后消化不良症状情况(n=40)
2.3 两组治疗前后肝功能及Child-Pugh 分级评分比较
两组治疗前总胆红素、谷丙转氨酶及Child-Pugh 分级评分比较,差异无统计学意义(P>0.05)。实验组治疗后总胆红素、谷丙转氨酶及Child-Pugh分级评分较对照组降低,差异有统计学意义(P<0.05)。见表3。
表3 两组治疗前后肝功能及Child-Pugh 分级评分比较(n=40,)
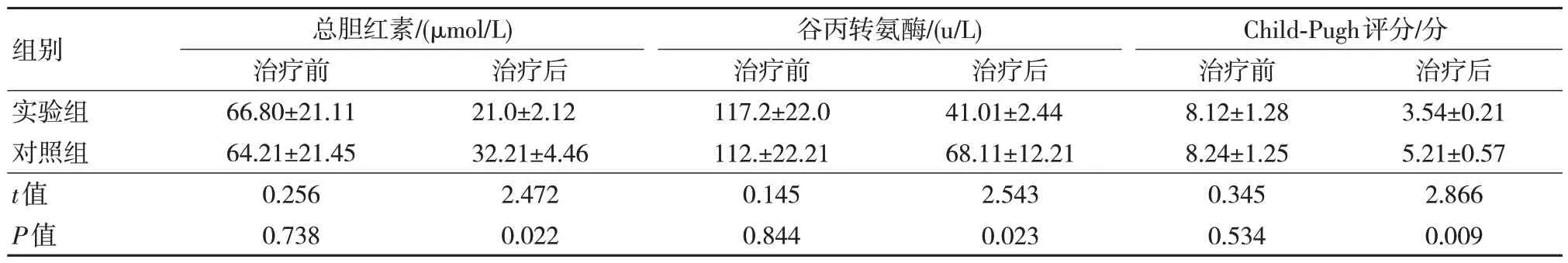
表3 两组治疗前后肝功能及Child-Pugh 分级评分比较(n=40,)
2.4 两组治疗4 周后SF-36 生活质量问卷评分比较
两组治疗4 周后生理机能、生理智能、躯体疼痛、一般健康状况、精力、社会功能、情感智能及精神健康比较,差异有统计学意义(P<0.05)。见表4。
表4 两组治疗4 周后SF-36 生活质量问卷评分比较(n=40,,分)
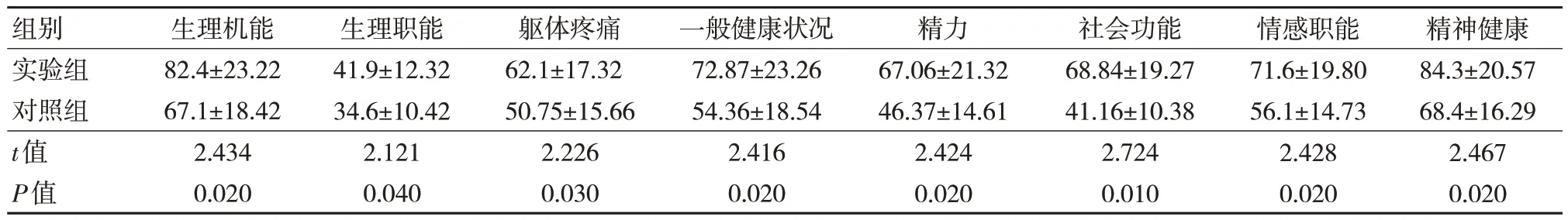
表4 两组治疗4 周后SF-36 生活质量问卷评分比较(n=40,,分)
3 讨论
胃肠功能障碍在肝硬化患者中很常见,并且可能会影响患者的生活质量和营养状况,导致肝硬化并发症的发生。肝硬化患者胃肠功能障碍病理生理学复杂多样,可能涉及肝硬化严重程度、精神心理因素、胃对扩张的敏感性增加和肠道转运延迟等相关的因素[5-6]。胃排空障碍和肠道转运延迟,可能与餐后血糖和胰岛素抵抗引起的激素紊乱有关。此外,胃肠屏障功能障碍导致细菌移位和细菌产物的渗透经常出现在肝硬化患者,导致患者肠道菌群失调和内毒素血症[7]。胃肠道症状的严重程度与肝硬化的严重程度、乳果糖使用、腹水的存在和心理因素及低血清睾酮水平相关。总之,胃肠道症状的病理生理学复杂多样,其还涉及肠道运动功能的异常。肝硬化患者会出现胆汁分泌异常,影响胰腺分泌消化酶,导致消化吸收延迟,进而造成胃肠动力紊与消化酶分泌不足,两者互为因果、相互促进。
米曲菌胰酶片是含有米曲菌酶和胰酶的复合制剂,发挥自然消化的作用[8],该药在临床应用广泛,其在治疗消化不良症状方面有多项研究。有研究显示,米曲菌胰酶片的安全性优于其他消化酶制剂,特别是治疗消化不良方面安全、可靠[9],但在肝硬化伴有消化不良这部分患者中的研究报道相对较少。本研究将肝硬化患者进行Child-Pugh 分级并进行分层研究,通过补充外源性消化酶达到改善消化不良的症状。
本研究结果显示,实验组治疗4 周后消化不良症状可以得到有效改善,Child-Pugh 评分值显著降低,生活质量评分明显高于对照组,比较有差异;两组治疗腹胀疗效比较,实验组总有效率显著高于对照组,比较亦有差异,且无不良反应发生,说明米曲菌胰酶片治疗消化不良安全、有效。米曲菌胰酶片可以通过改善患者的胃肠动力紊乱与消化酶分泌不足,从而改善患者消化不良症状。当然,对照组中一部分患者经过保肝等常规治疗,消化不良症状也得到了改善,提示随着肝硬化并发症的控制、肝功能的好转,一部分患者的消化功能可以逐渐恢复,消化不良症状可以得到改善,这需要进一步扩大样本进行研究。
综上所述,肝硬化伴有消化不良症状的患者加用米曲菌胰酶片治疗,可以让该部分患者在临床症状改善方面能够获得良好疗效。

