液相微萃取法快速检测果蔬中噻菌灵残留量
杨续金,王东清,任俌政,李立敏,杨杨
1.内蒙古农业大学食品科学与工程学院(呼和浩特 010018);2.呼和浩特市绿林源农业科技开发有限公司(呼和浩特 010020)
噻菌灵(TBZ)是一种高效、广谱,广泛用于水果、蔬菜防治真菌性病害的苯并咪唑类(BMZs)杀菌剂[1-3]。TBZ既可用于多种作物的真菌病害防治,也可用于果蔬的防腐保鲜,还可用于工业防霉剂及人、畜肠道的驱虫药剂,在农药、医药及工业领域有重要应用[4-7]。TBZ经常被用作水果和蔬菜采摘后入冷藏前喷洒,防止长时间存放和运输而导致的霉变,以提供反季节的配送[8]。TBZ在自然状态下降解缓慢,具有较低的急性皮肤毒性,若在生产中过度使用,容易引起残留量超标,长期食入可能会引发免疫系统紊乱[9-10],严重威胁消费者健康。因此,世界各国都制定了TBZ的残留限量标准,如GB 2763—2019《食品安全国家标准 食品中农药最大残留限量》[11]规定香蕉、柑橘类水果中TBZ的最大残留限量为10 mg/kg。欧盟(EU)和食品法典委员会(CAC)根据作物类型规定水果、蔬菜中TBZ的最大残留0.05~15 mg/kg限量[12-13]。
TBZ在果蔬中含量低,需要一种合适的提取方法才能准确可靠地分析其残留量。液-液萃取(LLE)、浊点萃取(CPE)[3,14-17]是经典的提取方法,此外还有加压液体萃取(PLE)法、盐析辅助均相液液萃取(SALLE)法、液相微萃取(LPME)法、固相微萃取(SPME)[3,18-21]等。LLE和CPE经典的提取方法,仅限于与水互相不溶的有机溶剂作为萃取剂,只适合简单基质中低极性有机物的萃取,且存在有机溶剂用量大、操作步骤多、成本高等缺点;PLE法需要在高温和高压的条件下进行,对提取设备的要求高;LPME是在液液萃取的基础上发展的新型微量化溶剂提取过程,减少供体相中的杂质对受体相的干扰,可以容纳更大体积的受体相,具有操作简单、快速、成本低、灵敏度高、稳定性好、环境污染小等优点。TBZ提取后,检测的方法有液相色谱-串联质谱仪测定分析、气相色谱-质谱仪测定分析、高效液相色谱法、表面增强拉曼光谱法、注射荧光检测法[5,10,17,22-24]等。这些技术大多需要昂贵的设备,操作步骤多,需要精细的处理等,高效液相色谱法还对某些化合物的灵敏度较低,它们是共洗脱和不可逆吸附的峰尾,有些不能被检测出来。试验采用紫外-可见分光光度计作为检测技术,结合LPME提取,检测TBZ残留量仅需20 min左右,既省时又经济,可更简便、快速、灵敏、准确、可靠地分析果蔬基质中TBZ残留量。
1 材料与方法
1.1 材料与试剂
黄瓜、圣女果、香蕉、橘子(呼和浩特市绿林源农业科技开发有限公司)。
猪白细胞介素(Porcine interleukin,IL,GR级,Sigma公司);Cu(NO3)2·3H2O(GR)、HNO3(GR)、乙腈(色谱级)、超纯水(色谱级)(北京百灵威科技有限公司);N-丙基乙二胺(色谱级,东莞康润实验科技有限公司);聚乙烯吡咯烷酮(GR,武汉华翔科洁生物技术有限公司);邻苯二甲酸氢钾(GR)、氢氧化钠(AR)、无水硫酸镁(AR)、氯化钠(AR)、甲醇(AR)、磷酸二氢钠(AR)、柠檬酸(AR)、4.5 μm滤膜(北京康普汇维科技有限公司);噻菌灵(纯度≥99%,武汉东康源科技有限公司)。
1.2 仪器与设备
破壁机(HX-PB965,佛山市海迅电器有限公司);旋涡混合器(XH-C,常州金坛良友仪器有限);pH计(ST3100,奥豪斯仪器(常州)有限公司);离心机(AnkeTGL-16B,上海安亭科学仪器厂);紫外可见分光光度计(Shimadzu UV-1800 PC,日本)。
1.3 方法
1.3.1 样品处理与制备
对蔬菜、水果先用蒸馏水初步清洗,再用超纯水精细清洗后,用破壁机冷打状态下将样品打碎,称取15 g样品于50 mL带盖的离心管中,加入15 mL乙腈、3 g NaCl和12 g无水MgSO4用振荡器高速振荡2 min,在室温、4500 r/min下离心5 min。用移液管分别取3份5 mL上清液加到20 mL离心管中,分别加入0.2 gN-丙基乙二胺和0.6 g无水MgSO4用振荡器高速振荡2 min,在室温、4500 r/min下离心5 min后,用4.5 μm滤膜过滤得到TBZ提取液备用。
1.3.2 磷酸氢二钠-柠檬酸缓冲液配制

表1 磷酸氢二钠-柠檬酸缓冲液配制表[25]
1.3.3 聚乙烯吡咯烷酮(PVP)缓冲液的配制
在100 mL容量瓶中加入32 mL 0.1 mol/L的NaOH溶液后,加入1.021 g邻苯二甲酸氢钾用超纯水定容,配成pH 5.5的PVP缓冲液备用。加入1.5 mg PVP后配成15 mg/L pH 5.5的PVP缓冲液备用。PVP具有优异的溶解性和生物相容性[26],理论上可以提高TBZ检出的灵敏度,为考察其这一性能,探究在TBZ提取液一组添加PVP和另一组不添加的2组对照设计。
1.3.4 标准溶液的配制
用乙腈溶解TBZ配制成200 mg/L的溶液,用乙腈逐步稀释制成不同浓度梯度的TBZ标准溶液。
用超纯水溶解Cu(NO3)2·3H2O配制成200 mg/L的溶液,用0.2 mol/L的HNO3溶液稀释制成不同浓度梯度的Cu离子标准溶液[27]。
1.3.5 光波的选择
选取TBZ标准液质量浓度分别为1,10和20 mg/L这3个梯度和一个空白对照(IL和乙腈混合),按照1.3.6程序操作,在光波250~490 nm波长范围内测定吸光度,根据测定结果选取最大吸收波长[28]。
1.3.6 试验操作程序
取5 mL的TBZ提取液(或标准液,TBZ标准溶液依次配制40,80,160,320,640,1280,2560和5120 μg/L)于30 mL带盖的刻度离心管中,加入450 μL 5 mg/L的Cu离子标准溶液,室温下反应生成TBZCu络合物形成后(约2 min),加入20 mg IL和400 μL乙腈萃取,加入超纯水至15 mL,用振荡器高速振荡3 min,在室温、3500 r/min下离心2 min后得到离心管底部的IL相,加入800 μL甲醇稀释后,用紫外可见分光光度计在340 nm下进行分光光度测定。试验空白值的测定为取5 mL超纯水,重复上述操作。
1.3.7 IL添加量对TBZ提取率影响的设计
选择1 mg/L的TBZ标准液作为考察对象,研究IL添加量分别为0,5,10,15,20和25 mg时对TBZ提取率的影响。以提取率高值为最佳,按式(1)计算。

式中:CIL为IL相中TBZ质量浓度,mg/L;V1为IL相体积,800 μL;C标准为TBZ标准液质量浓度,50 μg/L;V为TBZ标准液体积,5 mL。
1.3.8 乙腈添加量对TBZ提取率影响的设计
选择1 mg/L的TBZ标准液作为考察对象,IL添加量20 mg,研究乙腈添加量0,100,200,300,400,500和600 μL对TBZ提取率的影响。提取率按式(1)计算。
1.3.9 温度对TBZ提取率影响的设计
选择1 mg/L的TBZ标准液作为考察对象,在IL添加量20 mg、乙腈添加量400 μL的条件下,研究萃取温度10,20,30,40和50 ℃对TBZ提取率的影响。提取率按式(1)计算。
2 结果与分析
2.1 最佳吸收波长的确定
由图1可知,TBZ标准溶液在波长340 nm和430 nm出现最大吸收峰,340 nm比430 nm处吸光度更大,表明在340 nm处检测灵敏度更高。吸光度与TBZ质量分数相关性显著,TBZ质量分数越高,吸光度越大。
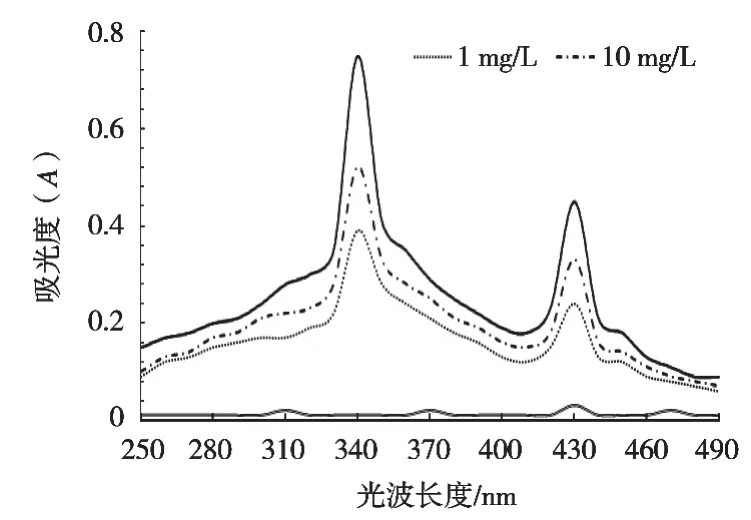
图1 不同光波下TBZ标准溶液的吸光值
2.2 pH对TBZ提取率的影响
pH会影响到TBZ与金属盐的络合,进而会影响提取率的变化。为此,在微萃取过程中选择pH进行优化。用磷酸氢二钠-柠檬酸配制pH 3.4~8.0的缓冲液,研究pH对TBZ标准溶液(1 mg/L)提取率的影响。由图2可知,在pH 3.4~5.4范围内,TBZ提取率显著增加,提取率从51.4%增加到86.4%,在pH 5.4~5.6范围内TBZ提取率最高,随着pH继续升高,TBZ提取率开始下降,pH在7.2以上,TBZ提取率下降明显,由此选择pH 5.5下提取TBZ。

图2 pH对TBZ标准溶液提取率的影响
2.3 IL添加量对TBZ提取率的影响
分散剂IL在水溶液中易形成微滴,并有助于将络合物萃取到IL相。IL添加量较小时,相分离不完全,提取率较低。考察IL添加量对TBZ标准溶液(1 mg/L)提取率的影响,由图3可知,IL添加可以显著增加TBZ提取率,IL添加量从5 mg增加到20 mg时,相分离明显增加,TBZ提取率明显增加,IL添加量增加到20 mg以上时,提取率不再增加。

图3 IL添加量对TBZ标准溶液提取率的影响
2.4 稀释剂乙腈添加量对TBZ提取率的影响
乙腈有助于IL溶解其中,并促进TBZ的络合物一起进入IL相。试验分析乙腈添加量在0~600 μL范围内对TBZ标准液提取率的影响。结果如图4所示。乙腈添加量不足400 μL时,IL分散不好,相分离不完全,TBZ提取率较低。400 μL以下时,相分离清晰,TBZ提取率显著提高。400 μL以上时,TBZ提取率不再增加。选择乙腈添加量400 μL可以实现良好的相分离,得到较高的TBZ提取率。

图4 乙腈添加量对TBZ提取率的影响
2.5 温度对TBZ提取率的影响
温度可以促进TBZ络合物溶于IL相中,试验考察萃取温度在10~50 ℃范围内对TBZ提取率的影响。结果如图5所示,温度低于20 ℃,相分离非常低,导致提取率也较低,在40 ℃范围内,TBZ提取率随温度升高而增加,40~50 ℃范围内TBZ提取率不再增加,因此选择最佳萃取温度40 ℃。
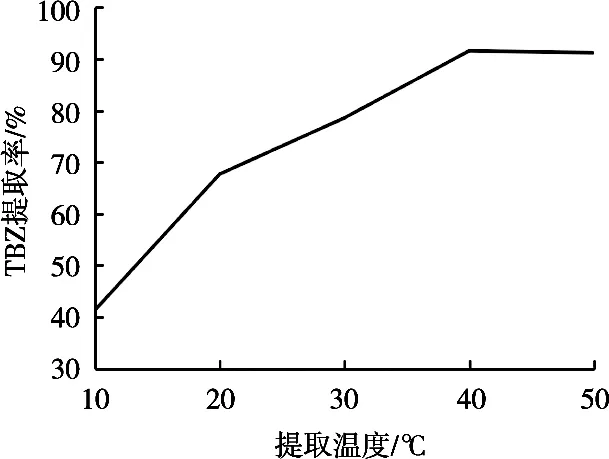
图5 温度对TBZ提取率的影响
2.6 聚乙烯吡咯烷酮(PVP)对TBZ提取率的影响
PVP具有优异的溶解性和生物相容性,可以提高TBZ的检出率。试验考察3个梯度的TBZ标准液(1,0.5和0.1 mg/L)一组分别添加2 mL pH 5.5的PVP缓冲液(试验组),另一组只添加2 mL pH 5.5邻苯二甲酸氢钾-氢氧化钠缓冲液,不添加PVP(空白组)按照1.3.6的操作程序40 ℃进行萃取,考察PVP对TBZ提取率的影响。结果如图6所示,PVP的添加明显提高3个梯度TBZ标准液的提取率,提取率较空白组提高9.3%。
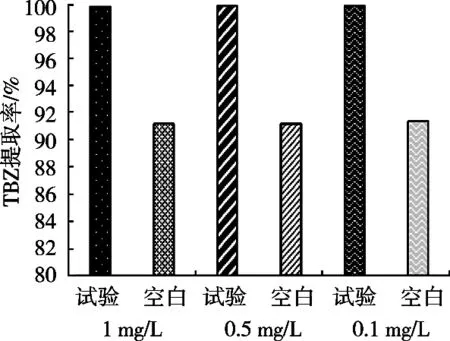
图6 聚乙烯吡咯烷酮对TBZ提取率的影响
2.7 对样品中TBZ含量的检出结果
取试验对象蔬菜(黄瓜、圣女果)、水果(香蕉、橘子),3个梯度的TBZ标准(5,1和0.1 mg/L)及空白组(超纯水),按照1.3.1和1.3.6的操作程序,试验组、空白组均分别添加2 mL pH 5.5的PVP缓冲液(所有测试样做5组平行试验,空白组做1组),40℃下萃取,340 nm下检测吸光度。测定结果如表2所示,3个梯度的TBZ标准的精准度均>98%,且具有很好的稳定性。4种蔬菜水果(黄瓜、圣女果、香蕉和橘子)中TBZ残留量分别为0.043,2.361,6.487和5.548 mg/kg,检测结果具有很好稳定性。通过向样品提供企业了解,除黄瓜样品为本地来源,采摘后没有使用过TBZ处理外,其他3种均在采摘后使用过TBZ,与实测结果对比基本吻合。对于没有使用过TBZ处理的黄瓜样品检出微量TBZ残留,推断是其生长过程中土壤吸收所致。从检测所用时间看,每个样品需要的时间在15 min左右。

表2 样品中TBZ的检出结果
3 结论
试验研究液相微萃取技术借助IL和pH 5.5的PVP缓冲液提取样品中TBZ,采用紫外-可见分光光度计作为检测手段。结果表明,TBZ在pH 5.5、IL添加量20 mg、稀释剂乙腈添加量400 μL和萃取温度40 ℃条件下具有较高得率;PVP有助于提高TBZ得率;紫外-可见分光光度计在340 nm处检测具有最高灵敏度。该方法有较好的精密度和良好的重现性,操作相对简单,试剂消耗量低,用时少,几乎任何实验室都可以使用;具有简单、快速、易于使用和成本低的优点。

