塔什干地区发酵乳制品中酵母菌的分离鉴定
如意,任冬艳,刘文俊,孟和毕力格
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,农业农村部奶制品加工重点实验室,内蒙古自治区乳品生物技术与工程重点实验室,呼和浩特010018)
0 引 言
发酵乳制品深受塔什干地区消费者的喜爱,当地居民具有制作和食用发酵乳制品的习惯。发酵乳制品便于保藏且营养丰富[1],包括酸马奶、酸牛奶、曲拉、乳饼、酸驼乳、酸山羊乳等。发酵乳制品的各种生产方法是在长期生产实践中摸索出来的,是一种保存鲜乳、防止变质的手段[2]。
酸牛奶通过将天然发酵剂(即引子)添加到新鲜牛奶中,环境温度10~25℃时,在木桶、动物皮制成的袋子或玻璃罐中发酵1~2 d直至达到所需的酸度[3]。而发酵牛乳中的醇味和某些特殊的香气主要由酵母菌发酵作用而形成[4]。酸牛奶是一种原生态保健饮料,也是功能性免疫食品,对神经衰弱、糖尿病、胃病和长期失眠者有一定的疗效。
发酵乳制品中除了酸牛奶,酸马奶也一个的研究热点。而酸马奶以鲜马奶为原料,具有较高的营养价值和医疗保健作用的饮品。在公元2000多年前,人类利用马奶的记载,西亚、东欧、中亚地区的牧民都有饮用马奶的记载[5-7]。马奶中酪蛋白和乳清蛋白的含量占总蛋白的一半,其中氨基酸组成与母乳相似。并且马奶中富含多不饱和脂肪酸,特别是亚油酸和亚麻酸[8-9]。酸马奶是利用传统发酵技术,经乳酸菌和酵母菌共同发酵而成的一种乳白色或稍带黄色的乳饮料[10],可以改善消化道、新陈代谢、神经系统、造血器官、肾脏、内分泌腺和免疫系统的功能。还对肺结核,泌尿生殖系统结核、乏力、贫血有治疗作用[11-14]。吉尔吉斯人用马奶制作具有良好风味的马奶酒,可能是酸马奶中的酵母菌赋予了产品独特的风味和口感,使其具有不同的地域特色。
发酵乳制品因制作工艺、地理因素、气候环境的差异,使其蕴藏了更为丰富的微生物多样性。因此分离鉴定塔什干地区发酵乳制品中的酵母菌,对保藏和发掘发酵乳制品中酵母菌资源具有重要意义。
本研究基于上述背景对塔什干地区酸牛奶和酸马奶中分离的酵母菌种类进行鉴定和同源性分析,保护塔什干地区特有的酵母菌种资源,为乳制品工业化开发提供支持。
1 材料与方法
1.1 样品来源
本研究的10份酸牛奶、1份酸马奶样品由实验室研究人员于2019年采集自乌兹别克斯坦塔什干地区,见表1。采集10份酸牛奶、1份酸马奶样品于已加入碳酸钙和淀粉(m碳酸钙∶m淀粉=1∶50)的无菌螺口冻存管,在4℃低温采样箱中保存,在7 d内运送至实验室,对样品进行酵母菌的分离培养。
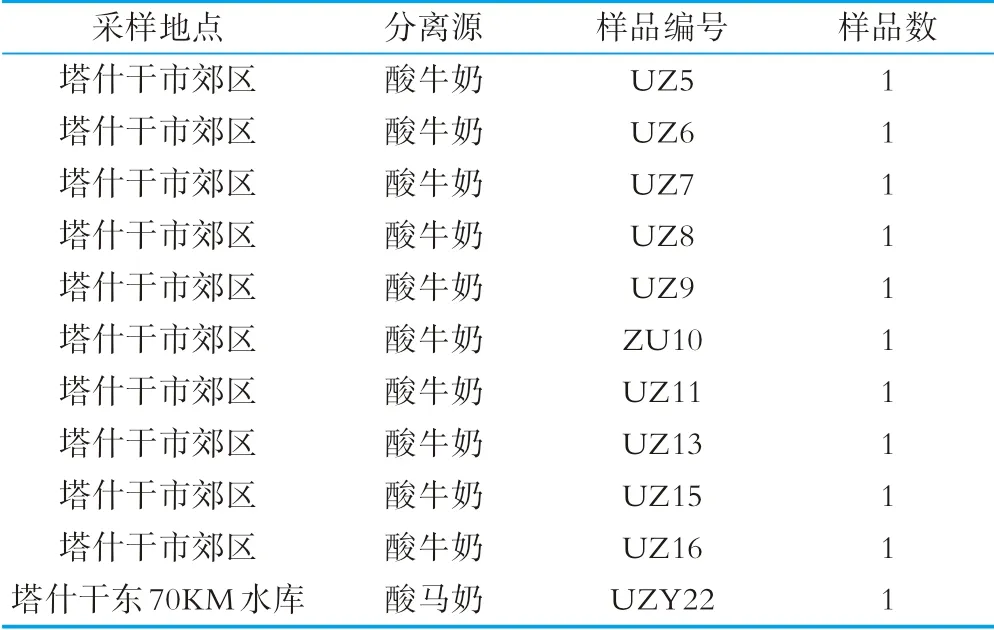
表1 塔什干地区样品采集样品信息
1.2 培养基及试剂
酵母菌浸出粉胨葡萄糖(Yeast Extract Peptone Dextrose Medium,YEPD)培养基(葡萄糖2%,蛋白胨2%,酵母膏1%,1 000 mL蒸馏水)、YPD固体培养基是在YPD液体培养基中添加2%琼脂粉、5×TBE电泳缓冲液(Tris 54 g、Na2EDTA·2H2O 3.72 g、硼酸27.5 g,定容至1 000 mL,p H 8.0)、DL2000 Marker、酵母菌基因组DNA提取试剂盒(离心柱型)天根生化科技有限公司、脱脂乳保护剂:脱脂乳粉8 g,酵母菌2 g,90 m L蒸馏水、PBS缓冲液(NaCl 0.8 g、Na2HPO40.115 g、KH2PO40.02 g、蒸馏水100 mL)。
1.3 仪器与设备
AR 2202CN电子天平,奥豪斯仪器上海有限公司;BX 50光学显微镜,日本OLYMPUS公司;移液枪、AB/Life梯度PCR仪,美国Applied Biosytems公司;LRH-500F电热恒温培养箱,上海一恒科技有限公司;UVPGDS-8000凝胶成像仪,DYY-12电泳仪,北京六一仪器厂;SX-500高压蒸汽灭菌锅,日本Tommy Digital Biology公司;垂直流超净工作台ZHJH-1214B,上海智城分析仪器制造有限公司;KDC-1044低速离心机,安敏中科中佳科学仪器有限公司;Vortex-genie2漩涡振荡器,美国Scientific Industries公司。
1.4 方法
1.4.1 菌株的分离、纯化
酵母菌菌株分离采用稀释涂布法:吸取样品0.5 mL,加入已灭菌的4.5 mL(0.85%)生理盐水中,得到10-1的稀释液,从10-1稀释液吸取500μL加到4.5 mL生理盐水中,得到10-2的稀释液,依次制成10-3~10-7的稀释液。10-1~10-7稀释液分别吸取100μL涂布于YPD琼脂培养基上,在28℃恒温培养箱倒置培养48 h,观察菌落特征,挑取形态学特征不同的单个菌落,划线于YPD琼脂培养基上培养48 h后,再进行一次划线纯化。
1.4.2 酵母菌镜检及保藏
观察纯化后的菌落形状、光滑度、大小、边缘和凹凸等特征,挑取形态不同的单个菌落于YPD液体培养基中,传三代,将第三代培养物进行革兰氏染色。首先取载玻片,用反复灼烧3次的接种环蘸取菌液,涂成均匀薄层,其次在载玻片上滴加结晶紫,染色1 min,冲洗后晾干;滴加卢哥氏染色,染色1 min,冲洗后晾干;滴加95%乙醇脱色,静置30 s,冲洗后晾干;滴加翻红染液,染色1 min,冲洗后晾干。在显微镜下进行镜检记录细胞形态及排列方式。最后将纯培养物3 800 rpm离心5 min,用PBS洗菌两次,再次离心,加入800μL脱脂乳保护剂,已灭菌的吸针吸取400μL分装至无菌螺口冻存管后液氮极冷后于-80℃冰箱保存备用。
1.4.3 酵母菌基因组DNA的提取
纯化后的菌株接种于YPD液体培养基中,28℃恒温培养箱中培养48 h,传三代,3 800 rpm离心5 min,加1 mL PBS洗菌,再次离心收取菌泥于1.5 mL灭菌EP管中,用离心柱性酵母菌基因组Dr.Gen TLE®(from Yeast)High Recovery的方法提取酵母菌DNA,于-20℃保存备用。
1.4.4 酵母菌26S rDNA PCR扩增
PCR扩增26SrDNA基因所用序列正向引物N L 1:5‘-GCATATCAATAAGCGGAGGAAAAG-3’;反向引物N L4:5‘-GGTCCGTGTTTCAAGACGG-3’。PCR扩增体系Amplification system(50μL)为:10buffer(Mg2+)/μL 5μL,d NTP/(mmol/L)4μL,forward Primer 1.5μL,reverse Primer 1.5μL,Taq DNA聚合酶0.5μL,dd H2O 35.5μL,DNA模板/ng 2μL。
基因扩增条件为:94℃5 min预变性;94℃1 min变性;58℃1 min退火;72℃2 min延伸;30个循环;72℃10 min。
1.4.5 PCR产物测序及鉴定
扩增完成后,预先制备琼脂糖凝胶,取PCR产物与6×Loading buffer混合,在1.0%琼脂糖凝胶电泳上点样,电泳结束后,用凝胶成像仪可观察到有一条清晰、明亮的条带。将扩增产物送至上海美吉生物医药科技有限公司进行双向测序。将拼接好的序列在NCBI(national center for biotechnology information)数据库中的序列进行同源序分析。
1.4.6 系统发育进化树的构建
下载模式菌株的26S rDNA D1/D2区序列和实验菌株序采用MEGA 5.2软件中的邻接(neighbor-joining,NJ)法,1000次Bootstrap检验构建酵母菌的同源序列系统发育树。
2 结果与分析
2.1 酵母菌的分离
从塔什干地区采集的10份酸牛奶和1份酸马奶样品共分离得到55株酵母菌菌株,划线接种于YPD固体培养基培养、纯化后,挑取的菌落呈圆形或椭圆形,颜色呈乳白色、乳黄色,表面凸起,边缘整齐,表面光滑湿润的单菌落,如图1(a)。涂片,革兰氏染色后,在显微镜下细胞染色为蓝色,形态为圆、椭圆、腊肠型等,初步鉴定为酵母菌,符合酵母菌特征,见图1。
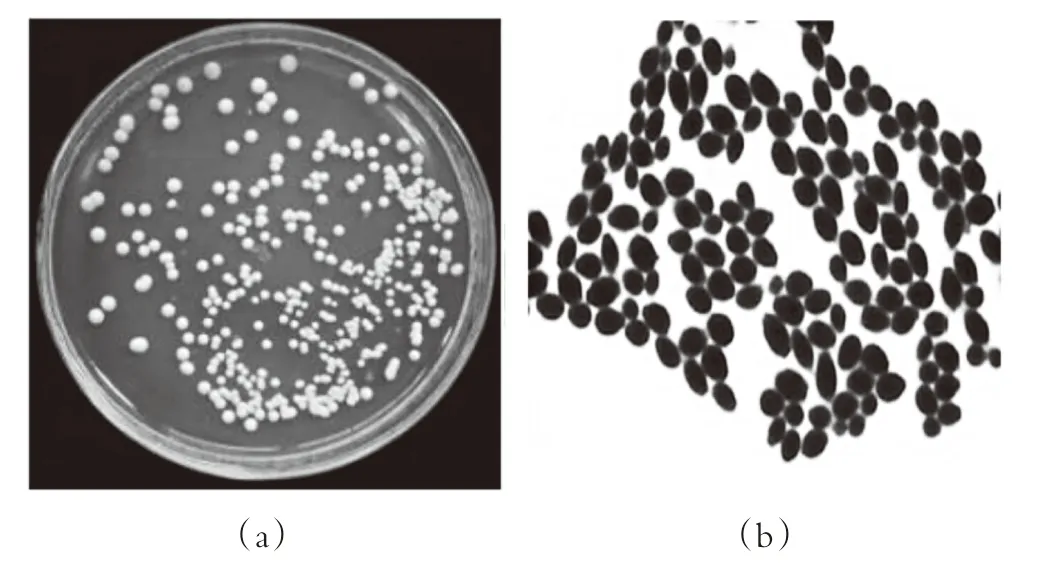
图1 酵母菌的菌落形态及普通光学显微镜下细胞形态
2.2 酵母菌26S rDNA序列PCR扩增结果
对酵母菌进行分子生物学鉴定,将所提取的菌株DNA为模板,用26SrDNA的区引物进行PCR扩增,将PCR产物与6×Loading Buffer混匀,经琼脂糖电泳后,用凝胶成像仪进行拍摄,获得约500~700 bp左右的特异性扩增条带,条带清晰明亮,并且无弥散,满足测序要求。部分菌株26S rDNA D1/D2区扩增产物电泳图如图2所示。
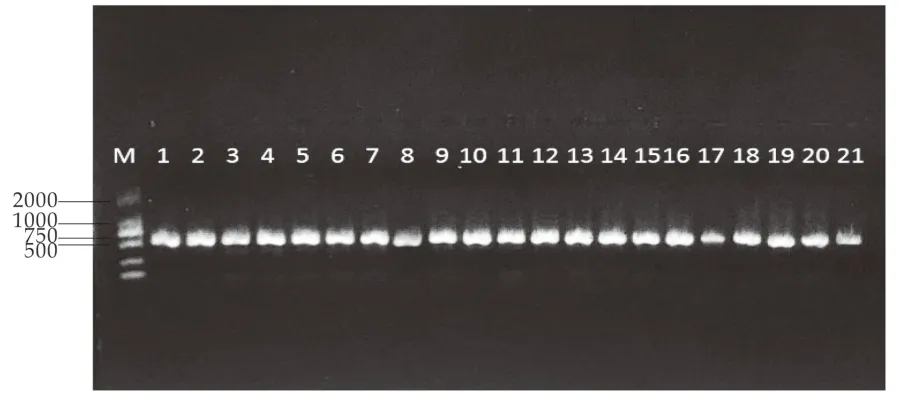
图2 部分酵母菌26SrDNA D1/D2区域的PCR扩增产物电泳图
2.3 酵母菌测序及系统发育分析
测序结果序列在GenBank数据库中进行同源序列搜索,从中挑选出具有代表性的菌株的序列与模式菌株序列做系统发育树,充分显示鉴定菌株与已知酵母菌的亲缘关系及其分类地位。
从塔什干地区10份酸牛奶样品分离出50株酵母菌,从1份酸马奶样品分离出5株酵母菌,分别属于4个属4个种,其中51株被归类于Kluyveromyces marxianus,2株被归类于Candida zeylanoides,1株被归类于Saccharomyces cerevisiae,1株被归类于Yarrowia lipolytica。结果表明,UZ11-3、UZ13-7、UZ9-3、UZ 8-4、UZ 15-9、UZ5-3、UZ16-8、UZ7-1、UZ 6-1、UZY22-8-1、UZ10-5最近缘种为Kluyveromyces marxianus ATCC 46537,相似度为100%。UZY22-4、UZY22-10最近缘的种为Candida zeylanoides TJY7b(EU 327107),相似度为100%。UZY22-3最近缘种为Saccharomyces cerevisiae ATCC 18824(KC881066),相 似 度 为100%,UZY22-6最近缘种为Yarrowia lipolytica ATCC 18942(AF335977),相似度为100%。26SrRNA序列构建系统发育如树图3所示,从图中可以看出,UZ11-3、UZ13-7、UZ 9-3、UZ 8-4、UZ 15-9、UZ 5-3、UZ16-8、UZ 7-1、UZ 6-1、UZY22-8-1、UZ10-5与Kluyveromyces marxianus ATCC 46537聚到同一分支,将其鉴定为马克斯克鲁维酵母菌,UZY22-4、UZY22-10与Candida zeylanoides TJY7b(EU 327107)聚到同一分支,将其鉴定为诞沫假丝酵母菌,UZY22-3与Saccharomyces cerevisiae ATCC 18824(KC881066)聚到同一分支,将其鉴定为酿酒酵母菌,UZY22-6与Yarrowia lipolytica ATCC 18942(AF335977)聚到同一分支,将其鉴定为解脂耶氏酵母菌。
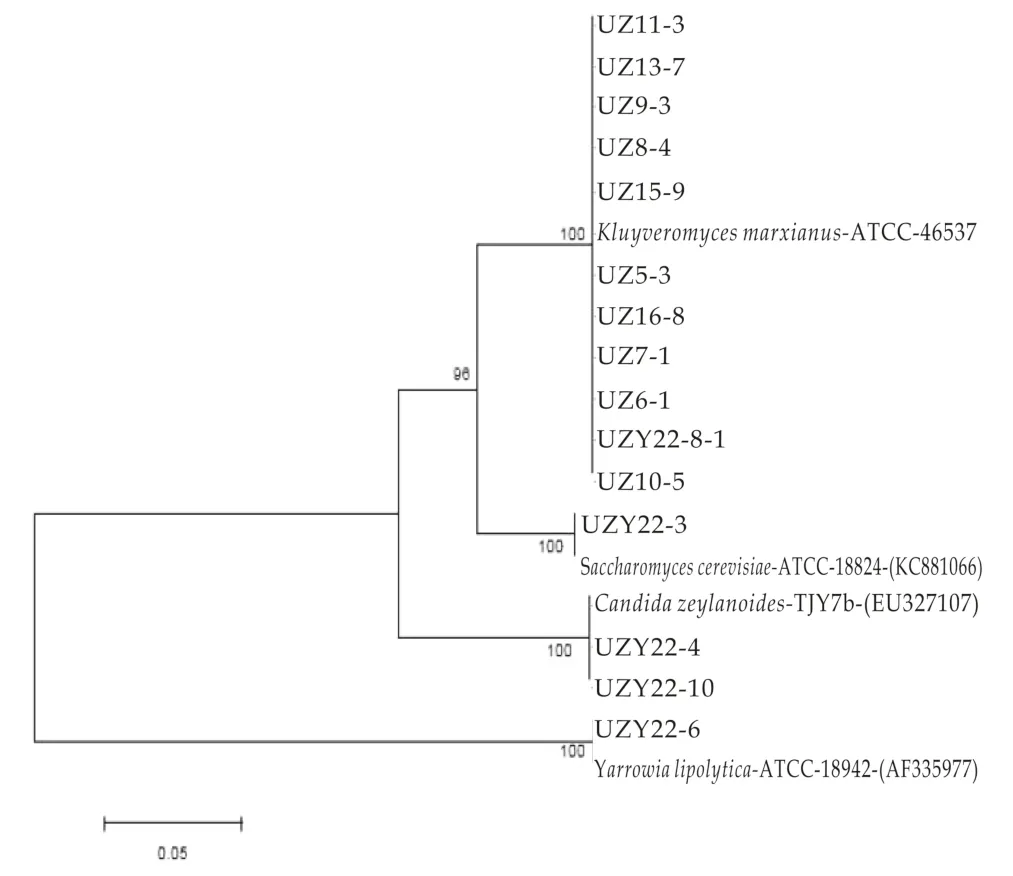
图3 乌兹别克斯坦地区代表性酵母菌株的26SrDNA D1/D2区间序列的系统发育树
3 讨 论
不同研究人员对发酵乳制品中酵母菌的鉴定结果如表2所示,Qvirist等从塔吉克斯坦雅格诺山谷酸牛奶中分离出Kluyveromyces marxianus、Pichia fermenta、Saccharomyces cerevisiae和Kazachstania unispora[15]。乔传丽[16]等人从酸牛奶中分离出Pichia kudriavzevii、Trichosporon asahii、Saccharomyces cerevisiae、Trichosporon coremiiforme等。这两个地区与本研究的酵母菌分离结果一致是Kluyveromyces marxianus。酸马奶中酵母菌组成存在异同,倪慧娟[17]等人从采集自新疆牧民家庭的酸马奶中分离到了Saccharomyces unisporus、Pichia membranaefaciens,祝春梅等人的研究则在酸马奶中发现了Galactomyces geotrichum、Kluyveromyces lactis[18],而我们从乌兹别克斯坦塔什干地区酸马奶中分离到了Candida zeylanoides、Yarrowia lipolytica。

表2 发酵乳制品中酵母菌的菌群结果比较
目前研究表明,与传统的生理生化测试相比,应用分子生物学技术是鉴定乳制品中酵母菌的可靠方法[19]。李静等[20]从新疆哈萨克族传统自制酸马奶中鉴定酵母菌菌株34株,共10个属,分别为Schizosaccharomyces、Sehizoblastosporion、Torulopsis、Saccharomycodes、Kloechera、Kluveromyces、Dekker、Trichosporon、Hansenula、Brettanomyces。Mu等[21]从我国3个地区共分离出655株酵母菌,发现优势菌为Kluyveromyces marxianus、Kazachstania unispora和Saccharomycescerevisiae。本研究酸牛奶样品的主要分离物为马克思克鲁维酵母菌,与上述研究有相同之处。而马克思克鲁维酵母菌可以产生芳香化合物,这也是乳制品中具有独特风味的原因之一。
发酵乳制品中蕴藏着大量的具有优良特性和益生作用的酵母菌。随着对传统发酵乳制品中酵母菌研究的深入,越来越多的酵母菌种属在各种乳制品中被分离到,刘飞[22]从奶酪样品中分离筛选出4株潜在益生酵母菌,两株属毕赤酵母属,一株属马克思克鲁维酵母属,一株酿酒酵母属。陈历水[23]从北京和哈尔滨地区原料乳中筛选出3株有潜在益生功能的菌株。酵母菌在发酵和成熟过程中影响产品的风味作为附属发酵剂,研究表明具有潜在益生特性的酵母菌还能抑制有害菌的生长,产生多种水溶性维生素,提高发酵乳制品的营养物质。
本研究的结果与先前的研究存在异同。这可能是因为地理位置、气候、制作工艺的不同造成的,本研究也进一步证明地理位置对自然发酵乳中酵母菌组成具有重要的影响作用。
4 结 论
本研究从塔什干地区发酵乳制品中分离出55株酵母菌,分别4个属4个种,其中Kluyveromyces marxianus51株,Candida zeylanoides 2株,Saccharomyces cerevisiae1株和Yarrowia lipolytica 1株。塔什干地区酸牛奶样品中Kluyveromyces marxianus是主要的分离菌株。本研究对塔什干地区发酵乳制品微生物资源的保护及研究提供菌株。

