内蒙古传统发酵乳制品中益生酵母菌的筛选及其对Cheddar干酪质构的影响
刘敏,曹志军,苏杰,李艳梅
(内蒙古农业大学职业技术学院食品工程技术系,内蒙古,包头014109)
0 引 言
内蒙古地区地域辽阔,蒙古族畜牧养殖业具有非常悠久的历史,养殖业的发展丰富了传统发酵乳制品,如酸奶、马奶酒、成熟及半成熟干酪等产品的加工,传统乳制品中孕育着极其丰富的、多样性的微生物菌群[1]。由于蒙古族地域差别和制作工艺的多样化,在不同地区干酪成熟过程中微生物菌群多样性构成与干酪质构的形成密切相关[2]。最近发现有些酵母菌对人体存在益生作用,应用其益生特性加工乳制品不仅会对产品风味和质构产生影响,而且也可有效抑制有害菌的生长繁殖。有研究表明,有些酵母菌不会对乳制品的品质造成负面影响,相反,还会对发酵乳制品提供有益作用,并且对干酪的风味和质构形成起到非常重要的影响[3]。在干酪成熟过程中,酵母菌可发酵利用葡萄糖等单糖类产生CO2气体,这也是干酪形成孔状结构的必要条件,同时,酵母菌对一些腐败微生物和腐败梭状芽孢杆菌的生长同样具有抑制作用;并且可使多种有机物质分解产生多种水溶性维生素,使乳制品的营养价值显著提高;除此以外,酵母菌还具有预防和治疗急性痢疾、降低机体胆固醇、抗氧化和抗辐射等益生活性作用[4]。因此,从原料乳中筛选出益生酵母菌进而应用于乳品生产中具有重要意义。
近年来,大量的酵母菌应用于软质干酪的研究,但对于硬质干酪中酵母菌特性、对干酪品质影响研究很少,其中质构是影响消费者购买干酪最关键品质之一。质构是指通过视觉或听觉利用机械、触觉感受到的产品所具有的流变和结构上的属性的变化程度[5]。本实验将分离筛选的益生酵母菌用于cheddar干酪生产中,研究其在成熟过程中对干酪质地的影响,评价其作为cheddar干酪附属发酵剂的可实现性,为发掘传统发酵乳制品中具有特殊作用的酵母菌资源提供依据。
1 实 验
1.1 材料与仪器
酵母膏胨葡萄糖培养基、革兰氏染液,杭州微生物制剂有限公司;直投式干酪发酵剂(50U),丹尼斯克公司;凝乳酶,科汉森公司。
TA.XT-2i型质构仪,英国Stable Microsystem公司;S-3400N扫描电子显微镜,日本日立公司;AC-S型洁净工作台,苏州安泰空气技术有限公司;PHSJ-3F型p H测试仪,雷磁。
1.2 方法
1.2.1 酵母菌的分离
1.2.1.1 试验样品采集
从内蒙古的阿拉善、伊盟、锡盟和通辽等地区采集传统发酵乳样品15个,标号记录采样地点后封口低温4℃储存,带回实验室尽快进行酵母菌的分离。
1.2.1.2 样品中酵母菌的分离
参考文献[6]的方法:通过稀释法将样液涂布于YPD培养基上,28℃恒温培养24~48 h,挑取单个菌落进行革兰氏染色,重复几次纯化酵母菌,镜检结果为同一细胞形态后,将其接种于YPD液体培养基中,纯培养物中加入30%的灭菌甘油,混匀后在-80℃条件下保存备用。
1.2.2 潜在益生酵母菌的筛选
1.2.2.1 耐酸试验
测定筛选菌株的酸耐受性,试验调配培养基的p H值为(1.5、2.0、3.0、5.0和6.5),在不同p H值条件下测试32株酵母菌的耐酸能力。菌株活化后制得菌悬液,在5种不同p H值的液体筛选培养基中加入4%的菌悬液[7],取p H值7.0为空白对照。在30℃温度下,转速为180 r/min的摇床上培养24 h后测定OD600nm吸光度。
1.2.2.2 耐胆盐试验
将以上筛选酸耐受性较好的酵母菌,接种在含猪胆盐质量浓度为0%、0.2%、0.4%、0.6%的固体胆盐培养基中,恒温培养12 h,采用菌落平板计数法计算活菌数[8]。观察接种酵母菌株在不同胆盐浓度下其生长状况,胆盐的耐受能力计算公式表示为:耐受性(%)=ΔE/ΔF×100;ΔF:测定对照培养基中细胞增长量,ΔE:测定添加胆盐培养基中细胞增长量。
1.2.2.3 模拟人体温度下的生长测试
将筛选菌株的悬液接种到YEPD固体培养基上,每株菌做3次平行实验,在摇床(180 r/min),温度37℃条件下培养24 h,采用活菌平板计数法进行计数。
1.2.2.4 模拟人体胃液环境
以上试验筛出的酵母菌活化后,抽取25 mL酵母菌纯培养物在37℃、3 000 rpm下离心10 min,取其菌悬液,所得细胞用无菌PBS缓冲溶液(0.1 mol/L,p H为7.0,其中NaCL浓度为80 g/L)按1:9比例进行稀释。取0.1 m L悬浮液添加到1.0 m L模拟胃液(5 g/L NaCL和3 g/L胃蛋白酶)中,加HCL调节p H值为1.2,混合物在37℃,150 r/min摇床上培养2 h后,在600 nm时测其OD值,通过浊度变化测其菌数,计算方法表示为:菌数降低率(%)=(OD末-OD初)/OD初×100;OD初:对照组的初始吸光值,OD末:模拟胃液中的吸光值[9]。
1.2.3 切达干酪生产工艺流程
对经过益生筛选得到的酵母菌进行活化,使菌株活性达到107cfu/mL以上,切达干酪经上述工艺加工,在堆酿完成后将凝块切碎、添加适量酵母菌液,菌液添加量质量分数为1%,与不添加酵母菌的空白对照。干酪压制成形,成熟后测定其质构变化情况。
1.2.4 成熟期间干酪质构测定
加工好的干酪,分别抽取成熟0、15、30 d样品,在室温下放置2 h后,将样品切为2.00±0.04 cm左右的正方形,利用质构仪(QTs25)进行TPA分析。测定条件为:温度19±2℃,样品温度10±0.5℃。测量参数:探头类型为P/5,触发力为0.2 N;下压变形为10 mm;测试速率为5 mm/s;质构仪前探头下降速率为2 mm/s;测量探头回程速率为2 mm/s。样品放置在平衡盘上进行测定,结果取3次平均值[10]。
1.2.5 统计分析
实验数据采用SPSSl3.0软件,通过方差分析(ANOVA)法对实验数据进行差异显著性分析。
2 结果与分析
2.1 酵母菌分离菌株的菌落形态及细胞形态特征
从内蒙古15份传统发酵乳样品中分离到的32个优势菌株,菌落形态呈圆形,表面光滑湿润,颜色呈乳白色,表面凸起、边缘整齐、不透明。显微镜下美蓝细胞染色观察为蓝紫色,形态呈现圆形、椭圆形、卵圆形等形状,以一端出芽的方式芽殖,细胞形态均符合酵母菌特征。
2.2 益生菌筛选试验
对筛选32株酵母菌进行益生性筛选实验发现,在不同p H值条件下,(X 4和Y2)菌株均能够正常生长,且生长活性较高,在高酸(p H=1.5)条件下,测定其吸光值均高于0.4,在此条件下,酵母菌细胞均能存活,表明这2株菌具有较好的耐酸特性。在胆盐含量浓度达到1 g/L条件下,(X 4和Y2)菌株增长率分别达到13.68%、6.05%,而在5 g/L胆盐下增长率分别为13.01%、3.03%,增长率略微下降,说明X 4和Y2在5 g/L胆盐下具有一定的生长力、耐受性。在模拟胃液中培养4 h后,X 4和Y2株酵母菌数量略微降低,有较好的耐胆盐性,具有一定的存活性。菌株耐温性实验中,(X 4和Y2)菌株在37℃恒温培养24 h,2株酵母菌生长正常,结果显示37℃条件菌株生长不受影响。经过以上多条件筛选试验后得出:X 4和Y2菌株具有潜在益生功能。观察其菌落形态及其结构形态,结果见图1和图2。
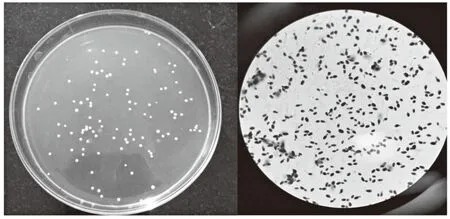
图1 X4酵母菌菌落形态及细胞形态
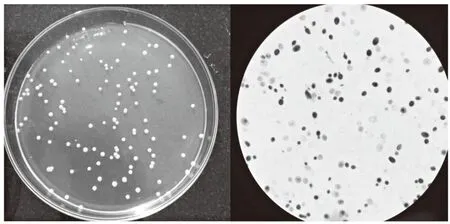
图2 Y2酵母菌菌落形态及细胞形态
2.3 不同抑菌膜包装Cheddar干酪质构的变化
添加X 4和Y2株菌制得Cheddar干酪,贮藏在4℃条件下,取成熟0、15、30 d的样品,与未添加酵母菌样品干酪进行对照,测定其质构的变化,表1中列出了不同成熟期干酪TPA检验的质构参数。
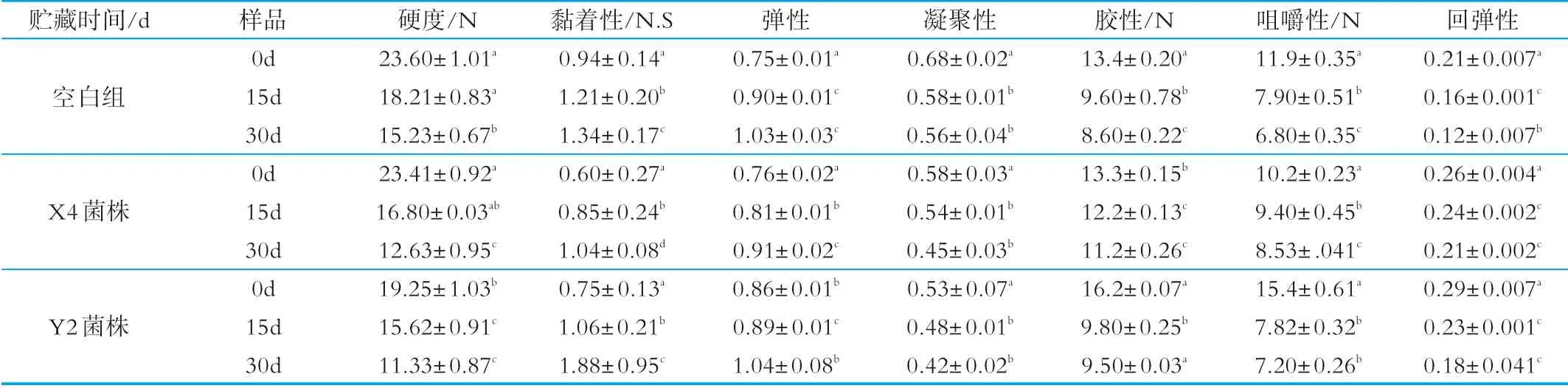
表1 添加X 4和Y2菌株Cheddar干酪的质地随成熟时间的变化情况
干酪的质构特征表现受干酪的成熟度、成份组成、组织结构以及各分子间的拉伸力等因素影响,质构通常是用来表征干酪成熟期间变化的重要指标[11]。从表1可见,添加X 4和Y2菌株后,Cheddar干酪的硬度随着成熟时间的延长而降低,且X 4菌株Cheddar干酪组硬度大于Y2菌株Cheddar干酪组,成熟时间对硬度的影响极显著(P<0.05);各处理组黏着性和弹性的数值是逐渐上升的,且空白组上升参数最大,Y2菌株Cheddar干酪组次之,X 4菌株Cheddar干酪组上升最小,其差异性均显著(P<0.05);凝聚性、胶性、咀嚼性和回弹性在贮藏期间都呈下降趋势,凝聚性空白组较大,X 4菌株Cheddar干酪组最小,各组随着贮藏时间的延长,其变化不显著(P>0.05);胶性在7 d时较大,14 d后下降趋于平缓,且X 4菌株Cheddar干酪组较大,统计分析显示胶性在整个成熟期内差异显著(P<0.05);咀嚼性和回弹性Y2菌株Cheddar干酪在7 d时较大,14 d后每组下降趋于平缓,成熟期内差异性显著(P<0.05)。
3 结 论
从内蒙古地区传统发酵乳制品中分离筛选得到32株酵母菌,对其进行了益生性能筛选试验,测定其在不同p H(1.5~6.5)值条件下、不同胆盐浓度范围(0%~0.6%)、模拟人体胃液和模拟人体温度条件37℃测其细胞数和OD值进行了耐受性益生性分析,最后筛选得到2株(X 4和Y2)存活率较好的潜在益生酵母菌。后续利用酵母菌与乳酸菌共生发酵作用制作Cheddar干酪。在不同成熟阶段利用质构仪分析了干酪质构变化情况,结果显示,随着干酪成熟时间的延长,X 4菌株对干酪硬度影响较大;Y2菌株对黏着性和弹性影响显著;2株菌均对胶性、咀嚼性、凝聚性和回弹性影响显著。

