蒙药点地梅HPLC指纹图谱研究
王鑫晶,王建娜,萨仁高娃,成日青,布仁,李书迪,齐和日玛
蒙药点地梅HPLC指纹图谱研究
王鑫晶1,王建娜1,萨仁高娃2,成日青1,布仁1,李书迪1,齐和日玛1
1.内蒙古医科大学药学院,内蒙古 呼和浩特 010110;2.内蒙古医科大学蒙医药研究院,内蒙古 呼和浩特 010110
建立蒙药点地梅的HPLC指纹图谱,为其质量评价提供参考。采用高效液相色谱法,COSMOSIL 5C18-MS-Ⅱ色谱柱(4.6 mm×250 mm,5 μm),以乙腈(A)-0.5%磷酸水溶液(B)为流动相,梯度洗脱,流速0.8 mL/min,柱温35 ℃,检测波长360 nm。采用《中药色谱指纹图谱相似度评价系统》(2012版)对9批点地梅样品指纹图谱进行相似度评价,通过液相色谱-质谱技术进行定性分析,并结合聚类分析、主成分分析和正交偏最小二乘-判别分析进行整体质量评价。建立了点地梅的指纹图谱共有模式,9批样品相似度较好;初步鉴定指认了其中8个共有峰;化学模式识别可将9批样品聚为3类。本研究建立的点地梅指纹图谱结合化学模式识别方法灵敏度高、专属性强,可为点地梅的质量评价提供依据。
点地梅;高效液相色谱法;指纹图谱;相似度;化学模式识别
点地梅为报春花科点地梅属北点地梅L.的干燥全草,是蒙医常用药,蒙药名为“达兰-套布其”,具有清热、解毒、消肿、疗伤、祛协日乌素、滋养强壮功效,主治创伤化脓疼痛、脓毒性关节炎、协日乌素症、赫依协日乌素合并症[1-2]。目前,点地梅质量控制标准的研究尚不完整,有文献报道采用HPLC测定点地梅主要成分槲皮素、山柰素的含量[3-4],但不能很好地控制其质量。本研究采用HPLC建立点地梅的指纹图谱,并进行相似度评价,通过化学模式识别方法筛选点地梅的主要标志性成分,为蒙药点地梅的质量控制提供参考。
1 仪器与试药
LC-2130 3D高效液相色谱系统(PDA检测器,LabSolutions色谱工作站),日本岛津公司;UltiMate 3000型快速超高效液相色谱仪(包括二极管阵列检测器、双三元梯度泵、在线脱气机、自动进样器),美国Thermo Fisher公司;四极杆-静电场轨道阱高分辨质谱系统(包括ESI源、Thermo Xcalibur3.1.66.10数据处理系统),美国Thermo Fisher公司;HH-S4数显恒温水浴锅,江苏金怡仪器科技有限公司;BSA124S电子分析天平,赛多利斯科学仪器有限公司;KH-250DB型数控超声波清洗器,昆山禾创超声仪器有限公司;JSP-100型高速多功能粉碎机,浙江省永康市金穗机械制造厂;ALH-6000-0艾科浦超纯水机,重庆颐洋企业发展有限公司。
点地梅样品S1~S9分别采自内蒙古乌兰察布、蛮汉山-1、蛮汉山-2、苏木山、呼伦贝尔、阿尔山、小井沟-1、小井沟-2、赤峰,经内蒙古医科大学药学院生药学教研室渠弼副教授鉴定为报春花科点地梅属植物北点地梅L.的干燥全草。芦丁对照品(批号100080-200707,供含量测定用),中国食品药品检定研究院;槲皮素对照品(批号100081-200907,纯度>98.6%),北京中科质检生物技术有限公司;山柰素对照品(批号110861- 200606,供含量测定用),北京中科质检生物技术有限公司;紫云英苷对照品(批号160118,纯度>98%),北京中科仪友化工技术研究院;乙腈、甲醇(色谱纯),Fisher Scientific;其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件
采用COSMOSIL 5C18-MS-Ⅱ色谱柱(4.6 mm×250 mm,5 μm),以乙腈(A)-0.5%磷酸水溶液(B)为流动相,梯度洗脱(0~40 min,14%A;40~60 min,14%~60%A),流速0.8 mL/min,柱温35 ℃,检测波长360 nm,进样量10 μL。
2.2 质谱条件
ESI离子源,负离子模式,离子源喷雾电压3 500 V,离子源温度400 ℃,鞘流气流量45 L/h,辅助气体为N2,辅助气体流速2 L/h,辅助器温度100 ℃,扫描范围110~1 500 m/z。
2.3 混合对照品溶液制备
分别精密称取芦丁、紫云英苷、槲皮素、山柰素对照品适量,置于50 mL容量瓶中,加入甲醇,摇匀,超声溶解,定容至刻度,过0.45 μm微孔滤膜,取续滤液,即得。
2.4 供试品溶液制备
精密称取约0.5 g点地梅粉末,置于100 mL具塞锥形瓶中,精密加入70%甲醇溶液25 mL,摇匀,密塞称重,于恒温水浴锅80 ℃回流提取1 h,冷却至室温,再次称定质量,用70%甲醇溶液补足减失的质量,离心,取上清液,过0.45 μm微孔滤膜,取续滤液,即得。
2.5 指纹图谱方法学考察
2.5.1 精密度试验
取点地梅样品(S1),按“2.4”项下方法制备,按“2.1”项下色谱条件连续进样6次,检测指纹图谱,以9号色谱峰为参照,计算各共有峰相对保留时间和相对峰面积,结果RSD分别为1.04%~2.18%和0.30%~2.31%,表明仪器精密度良好。
2.5.2 稳定性试验
取点地梅样品(S1),按“2.4”项下方法制备,按“2.1”项下色谱条件,分别于0、2、4、6、8、10、12、24 h进样,检测指纹图谱,以9号色谱峰为参照,计算各共有峰相对保留时间和相对峰面积,结果RSD分别为0.04%~2.25%和0.14%~3.07%,表明供试品溶液在24 h内稳定性良好。
2.5.3 重复性试验
取点地梅样品(S1),按“2.4”项下方法平行制备6份,按“2.1”项下色谱条件进样,检测指纹图谱,以9号色谱峰为参照,计算各共有峰相对保留时间和相对峰面积,结果RSD分别为0.01%~0.34%和0.95%~2.77%,表明该方法重复性良好。
2.6 指纹图谱建立及相似度评价
分别取9批点地梅样品(S1~S9),按“2.4”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定。将9批点地梅样品图谱数据导入《中药色谱指纹图谱相似度评价系统》(2012版),进行数据多点校正及全峰匹配,建立9批样品的叠加HPLC指纹图谱及对照指纹图谱,共确定21个共有峰,见图1、图2。计算9批样品指纹图谱相似度,结果见表1。9批点地梅样品指纹图谱相似度良好。
2.7 指纹图谱共有峰指认
吸取点地梅供试品溶液,注入LC-MS仪,按“2.2”项下条件进行检测。根据文献检索,对比总离子流图各色谱峰的保留时间,结合各色谱峰的一级、二级质谱信息及紫外光谱信息,确定主要色谱峰结构,初步指认出不同批次点地梅指纹图谱中8个共有峰,分别为山柰酚-3-O-(二鼠李糖)-芸香糖-7-O鼠李糖苷(5号峰)、槲皮素-3-O-(二鼠李糖)-芸香糖苷(9号峰)、芦丁(13号峰)、异鼠李素-3-O-芸香糖苷(16号峰)、紫云英苷(18号峰)、异槲皮苷(19号峰)、槲皮素(20号峰)、山柰素(21号峰),并用其中4种成分的对照品进行确证,见图3、表2。
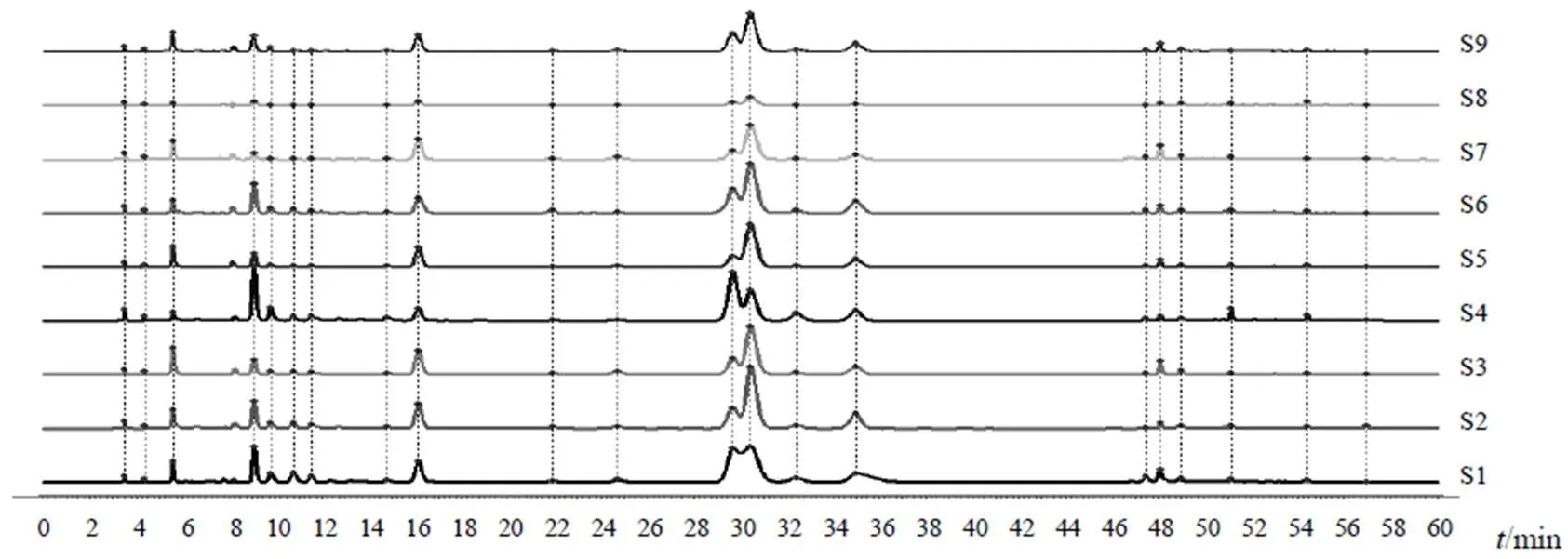
图1 9批点地梅样品HPLC叠加图谱
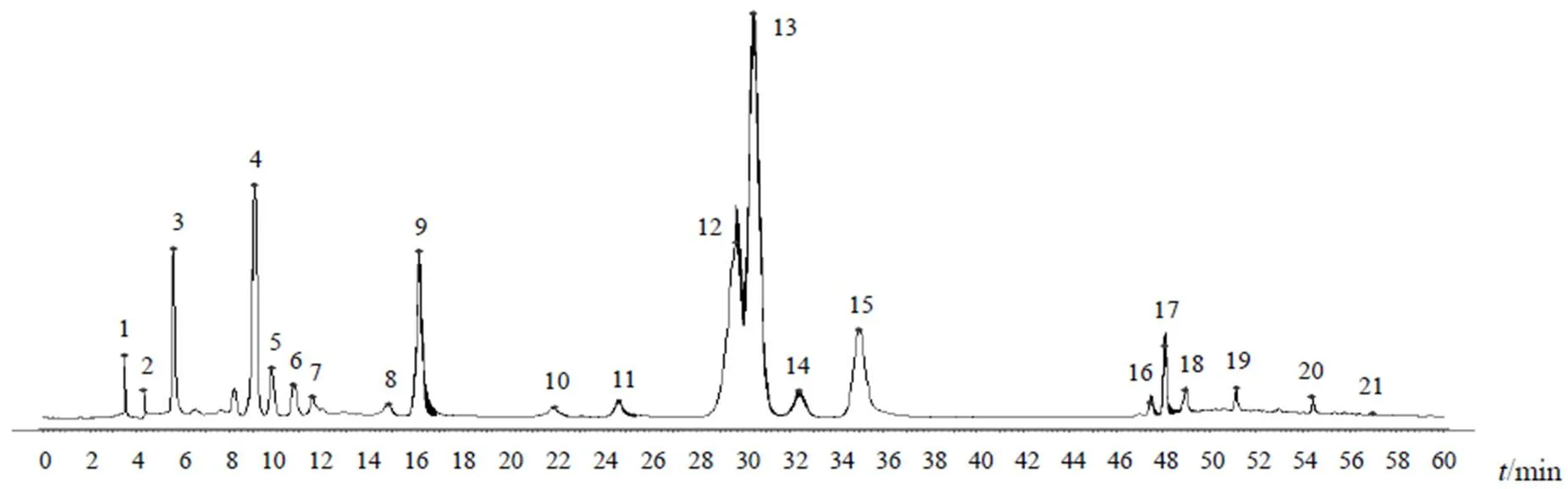
图2 点地梅对照指纹图谱
表1 9批点地梅样品指纹图谱相似度评价结果(r)
批号S1S2S3S4S5S6S7S8S9 S11.000 S20.9391.000 S30.9210.9911.000 S40.9470.7970.7561.000 S50.8990.9910.9960.7241.000 S60.9670.9910.9730.8620.9681.000 S70.8830.9740.9940.6930.9920.9461.000 S80.9350.9850.9830.8000.9790.9810.9721.000 S90.9620.9940.9890.8360.9820.9940.9700.9861.000 对照0.9760.9900.9810.8650.9720.9960.9570.9840.998
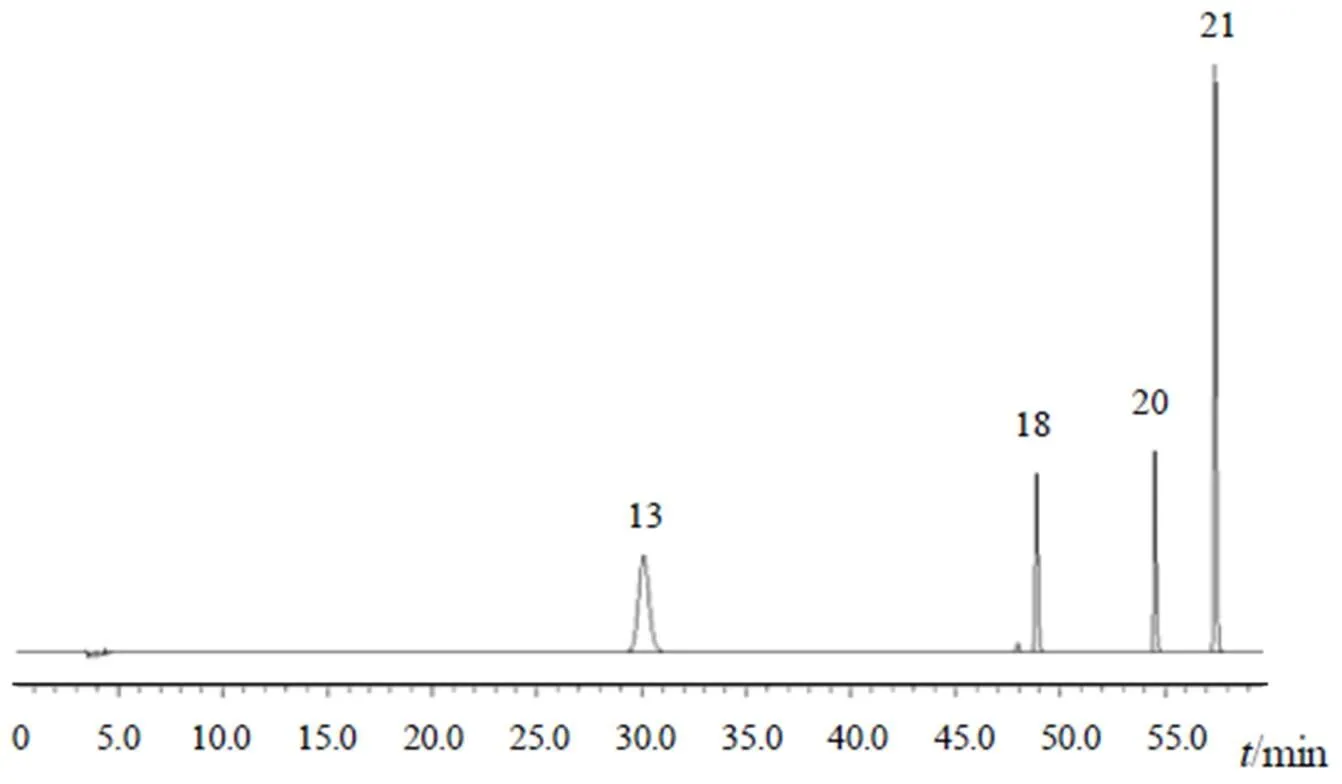
注:13.芦丁;18.紫云英苷;20.槲皮素;21.山柰素
表2 点地梅指纹图谱部分共有峰质谱数据
峰号tR/min分子式准分子离 子[M-H]-二级主要碎片离子误差 (×10-6)推测成分文献 5 8.61C39H50O23885.174 38575.814 76,473.160 00,327.110 00,284.200 00, 255.051 70-5.395山柰酚-3-O-(二鼠李糖)-芸香糖-7-O鼠李糖苷[5] 915.59C33H40O20755.206 97609.145 81,591.135 74,489.104 46,343.048 46, 325.034 33,300.028 26,271.024 60,255.030 535.363槲皮素-3-O-(二鼠李糖)-芸香糖苷[5] 1329.66C27H30O16609.148 32343.046 88,301.035 31,255.031 565.432芦丁*[5] 1647.29C28H32O16623.164 55315.051 36,300.027 98,271.024 446.241异鼠李素-3-O-芸香糖苷[5] 1848.71C21H20O11447.094 45227.034 62,284.033 295.060紫云英苷*[6] 1951.84C21H20O12463.090 12301.030 61,152.070 89-6.169异槲皮苷[7] 2054.28C15H10O7301.036 07178.998 03,151.002 915.949槲皮素*[6] 2157.65C16H12O6299.141 91182.987 66,112.986 593.668山柰素*[8]
注:*经对照品确证
2.8 化学模式识别分析
2.8.1 聚类分析
将9批点地梅样品指纹图谱21个共有峰的相对峰面积导入SPSS19.0统计软件,采用组间连接法,以欧式距离平方作为测量度,进行聚类分析,结果见图4。9批点地梅样品可分为3类:第1类为S1~S3、S5~S7、S9,第2类为S4,第3类为S8。聚为一类的样品之间有较好的相似性,与相似度评价结果较为一致。

图4 9批点地梅样品聚类分析树状图
2.8.2 主成分分析
采用SPSS19.0软件,以21个共有峰的相对峰面积为变量,对9批点地梅样品进行主成分分析(PCA)。选取特征值>1的前5个成分为主成分,其累计方差贡献率为97.610%(见表3),表明这5个主成分可代表样品的大部分信息。第1主成分中4、5、12、14号峰有较高的载荷值,第2主成分中3、9号峰有较高的载荷值,第3主成分中11、17号峰有较高的载荷值,第4主成分中10、16、17、18、21号峰有较高的载荷值,第5主成分中6、16号峰有较高的载荷值,表明多个化学成分协同影响点地梅的整体质量(见表4)。
2.8.3 正交偏最小二乘-判别分析
将9批点地梅样品共有峰的相对峰面积导入SIMCA-P14.1软件,进行正交偏最小二乘-判别分析(OPLS-DA),得分图见图5。9批样品可聚类为3类,与聚类分析和PCA结果一致。提取OPLS-DA模型中21个变量的变量重要性投影(VIP)值并从大到小排序,结果见图6。以VIP>1作为引起点地梅批次间差异的主要标志性成分,色谱峰(VIP值)分别为20号峰(1.239 6)、9号峰(1.231 4)、3号峰(1.171 2)、11号峰(1.133 3)、13号峰(1.108 4)、21号峰(1.103 3)、19号峰(1.082 3)、14号峰(1.037 3)、5号峰(1.019 5)、12号峰(1.019 4)、4号峰(1.019 1)、17号峰(1.014 5)、8号峰(1.007 2),对其聚类有显著影响。
表3 点地梅样品指纹图谱主成分分析特征值及方差贡献率
主成分特征值方差贡献率/%累计方差贡献率/% 19.97747.50947.509 26.21629.60177.110 31.824 8.68485.794 41.327 6.31792.111 51.155 5.49997.610
表4 点地梅样品指纹图谱色谱峰主成分因子载荷矩阵
峰号主成分1主成分2主成分3主成分4主成分5 10.082-0.0110.1240.178-0.360 20.091-0.0290.1530.116-0.179 30.0210.1420.1830.017-0.138 40.097-0.029-0.069-0.0700.069 50.096-0.0340.006-0.0740.083 60.0780.040-0.038-0.2780.350 70.093-0.0160.053-0.2010.054 80.084-0.0650.144-0.008-0.123 90.0340.1460.078-0.084-0.034 100.0300.063-0.4300.2300.112 110.0220.1380.2390.0490.138 120.097-0.026-0.013-0.0150.114 130.0400.127-0.188-0.065-0.247 140.095-0.0460.041-0.0460.016 150.0720.059-0.279-0.104-0.198 160.068-0.0150.0510.2080.574 17-0.0080.1250.2300.3320.091 180.0620.043-0.1620.504-0.025 190.071-0.0990.0230.161-0.161 200.014-0.1520.0330.033-0.103 21-0.054-0.118-0.0060.2560.111
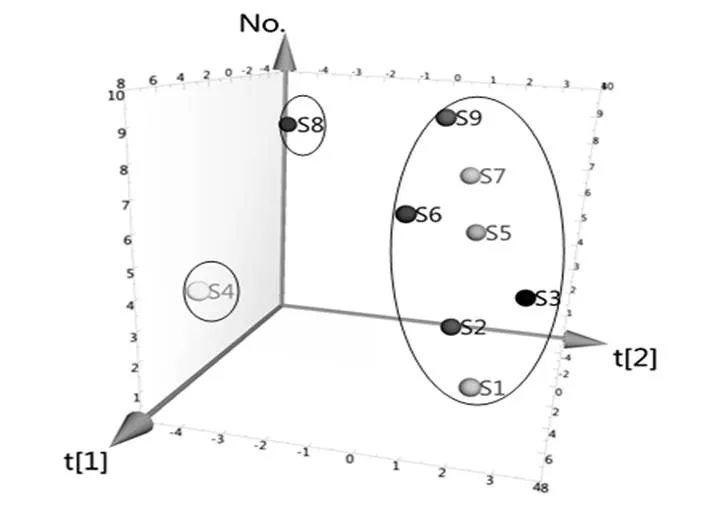
图5 9批点地梅样品OPLS-DA得分图
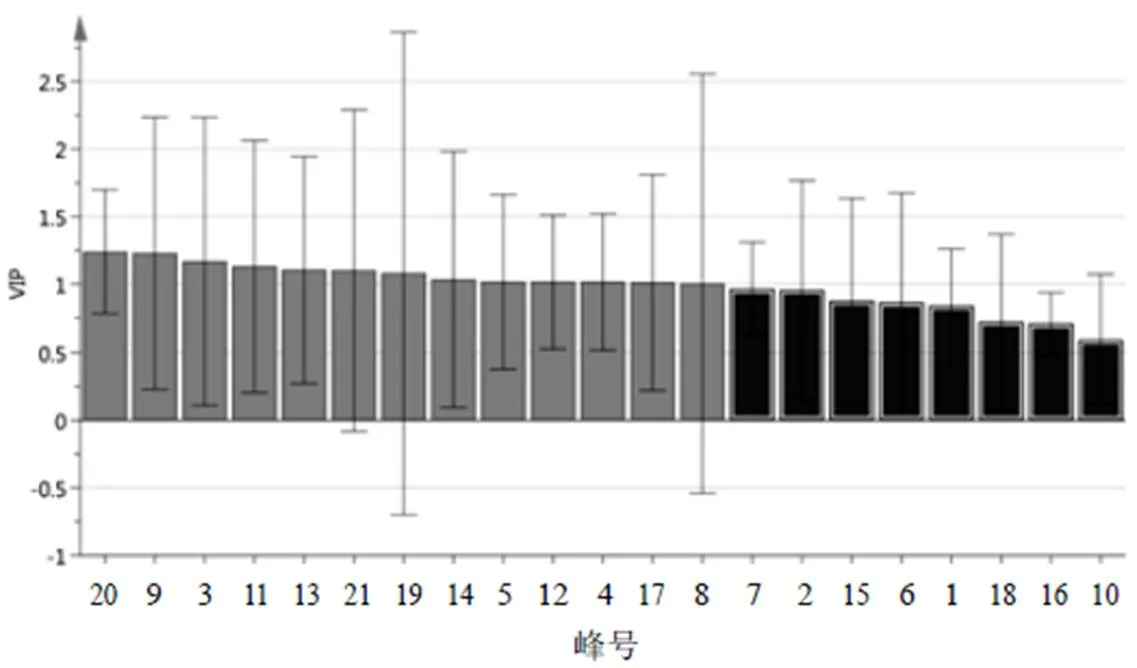
图6 9批点地梅样品OPLS-DA差异标志物VIP图()
3 讨论
本试验制备供试品溶液时,比较了水、50%甲醇、70%甲醇及甲醇的提取效果,结果70%甲醇提取的色谱峰数目多、响应值大;比较超声和回流2种提取方式,结果回流提取效率较高;比较加热回流时间对提取率的影响,结果加热回流1 h以上提取率无明显差异。故选择70%甲醇回流提取1 h制备供试品溶液。
在色谱条件选择上,本试验比较了乙腈-水、甲醇-水流动相系统对色谱峰的影响,结果用乙腈-水进行梯度洗脱时色谱图分离效果较好,峰数目较多;比较乙腈与不同浓度磷酸水溶液为流动相时对色谱峰的影响,结果乙腈-0.5%磷酸水溶液作为流动相时效果最佳。在检测波长的选择上,本试验利用二极管阵列检测器对样品进行分析,观察全谱的分离与吸收情况,结果波长为360 nm时出峰数量多,基线较平稳,信号响应值大,故选择360 nm作为检测波长。
本试验建立了蒙药点地梅的指纹图谱,确定了21个共有峰,并对9批样品指纹图谱的相似度进行评价,结果显示与对照指纹图谱有良好的相似性。根据色谱峰的分离情况,9号峰槲皮素-3-O-(二鼠李糖)-芸香糖苷分离度较好,峰面积相对较大,位置居中,故选择该峰为参照峰。同时,采用四极杆-静电场轨道阱高分辨质谱对点地梅指纹图谱中主要色谱峰进行定性分析,通过质谱库及文献检索,初步指认了8个特征峰,并采用对照品随行对照确证了其中4个化学成分。
聚类分析、PCA和OPLS-DA结合HPLC指纹图谱能够对不同产地、批次中药进行聚类鉴别和成分判别分析。本研究通过化学模式识别分析,建立了点地梅聚类分析、PCA和OPLS-DA分类模型,3种方法分析结果基本一致,均将9批样品归为3类;PCA以载荷值结果筛选得到15个差异性成分,OPLS-DA以共有峰VIP>1筛选得到13个主要差异性物质,点地梅样品间的差异性主要体现在3、4、5、9、11、12、14、17、21号峰,其中,5号峰为山柰酚-3-O-(二鼠李糖)-芸香糖-7-O鼠李糖苷、9号峰为槲皮素-3-O-(二鼠李糖)-芸香糖苷、21号峰为山柰素。本研究建立的HPLC指纹图谱及化学模式识别分析结果可为点地梅的质量控制和评价提供一定参考。
[1] 国家中医药管理局《中华本草》编委会.中华本草:蒙药卷[M].上海:上海科学技术出版社,2004:300.
[2] 《蒙古学百科全书》编委会.蒙古学百科全书:医学[M].呼和浩特:内蒙古人民出版社,2012:977.
[3] 齐和日玛,萨仁高娃,渠弼,等.蒙药材东北点地梅的质量标准研究[J].中医药导报,2019,25(9):69-72,93.
[4] 齐和日玛,成日青,那生桑,等.内蒙不同产地东北点地梅中槲皮素和山柰素含量测定[J].中国中医药信息杂志,2018,25(10):88-90.
[5] 古丽斯坦•阿不来提,迪里木拉提•毛里明,姚军.阿勒泰锦鸡儿花及叶中总黄酮的超声提取工艺、抗氧化活性及化学成分研究[J].新疆医科大学学报,2018,41(1):92-96,101.
[6] 许文,傅志勤,林婧,等.HPLC-Q-TOF-MS和UPLC-QqQ-MS的三叶青主要成分定性与定量研究[J].中国中药杂志,2014,39(22):4365-4372.
[7] 王翼,顾苑婷,丁筑红,等.超高效液相色谱-串联高分辨质谱对刺梨槲皮素及其糖苷类化合物的鉴定分析[J].分析化学,2020,48(7):955- 961.
[8] 安欣欣,李媛媛,战妍妃,等.基于UPLC-Q-Exactive和HPLC对蒲公英总黄酮部位成分分析及主成分的含量测定[J].中药新药与临床药理, 2019,30(1):99-105.
Study on HPLC Fingerprints of Mongolian Medicine Androsacis Herba
WANG Xinjing1, WANG Jianna1, Sarengaowa2, CHENG Riqing1, Buren1, LI Shudi1, Qiherima1
To establish the HPLC fingerprints of Mongolian medicine Androsacis Herba; To provide references for its quality control.The HPLC analysis was carried on a COSMOSIL 5C18-MS-Ⅱ column (4.6 mm × 250 mm, 5 μm); the mobile phase was acetonitrile (A)-0.5% phosphoric acid aqueous solution (B) with gradient elution at the flow rate of 0.8 mL/min; the temperature was 35 ℃; the detection wavelength was 360 nm. The Similarity Evaluation System for Chromatographic Fingerprint of TCM (2012 edition) was used to evaluate the fingerprints similarity of 9 batches of samples. Qualitative analysis was carried out by LC-MS technology. The overall quality evaluation of Androsacis Herba was carried out by combining cluster analysis, principal component analysis and orthogonal partial least square discrimination.The common mode of HPLC fingerprints of Androsacis Herba was established, and the similarity of 9 samples was good; 8 compound peaks were determined preliminary; 9 batches of samples were aggregated into 3 categories by chemical pattern recognition.The fingerprints of Mongolian medicine Androsacis Herba established in this study combines chemical pattern recognition method, which has high sensitivity and strong specificity, and can provide a basis for the quality evaluation of Mongolian medicine Androsacis Herba.
Androsacis Herba; HPLC; fingerprints; similarity; chemical pattern recognition
R284.1
A
1005-5304(2021)08-0098-05
10.19879/j.cnki.1005-5304.202011428
内蒙古自治区自然科学基金(2020MS08129)
齐和日玛,E-mail:qiherima@126.com
(收稿日期:2020-11-23)
(修回日期:2020-12-21;编辑:陈静)

