3株猪源绿色气球菌的分离鉴定
钱丽敏,何依蓉,陈梦婷,陈培富
(云南农业大学动物医学院,昆明 650201)
气球菌属介于葡萄球菌属和链球菌属之间,其模式种为绿色气球菌(Aerococcusviridans)[1],还包括尿道气球菌、柯气球菌、血气球菌和人尿气球菌[2]。绿色气球菌是一类重要的机会致病菌[3],广泛存在于自然界,如空气、土壤、动植物以及健康动物体表,若未做好消毒,可随空气和粉尘传播。绿色气球菌也被视为一种人兽共患病原菌,当人和动物机体免疫力水平降低、免疫功能不健全以及体表产生开放性外伤时,可引起人尿道感染、心内膜炎、主动脉假性动脉瘤及皮肤血管炎等疾病[4-6]。据报道[7],绿色气球菌感染可增加猪患其他感染性疾病的风险,最终导致仔猪生长发育受阻,出栏时间延迟,乃至引起死亡,造成重要经济损失。
近年,云南省不同地区3个猪场陆续发生多起仔猪非急性死亡病例,患病仔猪均表现出明显的四肢运动障碍。2015年3月芒市某小型猪场仔猪群发病,前期表现发热和呼吸困难,呈犬坐姿势,后期腹泻和四肢僵直,死亡率高达10%,病理剖检见胸腔有积液、肝脏有肿块、肺脏呈虾肉样病变,与胸膜粘连,肺组织经PCR扩增检出猪肺炎支原体阳性。2018年4月富民县某猪场部分2月龄仔猪出现生长缓慢,肌肉震颤,后期出现体温升高、全身皮肤潮红,跛行,无法站立,按压背部及臀部肌肉表现疼痛,经青霉素连续治疗4 d,无效死亡,剖检发现颌下淋巴结显著肿大。2019年1月禄劝县某养猪场发生温和型猪瘟(取白细胞经RT-PCR扩增检测猪瘟病毒核酸呈阳性),病猪全身体表发红,精神沉郁,肌肉震颤,关节肿胀,死前口鼻流血。为确定以上3个猪场仔猪发生四肢运动障碍的病原因素,无菌采集病死仔猪内部组织样品进行病原检测,为防控此类疾病提供必要的参考依据。
1 材 料
1.1 病料来源 分别从上述各猪场发病期间采集病猪组织样品。芒市小型猪场无菌采集病死仔猪脾脏、肝脏和肺脏各5份;富民县某猪场无菌采集病死仔猪肝脏、脾脏、颌下淋巴结、腹股沟淋巴结及心包积液各2份;禄劝县某养猪场采集3月龄患病仔猪抗凝血液2份。
1.2 主要试剂 小量琼脂糖凝胶DNA回收试剂盒(Lot:EG101-01)购自北京全式金生物技术有限公司,DH5α感受态大肠杆菌细胞(Lot:CB101)购自天根生化科技有限公司,胰蛋白酶大豆胨绵羊血琼脂等细菌培养基由实验室自行配制。
1.3 仪器设备 PCR 仪(型号EDC-810)购自北京东胜创新生物科技有限公司;高速离心机(型号H1650-W)购自湖南湘仪实验室仪器开发有限公司;凝胶成像系统(型号GELDOC-XR)购自BIO-RAD;电热恒温培养箱(型号303-S)购自沪南试验仪器厂;超低温冰箱购自日本SANYO 公司;立式压力蒸汽灭菌器(型号YXQ-50SII)购自上海博讯实业有限公司医疗设备厂。
2 方 法
2.1 细菌分离培养 无菌取病变组织或体液涂布绵羊血琼脂、LB琼脂,37 ℃培养24 h,挑取单个菌落继续做划线培养,直至形成外观形态完全一致的菌落,随机挑取单菌落少许菌样做革兰染色,镜检并记录细菌个体形态。
2.2 生化试验 对细菌纯培养物进行葡萄糖、麦芽糖、蔗糖、山梨醇、棉籽糖、七叶苷、乙酰甲基甲醇(VP)等生化试验。37 ℃培养24 h,记录反应结果。挑取经液体培养的细菌置于两张洁净玻片上,一张滴加少量现配的3% H2O2溶液,另一张滴加蒸馏水作为对照,观察触酶试验结果。
2.3 分离菌株16S rRNA基因序列测定 取1 mL新鲜培养菌液12000 r/min离心5 min弃上清,留取沉淀,按照细菌基因组DNA提取试剂盒说明书提取菌株DNA,以其为模板进行16S rRNA基因的PCR扩增。16S rRNA基因通用引物[8](上游引物:5′-AGA GTT TGA TCC TGG CTC AG-3′,下游引物:5′-CGG CTA CCT TGT TAC GAC TT-3′)由生工生物工程(上海)股份有限公司合成。PCR扩增程序:95 ℃预变性5 min;94 ℃变性50 s,52 ℃退火45 s,72 ℃延伸50 s,共35个循环;最后72 ℃延伸反应10 min。用1%琼脂糖凝胶电泳检查PCR扩增产物,胶回收产物做TA克隆,随机取白色菌落样品送生工生物工程(上海)股份有限公司测序,将所获基因片段序列于NCBI网站进行BLAST分析,选取同源性最高的7条序列(GenBank:CP014164、CP046334、GQ161096、HQ465288、KU922464、MG576151、MN932266)为参考序列,应用MEGA6.0软件构建系统发育树。
2.4 药敏试验 选用9种兽医临床常用抗菌药物,以纸片扩散法(K-B法)测定菌株敏感性。取纯培养菌液150 μL均匀涂布于M-H琼脂平板表面,每个平板贴4~5片药敏片,37 ℃培养18~24 h,用游标卡尺测量抑菌圈直径,按说明书判定菌株敏感性。
3 结果与分析
3.1 细菌分离培养 芒市脾脏样品、富民县肝脏和淋巴结样品、禄劝县血液样品在血琼脂均只形成白色圆形、隆起光滑、直径约1 mm并产生明显溶血环的菌落(图1),转种LB琼脂,均形成光滑、平整的灰白色小菌落(图2)。分离菌株依次命名为ASV-1、ASV-2和ASV-3。革兰染色镜检为阳性球菌,可见四联、成团块状排列,也有单个或成双排列(图3)。
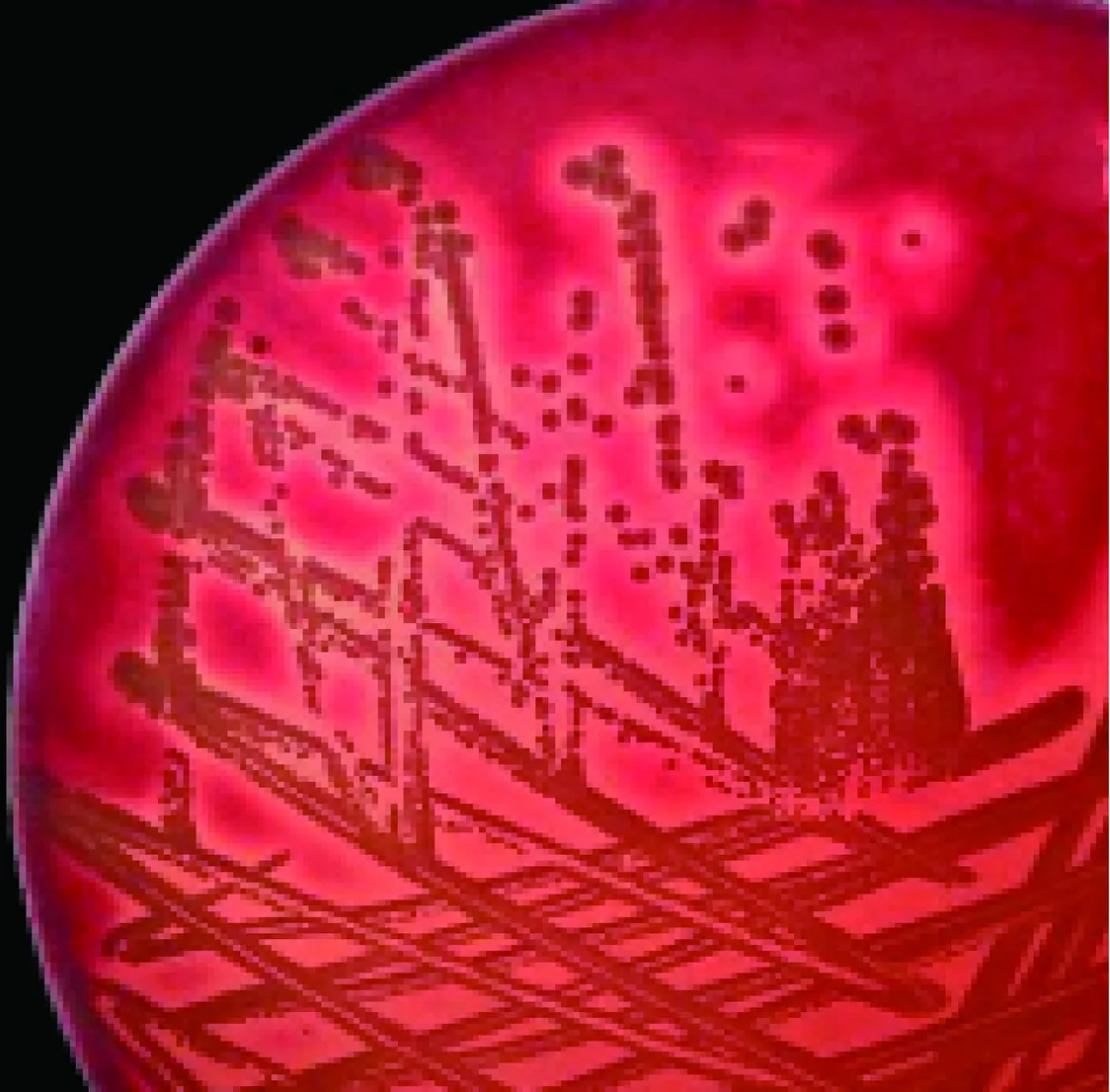
图1 血琼脂菌落形态Fig 1 The morphology of colonies on blood agar

图2 LB琼脂菌落形态Fig 2 The morphology of colonies on LB agar
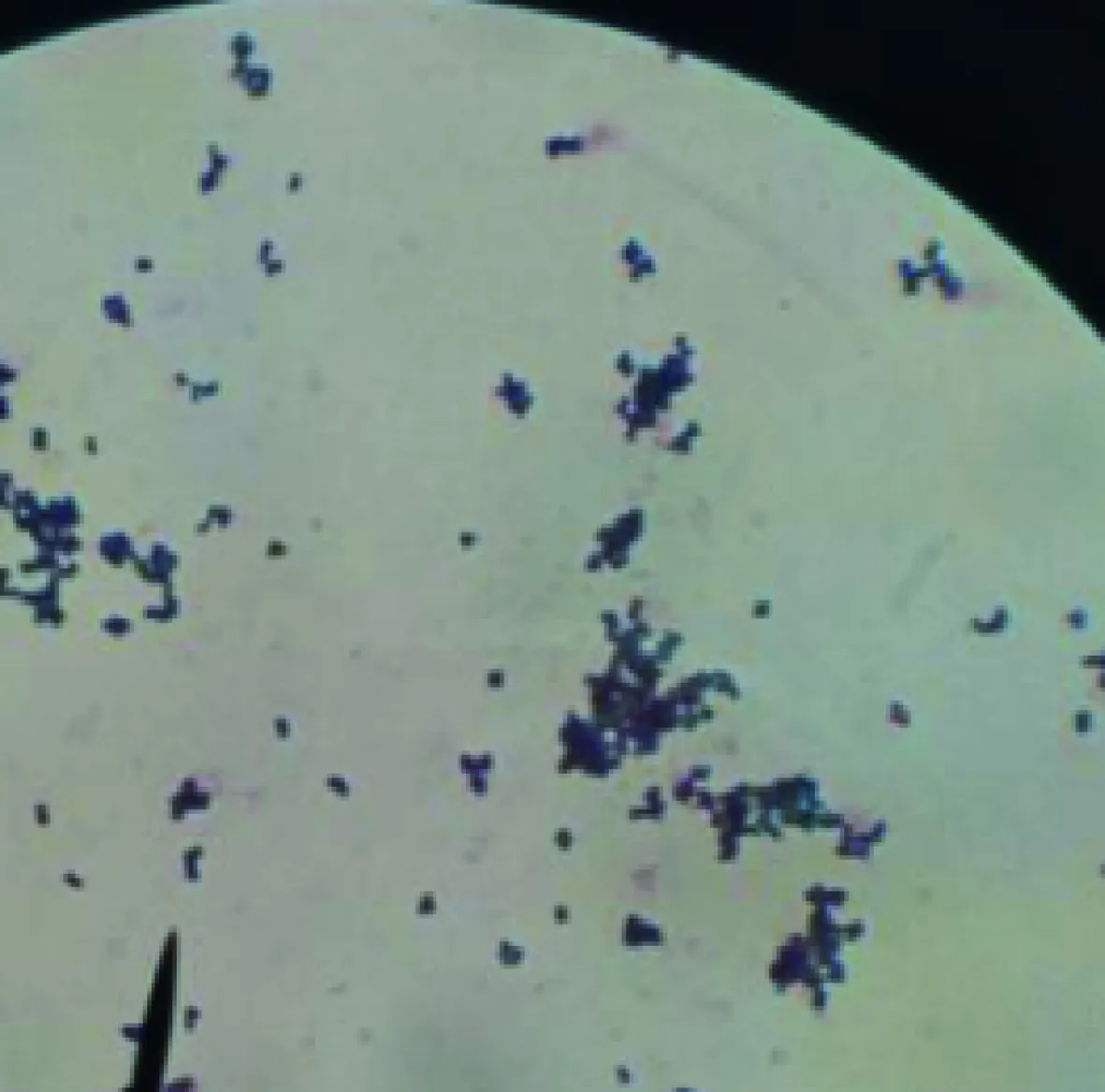
图3 革兰染色(1000×)Fig 3 The Gram stain(1000×)
3.2 生化鉴定 3个菌株都分解葡萄糖、蔗糖、木糖、山梨醇;不分解麦芽糖、棉籽糖、蕈糖、七叶苷、水杨苷,VP试验为阴性,不还原硝酸盐。触酶试验均为阴性。
3.3 16S rRNA基因扩增及测序结果 将所获3个菌株的16S rRNA基因序列扩增产物分别通过1%琼脂糖凝胶电泳检测,均在1500 bp左右处出现单一的光亮条带(图4-图6),与预期扩增产物大小相符。
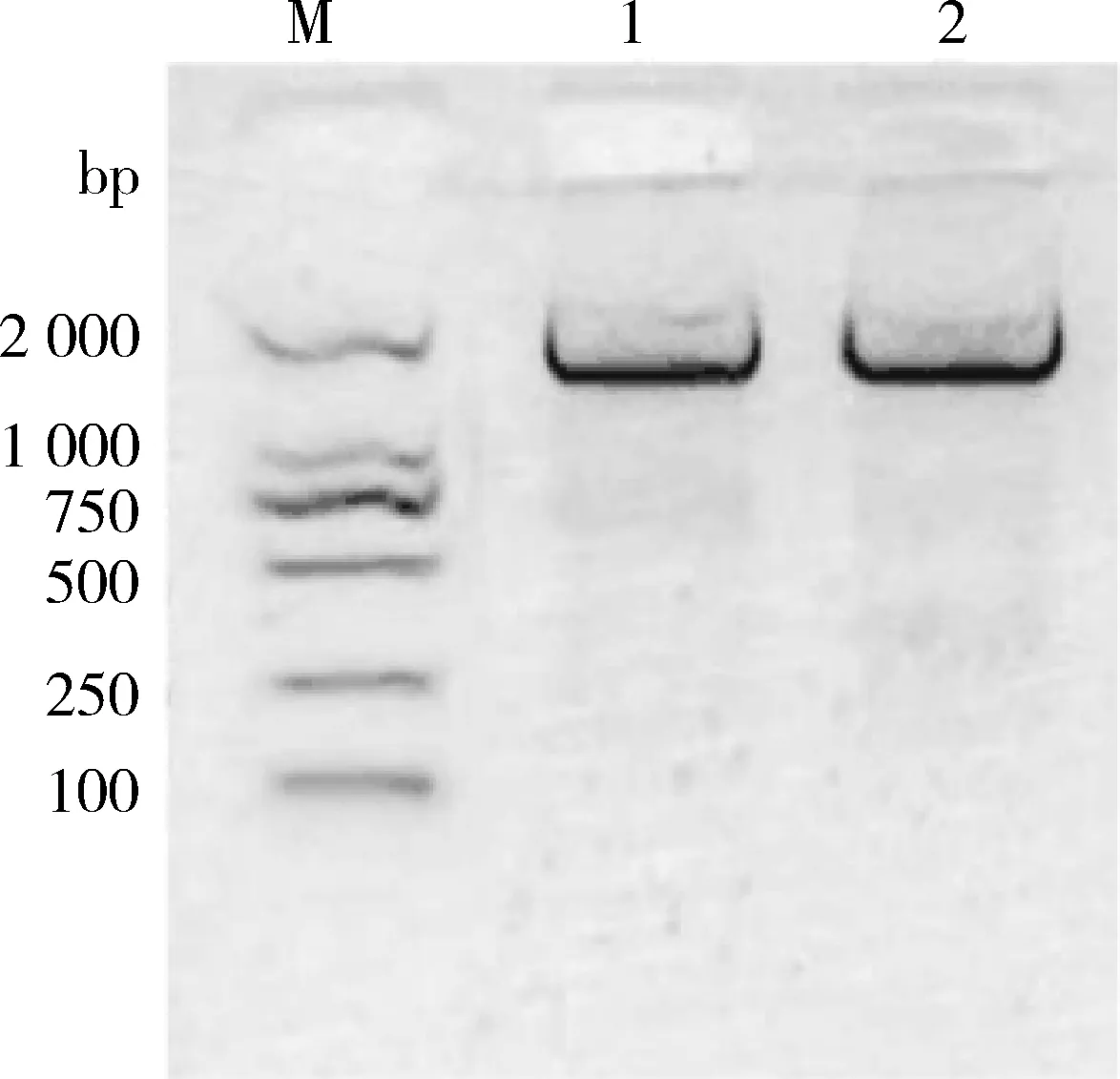
M:DL2000 DNA Marker;1-2:菌株ASV-1图4 菌株ASV-1 16S rRNA基因PCR扩增产物Fig 4 The PCR amplicon of ASV-1 16S rRNA gene

M:DL2000 DNA Marker;1-3:菌株ASV-2图5 菌株ASV-2 16S rRNA基因PCR扩增产物Fig 5 The PCR amplicon of ASV-2 16S rRNA gene
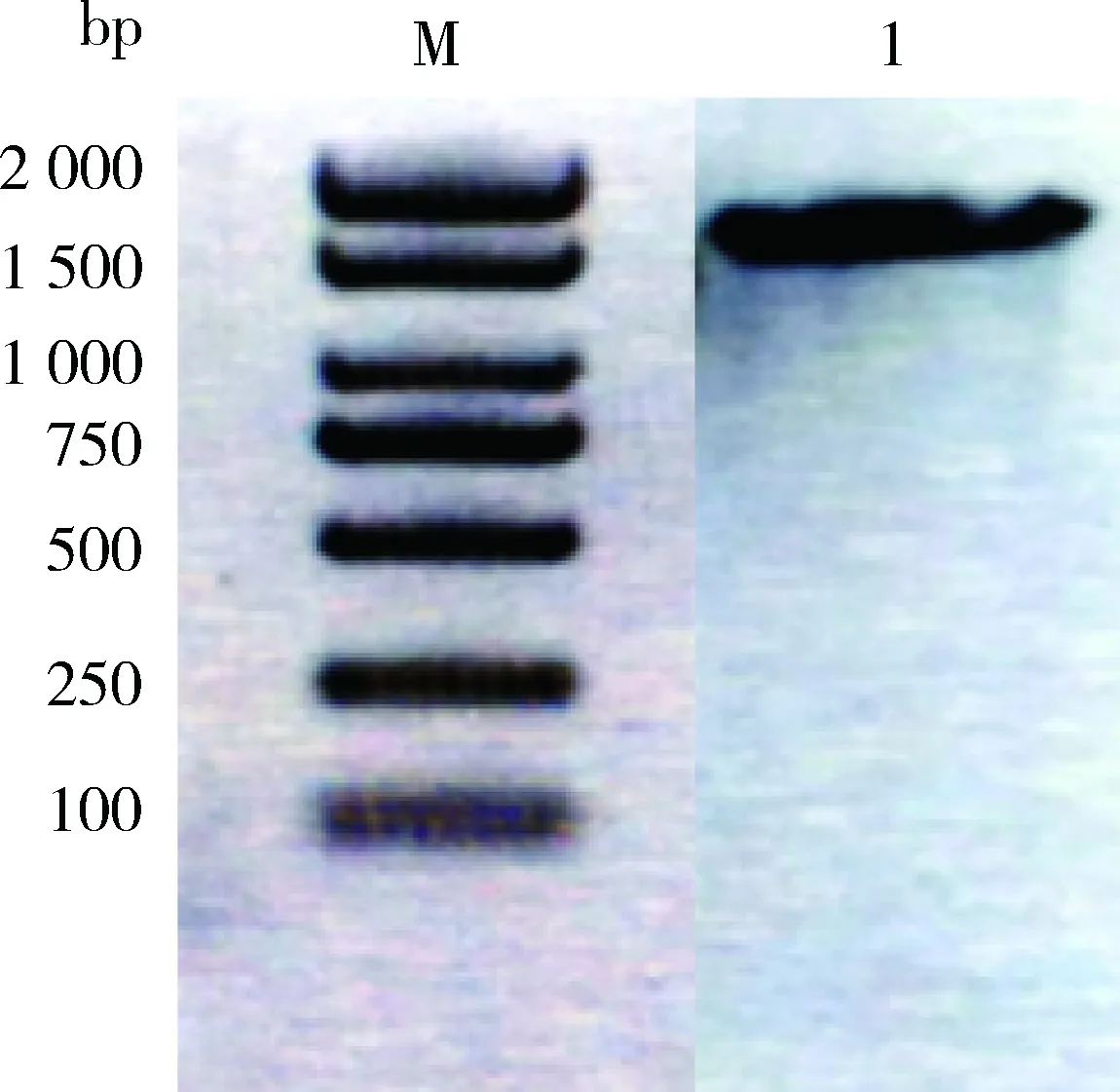
M:DL2000 DNA Marker;1:菌株ASV-3图6 菌株ASV-3 16S rRNA基因PCR扩增产物Fig 6 The PCR amplicon of ASV-3 16S rRNA gene
3.4 系统进化分析 所获3个分离菌株16S rRNA基因序列经BLAST分析,显示与GenBank收录的7株绿色气球菌参考菌株的同源性均在99%以上,据此将其判定为绿色气球菌。系统发育树显示3个分离菌株高度相似,且与印度分离株MG576151的遗传距离最近(图7)。

图7 基于16S rRNA基因序列的系统发育树Fig 7 The 16S rRNA gene-based phylogenetic tree
3.5 药敏试验结果 表1结果显示:3个菌株均对头孢曲松、恩诺沙星、青霉素、氟苯尼考、克拉霉素、呋喃唑酮敏感,对卡那霉素、庆大霉素、复方新诺明等药物不敏感。
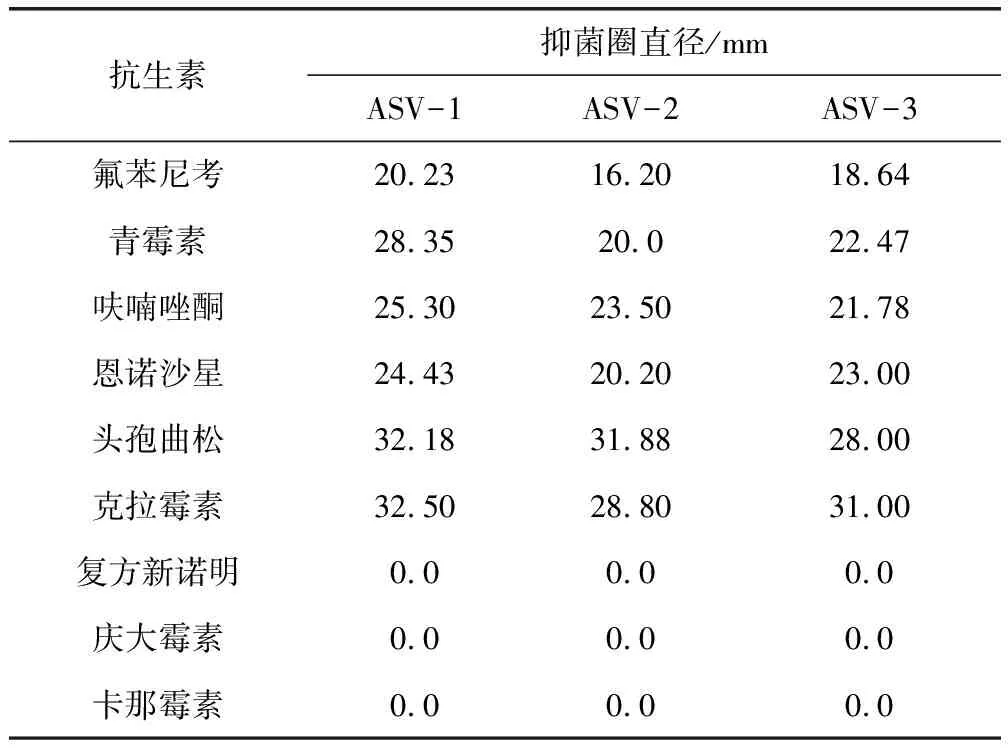
表1 药敏实验结果Tab 1 The results of drug susceptibility tests
4 讨论与结论
近些年,绿色气球菌感染动物机体造成的危害引起人们逐步重视。越来越多的研究表明,绿色气球菌可以感染多种动物,国外主要从水产动物中分离到绿色气球菌,如龙虾、鳌虾[9];国内报道最多的主要是人和仔猪的感染,从山羊、奶牛及竹鼠中也分离到绿色气球菌[10-12],可见此菌感染的宿主范围很广。Clark等[9]研究发现,绿色气球菌的强毒株荚膜对美洲龙虾有强致病力;Liu等[11]从患乳房炎的奶牛乳汁中分离到绿色气球菌,并发现此菌具有粘附和侵袭乳腺上皮细胞的能力。Sun等[13]也发现,夏季由绿色气球菌引起乳腺炎的比率最高,表明此菌是引起奶牛亚临床乳腺炎的重要病原。当然,绿色气球菌的致病性差异可能与菌株毒力和宿主种类有关。
本试验所获3株绿色气球菌分别源自云南省不同地区、不同年份的3个养猪场,证实此菌广泛存在于养猪环境,但未见其单独有强致病力的报道。Pan等[14]研究发现,从患病仔猪的关节液、脑脊液和肺脏中分离到猪链球菌和绿色气球菌,两种病原菌混合感染可引起仔猪和小鼠急性脑膜炎,且两种病原菌“协同作用”引起小鼠的死亡率显著高于单一病原菌引起的死亡率。这3个猪场患病仔猪虽然均表现肢体运动障碍,其他临床症状不尽相同,可能与其原发性感染疾病不同有关。根据疾病前期或同期的核酸检测结果,可以判定芒市病例发生的原发性感染为猪支原体肺炎,禄劝县病例则由猪瘟病毒(CSFV)引起原发性感染。富民县病例未及时做其他病原检测,但出现天生痉挛症和“僵猪”样状态,这是CSFV垂直传播引起先天感染的典型特征。CSFV具有淋巴细胞及上皮细胞嗜性,是引起猪免疫力下降而继发感染其他病原菌的主要因素。韩庆安等指出CSFV与其他病原体的混合感染非常普遍,与CSFV发生混合感染的病原体主要见于仔猪群及流产胎儿但在发育正常的育肥猪群中未检测到[15]。此外,所处地理位置、气候因素及养殖环境不同的养殖场,引起继发感染的机会致病菌种类可能差异,本研究发现的是绿色气球菌感染。富民县发病仔猪虽采用分离菌株敏感的青霉素治疗,但仍死亡,可能因为感染已导致器官功能衰竭。Marein等[16]从不同患病猪关节液、脑积液及肺脏中分离到58株绿色气球菌,指出该菌可能是猪的致病菌;但刘洁等分离出的8株绿色气球菌,并未引起正常小鼠的发病或死亡[17],进一步表明该菌为机会致病菌。
目前,绿色气球菌引起动物发病的相关机理尚不清楚,但凡能降低动物免疫功能的因素,如营养不良、天气骤变、免疫抑制病毒感染、应激反应等,都有可能引起绿色气球菌等机会致病菌的感染[18]。鉴于所调查病猪普遍预后不良,预防或消除导致免疫力下降的原发性感染才是避免或控制绿色气球菌机会感染的根本办法。
本研究从不同年份、不同地区的3个猪场病料中均只分离到绿色气球菌,提示其存在重要的致病性,并有必要深入调查其毒力因子、感染途径以及造成继发感染的前置或协同因素,以设法减少该菌感染引起的经济损失。

