我国猪源和鸡源大肠杆菌抗生素耐药性相关基因研究进展
周 炜,周芷锦,沈红霞, 倪柏锋, 王 彬, 陈 凯, 穆 琳, 陈 勇, 张恩宝,曲道峰, 赵灵燕*
(1.浙江省动物疫病预防控制中心, 杭州 311119;2:浙江工商大学食品与生物工程学院,杭州 310018)
大肠杆菌(Escherichiacoli,E.coli)是肠杆菌科细菌中分布最广泛的革兰氏阴性菌,也是兽医临床中常见病原菌之一。自1885年德国小儿科医师Escherich首次发现大肠杆菌以来,先后有279种血清型被证实[1]。正常情况下,大肠杆菌是动物肠道的共生菌,但当动物机体免疫力低下或菌群失调时,肠侵袭性(EIEC)、肠出血性(EHEC)、肠致病性(EPEC)、肠黏附性(EAEC)、弥散粘附性(DAEC)和肠产毒性(ETEC)大肠杆菌等致病性大肠杆菌可引发宿主肠道、呼吸道、血液系统、生殖系统等多器官系统疾病,例如受到广泛关注的肠出血性家族的O157:H7型、O2血清型等。由于血清型复杂,且极易产生变异和耐药性[2],大肠杆菌引发的疾病并无理想的疫苗可用于预防,兽医临床多用抗菌药物进行治疗。按照《中华人民共和国兽药典 兽药使用指南 化学药品卷》的分类,目前兽医临床常用于猪、鸡大肠杆菌病防治的药物主要有β-内酰胺类(阿莫西林、头孢噻呋)、氨基糖苷类(新霉素、安普霉素)、喹诺酮类(恩诺沙星)、磺胺类(磺胺氯哒嗪钠)、多肽类(硫酸黏菌素)和酰胺醇类(氟苯尼考),以及其他合成抗菌类药物(乙酰甲喹)。在长期抗菌药选择进化过程中,大肠杆菌通过非遗传性耐药/药物耐受[3]和耐药基因遗传/转移[4],从而产生水解酶/钝化霉、抗菌药物靶位改变、胞吞/胞吐作用改变、形成生物被膜及细胞膜通透性改变等变化,进而产生抗生素耐药性。因而,大肠杆菌被视作耐药性指示菌和耐药基因库被广泛研究。目前,已有大量关于动物源大肠杆菌耐药性相关基因的研究,但由于各研究者的关注点不同,研究中所检测的耐药基因也不相同。本文拟根据耐受抗菌药物种类,对这些基因作用机理及分布情况等方面进行综述,阐明大肠杆菌的耐药基因类型,分析比较各类耐药基因在全国各地的分离检出率。
1 介导β-内酰胺类抗菌药物耐受的相关基因
表达产生超广谱β-内酰胺酶(Extended-spectrum β-lactmases,ESBLs),是大肠杆菌对β-内酰胺类药物耐药最主要的机制,还可引起对氨基糖苷类、喹诺酮类药物、多西环素和氟苯尼考等药物耐药,引发了科学界最广泛的关注[5]。国内兽医界关注的产ESBLs基因型主要有:TEM、CTX-M、SHV、OXA。
1.1TEM型ESBLsTEM型ESBLs是由TEM-1和TEM-2广谱酶的编码基因发生1~4个氨基酸突变而形成的一系列蛋白酶。目前,已知的TEM型酶有115种,是目前数量最多的ESBLs[6-7]。根据徐英春等[8]的综述,TEM-1、TEM-2、TEM-13和属窄谱β-内酰胺酶,而TEM-30~36、38~40、44~45、51、59、65、73~78和80属耐酶抑制剂的β-内酰胺酶,并非ESBLs。关于动物源大肠杆菌中的TEM基因检测,国内的研究通常不细分至亚型。刘雅妮等[9]对2010~2011年间上海地区296株猪源大肠杆菌的检测结果表明,52株产ESBLs菌株中TEM基因和CTX-M基因检出率分别为88.5%和28.8%。曲志娜等[10]发现,2012年山东莱西地区的43株鸡源产ESBLs大肠杆菌中CTX-M和TEM基因的检出率分别为93%和72%。2019年,张明亮等[11]针对豫北地区21株猪源大肠杆菌开展了TEM-1基因检测,发现检出率为100%。
1.2CTX-M基因型ESBLsCTX-M基因型ESBLs,是20世纪90年代发现的一类主要作用于头孢类药物的ESBLs。其对头孢噻肟的水解能力最高,同时可水解氨曲南和头孢曲松,而对头孢吡肟的水解力很弱。截至2015年,已知的CTX-M基因型ESBLs已达160种(http:∥www.lahey.org/studies/,2015年7月关闭),按基因同源性其可分为5组[12]:CTX-M-1、CTX-M-2、CTX-M-8、CTX-M-9和CTX-M-25。张成东等[13]对2018年从河南省规模化猪场分离得到的704株大肠杆菌的耐药基因进行了研究,CTX-M、CTX-M-G9和CTX-M-G2的检出率分别为78.4%、38.4%和69.9%,而CTX-M-G1、CTX-M-G8和CTX-M-G25均未检出。2015年,杨守深[14]等报道了在213株闽西地区猪源大肠杆菌中17.4%的菌株检出CTX-M-9G基因,且均与耐喹诺酮类基因共存。李进福等[4]对河南地区31株猪源大肠杆菌的研究表明,CTX-M-U基因检出率为25.8%,其中CTX-M-1和CTX-M-9亚群菌株均检出3株。杜向党等[15]2009年的研究发现:94株鸡源大肠杆菌中,CTM-X型基因携带率分别为56.4%,CTX-M-9组26株、CTX-M-2组14株、同时携带CTX-M-9和CTX-M-2组13株;46株猪源大肠杆菌中,25株检出CTM-X型基因,CTX-M-9组17株、CTX-M-2组7株、同时携带CTX-M-9和CTX-M-2组1株;CTX-M-1、CTX-M-8、CTX-M-25组均未检出。2016年,张利锋[16]等发现山东某鸡场及其加工场的373株大肠杆菌中,有54.7%的菌株携带CTX-M系列耐药基因,其中CTX-M-55(属于CTX-M-G1组)、CTX-M-65和CTX-M-14(属于CTX-M-G9组)检出率最高,并检出同于CTX-M-G9组的CTX-M-27基因。张冬冬等[17]2018年的研究结果表明,四川地区29株产ESBLs大肠杆菌中CTX-M的检出率为100%,如图1所示,7种亚型的检出率依次为:CTX-M-65>CTX-M-55>CTX-M-14>CTX-M-79>CTX-M-27>CTX-M-15>CTX-M-123。
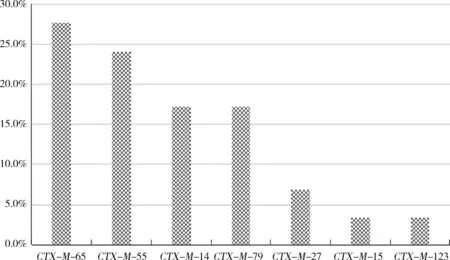
图1 四川地区7种CTX-M基因亚型的检出率Fig 1 Ratios of the 7 kinds of CTX-M gene in Sichuan
1.3SHV型基因型ESBLsSHV型β-内酰胺酶是由广谱的SHV-1酶编码基因发生1~4个氨基酸突变而形成的,一系列可不同程度水解头孢菌素类和氨曲南的蛋白酶。目前已经发现39种SHV型酶,其中SHV-1属窄谱β-内酰胺酶。李进福等[4]发现2015年间河南地区31株猪源大肠杆菌中SHV基因检出率为61.3%,曲志娜等[10]对2013年山东莱西地区分离得到的49株猪源和53株鸡源大肠杆菌的研究发现,产ESBLs大肠杆菌的流行基因主要为CTX-M和TEM,而SHV基因非主要流行基因。2016年,张炳亮等[18]等在洛阳某猪场分离得到的17株致病性大肠杆菌中均未检出SHV基因。
1.4OXA型基因型ESBLs 目前已知的OXA型β-内酰胺酶有40种,仅16.1%的亚型是从大肠杆菌中分离得到的[11]。OXA-10和OXA-35属窄谱β-内酰胺酶,OXA-23~27属碳青酶烯酶。2018年,张成东等[13]在河南地区704株猪源大肠杆菌中,检出173株携带OXA基因的菌株,检出率低于携带CTM-X(552株)和TEM(231株)基因株,高于SHV基因株(18株)。王豪举[1]对2014~2016年间重庆地区分离到854株鸡源和493株猪源大肠杆菌进行的ESBLs基因分析,发现尽管仅1株猪源菌单纯携带OXA-10基因,但携带OXA-10基因的菌株占产ESBLs菌株的9.8%,低于TEM株(占比94.5%)和CTX-M株(占比26.7%),高于SHV株(占比6.9%)。
尽管各研究中时间、地域、动物种类和探讨的基因亚型各有不同,总体而言,我国产ESBLs动物源大肠杆菌中TEM和CTX-M为优势基因型。
除上述4类基因型外,还有关于PER、VEB、GES、CARB、IMP、VIM、DHA、PSE(PSE-1)、BES、STO、TLA等基因的研究报道[1]。此外,李庆周等[19]在2013~2015年间四川地区20个规模化养鸡场分离得到的367株鸡源大肠杆菌进行了研究,发现33株产CMY-2的菌株,在这些菌株中TEM-1等耐药基因的检出率均在70%以上,且表现出对氨苄西林、阿莫西林/克拉维酸100%的耐药性。卢亚兰等[20]分析了2018年浙江和陕西地区分离得到的2株携带NDM-5质粒的禽源大肠杆菌的耐药性,2菌株检出10种和16种耐药基因,分别在体外表现出对10种和12种抗菌药物耐药,耐受的药物包括头孢他定、头孢噻呋和氨苄西林等β-内酰胺。
2 介导氨基糖苷类抗菌药物耐受的相关基因
大肠杆菌对氨基糖苷类药物耐受的基因研究,主要集中在16S rRNA甲基化酶和3种产氨基糖苷钝化酶的编码基因。16S rRNA甲基化酶可使菌体30S核糖体亚单位中16S rRNA位点的某一个或多个碱基发生甲基化,阻断了氨基糖苷类药物与作用靶点的结合,从而产生耐药性。目前,至少已有rmtA~E、npmA和armA等7种16S rRNA甲基化酶基因被证实。产氨基糖苷钝化酶的编码基因是:产O-腺苷转移酶(aminoglycoside adenylase,AAD)基因、产N-乙酰转移酶(aminoglycoside acetytranserase,AAC)基因和产O-磷酸转移酶(aminoglycoside phosphotransferase,APH)基因。国内兽医学界关注的AAC编码基因亚型最多,包括:aac(3)-Ⅰ、aac(3)-Ⅱ、aac(3)-Ⅲ、aac(3)-Ⅳ、aac(6')-Ⅰ、aac(6')-Ⅱ、aacA4、aacC2。AAD编码基因的研究主要集中于aadA1和aadB中,APH编码基因则主要关注aph(3’)系列。其中,aph(3’)系列包括aph(2'')、aph(3')-Ⅰ、aph(3')-Ⅱa、aph(3')-Ⅲ、aph(3')-Ⅵ等亚型。
邓向东[21]分析了2012-2013年间四川地区134株猪源和鸡源大肠杆菌中rmtA~rmtE、npmA和armA等7种16S rRNA甲基化酶基因,仅5株菌株检出rmtB基因,其它6种16S rRNA甲基化酶基因均未检出。刘河冰[22]检测了2008年间河南郑州地区120株鸡源大肠杆菌中6种16S rRNA甲基化酶基因,结果表明仅检出armA和rmtB基因,两者检出率分别为2.5%和7.5%。
2009年,孙金福等[23]对辽宁地区27株禽源大肠杆菌进行了检测,发现apH(3’)-Ⅱ、aadA1和aacA4基因检出率分别为55.6%、44.4%和27.8%。2005年,马孟根等[24]分析比较了四川地区22株猪源和鸡源大肠杆菌中aadA1、aadA2、aadB、apH(3’)-Ⅱ和acc(3)-Ia五种基因的携带率,结果表明aadA1和apH(3’)-Ⅱ为优势基因,两者检出率分别为59.1%和54.5%,acc(3)-Ia未检出。朱永江等[25]所检测的2015-2016年间扬州地区分离得到的40株猪鸡源大肠杆菌中,aac(3)-Ⅱ和aac(6’)-Ib的检出率分别为17.5%和2.5%。
在多族耐药基因比较的研究中,张炳亮[18]的研究结果显示2016年洛阳地区17株猪源大肠杆菌aac(3)-Ⅱ基因检出率88.2%,高于其他所测试的β-内酰胺类、四环素类和大环内酯类药物的耐药基因。2019年,张明亮[11]等的研究发现aadA1和aph(3’)-Ⅱa的检出率分别为57.1%和76.2%,低于其所试的2种四环素和1种β-内酰胺类耐药基因,但高于酰胺醇类和磺胺类耐药基因。
3 介导喹诺酮类抗菌药物耐受的相关基因
对喹诺酮类耐药基因的研究主要集中于:质粒介导的喹诺酮类耐药基质(plasmid mediated quinolone resistance,PMQR)和喹诺酮作用靶位基因决定区的突变基因(Quinolone resistance determining regions,QRDQ)。其中,PMQR基因族又主要包括qnr系列、aac(6’)-Ib-cr、oqxA/B和qepA。严格地,oqxAB和qepA均是质粒介导的外排泵基因[26]。
qnr基因通过保护DNA促旋酶和拓扑异构酶Ⅳ不受药物的抑制来降低菌体对喹诺酮类药物敏感性,已有报道的qnr主要包括qnrA、B、S、C、D、VC等。杨守深等[14]的研究发现,在2015年福建地区分离得到的213株猪源大肠杆菌中37株检出CTX-M-9G基因,97.3%的菌株还携带有qnr基因,其中qnrS、qnrB和qnrA基因检出率分别为73.0%、37.8%和5.4%,oqxA、oqxB和qepA的检出率则依次为70.3%、75.7%和18.9%。aac(6’)-Ib-cr基因易被误读为EBSLs编码基因,其中“-cr”系指环丙沙星耐药(Ciprofloxacin resistance),是氨基糖苷乙酰转移酶的新型变异基因编码的灭活酶。南海辰等[27]对2010~2013年间新疆地区的183株畜源大肠杆菌耐药基因的检测结果表明,aac(6’)-Ib-cr的检出率呈现出一定的动物种属差异,猪、羊和牛源的检出率分别为5.0%、22.9%和12.5%。由于猪源、羊源和牛源大肠杆菌菌株数分别为79株、96株和8株,aac(6’)-Ib-cr在不同物种间检出率的差异可能受样本量影响。
喹诺酮类药物作用靶位是DNA促旋酶和拓扑异构酶Ⅳ,DNA促旋酶由gyrA和gyrB基因编码,拓扑异构酶Ⅳ则由parC和parE基因编码。因而,QRDQ系列基因的研究围绕这4个基因开展。张艳芳等[28]的研究发现,DNA促旋酶的GyrA和GyrB亚基上发生的氨基酸替代与喹诺酮类药物产生耐药性有关。张秀英[29]等利用中药处理耐喹诺酮类药物的大肠杆菌,可使GyrA和ParC亚基从耐药状态恢复至敏感状态。
4 介导四环素类抗菌药物耐受的相关基因
已知的四环素类耐药基因,根据其耐药机制可分为3大类[30-31]:①外排泵基因,通过编码膜相关蛋白,加速四环素排出细胞浆外。包括:tet(A)~tet(E)、tet(G)、tet(H)、tet(J)、tet(K)、tet(L)、tet(V)、tet(Y)、tet(Z)、tet(30)、tet(31)、tet(33)、tet(35)、tet(38)、tet(39)、otr(B)、otr(C)、tcr和tetA(P)。②核糖体保护蛋白基因,通过编码核糖体保护蛋白,使核糖体免受四环素作用。包括:tet(M)、tet(O)、tet(Q)、tet(S)、tet(T)、tet(W)、tet(32)、otr(A)和tetP(B)。③灭活/钝化四环素基因,通过编码灭活或钝化四环素的酶而发挥作用。包括:tet(X)、tet(34)和tet(37)。
2018年,王学君[31]对贵州地区783株猪源大肠杆菌中四环素耐药基因携带率进行了研究,发现tetA、tetB、tetC和tetD等4种外排泵基因检出率分别为92.6%、41.5%、58.8%和58.6%,核糖体保护蛋白基因tetM的检出率为70.1%,灭活/钝化四环素基因tetX的检出率为78.8%。李进福等[4]对2015年间河南地区31株猪源大肠杆菌的外排泵基因(tetA、tetB、tetC、tetK、tetL)和核糖体保护蛋白基因(tetM、tetO、tetW)两类耐药基因进行检测,tetA和tetM基因为优势基因,两者检出率分别为87.1%和54.8%。6株tetL基因检测阳性,tetC和tetO各有1株呈阳性,未检出tetB、tetK和tetW基因。在张炳亮[18]等2015年的研究中,猪源大肠杆菌中tetA检出率为70.6%,而tetC则未检出。2018年,李蕴玉等[32]对唐山和秦皇岛地区22株鸡源大肠杆菌中tetA和tetB基因进行了检测,两者的检出率均在80%以上。2016年,张雅为等[33]在辽宁阜新地区33株鸡源大肠杆菌中tetB、tetC、tetM、tetK和tetL等5种四环素耐药基因分析中,33.3%菌株检出tetK基因,tetL、tetB、tetC、tetM检出率在15%~30%之间,tetA基因均未检出。
5 介导酰胺醇类抗菌药物耐受的相关基因
关于酰胺醇类耐药基因的研究主要集中在cat、clmA和flor三种基因,此外还有一些关于fexA、cfr、pexA和estdl136的报道。cat基因负责编码氯霉素乙酰转移酶,使菌体对氯霉素和甲砜霉素耐药,但对氟苯尼考没有作用。cat基因可以分为A型和B型,其中A型又有catⅠ~Ⅳ、catA~D、catP、catS、catQ等16种亚型,B型有cat和catB2种亚型。cmlA和flor均是外排泵蛋白基因,前者只介导氯霉素和甲砜霉素耐药,而后者则还可以介导对氟苯尼考耐药[34]。
2019年,张明亮[11]等在豫北地区21株猪源大肠杆菌中发现4株cat1基因阳性,检出率19.0%。同年,吴方达[35]发现福建地区的17株耐氟苯尼考的大肠杆菌,floR基因检出率为100%。罗永乾[34]对2014~2016年间重庆地区393株鸡源、194株猪源和108株牛源大肠杆菌中cat、clmA、flor、pexA、cfr、fexA和fexB基因进行了检测,695株菌中各基因总的检出率依次为:flor(58.7%)>cat(37.0%)>cfr(0.9%),pexA、fexA和fexB均未检出。
6 介导多粘菌素耐受的相关基因
大肠杆菌耐多粘菌素基因包括:arnBCDTEF基因和mcr系列基因。arnBCDTEF(亦作pmrHFIJKLM)操纵子,其通过脂质A的共价修饰,减少菌体细胞外膜的净负电荷,从而降低对带正电荷的多粘菌素的吸附。mcr系列基因属磷酸乙醇胺转移酶编码基因,同样通过减少菌体细胞外膜的净电荷而产生耐药性[36]。自2015年沈建忠院士团队首次报道mcr-1以来,先后又发现了mcr2~mcr5等基因[37],但兽医学界尚主要关注mcr-1基因。祝瑶[36]对2016年东三省732株动物源大肠杆菌进行了mcr-1基因携带率检测,发现mcr-1基因在294株鸡源大肠杆菌中的检出率为15.3%,255株猪源菌株中检出率为9.4%。
7 介导磺胺类抗菌药物耐受的相关基因
磺胺类药物主要作用于细菌的二氢蝶酸合成酶(Dihydropteroate synthase,DHFAS)。因而,对大肠杆菌磺胺类药物耐药的研究主要集中于DHFAS突变基因folp及DHFAS替代基因。兽医学界主要关注于后者中的sul1、sul2和sul3基因亚型。2018年,方结红[38]对浙江地区生猪屠宰环节分离得到的350株大肠杆菌的检测发现,34株菌检出sul1、sul2和sul3基因。其中,17株菌存在2~3种基因共存,sul1、sul2和sul3基因对阳性菌株的贡献率分别为58.8%、47.1%和38.2%。李庆周[19]等发现在2013~2015年间四川地区20个规模化养鸡场分离得到的产CMY-2的大肠杆菌中,sul1、sul2和sul3基因检出率为84.8%、72.7%和36.4%。
8 介导多重药物耐受的相关基因
除前述的7类药物的耐药基因外,国内兽医学界还对cfr(chloramphenicol-florfenicol resistance)基因、外膜通道蛋白和被膜等有关的耐药性编码基因进行了研究。
cfr基因,是因耐受氟苯尼考和氯霉素而得名的2kb左右的小基因,但后经证实其可通过产物-甲基化转移酶使药物结合位点发生改变,而可同时介导五类抗生素耐药。除cfr基因外,大肠杆菌中还存AcrR和Mar等与多重耐药有关的基因[39]。AcrAB、ACREF、EmrAB、Ecr和QacE等均需于大肠杆菌的主动外排系统,其中AcrAB-TolC外排系统是最主要的。AcrR、MarA、MppA、SdiA、Rob和SoxS等调控基因因子,可作用于AcrAB-TolC外排系统,调节大肠杆菌的外排效能,形成耐药。马红霞等对rob[40]、SdiA[41]基因的研究表明,这2种基因的高水平表达时,均可形成多重耐药。
MdtM编码一种大肠杆菌细胞膜蛋白,可非特异性增加抗菌药物的泵出效率,从而介导多重耐药。刘婵婵[37]在81株人源大肠杆菌中,发现54株携带有MdtM基因的菌株,表现出多重耐药性。ompF编码大肠杆菌外膜蛋白(OMPs)中的一种亲水性非特异孔道蛋白,王艺凝等[42]的研究表明ompF基因通过对被膜及排出泵的作用,而影响大肠杆菌的耐药性水平。
9 展 望
综上所述,大肠杆菌不同的耐药表型对应不同的耐药基因,同样的耐药表型也可能对应不同的耐药基因,因而在研究目标区域流行的耐药基因时,需注意三方面因素的影响:首先,各类药物耐药机制和基因亚型均具多样性,选择哪些基因进行研究分析就显得尤为重要。其次,从微观层面的基因、蛋白表达,到宏观的耐药表型,还有很多因素在发挥影响,尤其是当目标菌株已表现出多重耐药时,耐药基因与表型是否完全一一对应,需审慎地总结。其三,因指示菌与致病菌/继发感染菌的差异、药物剂型/佐剂的差异等诸多因素影响,体外试验的耐药性与体内试验结果并不完全一致。
国内兽医学界对动物源大肠杆菌各类耐药性相关基因进行深入研究。其中,β-内酰胺类和氨基糖苷类的相关耐药基因研究较多。氨基糖苷类和四环素类药物很少用于畜禽大肠杆菌感染的防治,但两类药物的耐药基因检出率很高,这可能与2方面原因有关:1、依据原《中华人民共和国农业部公告第168号》,氨基糖苷类的越霉素A预混剂、潮霉素B预混剂、硫酸安普霉素预混剂、盐酸林可霉素及硫酸大观霉素预混剂、硫酸新霉素预混剂、硫酸安普霉素;四环素类的土霉素钙和金霉素(饲料级)预混剂,允许作为促动物生长使用。在长期低剂量的四环素类药物压力作用下,与动物共生的大肠杆菌自身产生了耐药性。2、其他种类细菌产生的相关耐药基因,通过质粒、整合子、转座子等可移动遗传元件横向迁移至大肠杆菌内,再通过繁殖扩增,使这些耐药基因得以纵向传播。
随着国家兽药规范化使用行动和遏制动物源细菌耐药性行动的逐步实施与推进,《中华人民共和国农业农村部公告第194号》等法规的相继颁布与实施,以及养殖主体生物防控意识的不断增强,动物源细菌耐药性必将逐步减轻。

