紫杉醇靶向化疗治疗小细胞肺癌的效果观察
孙岩
肺癌是发病率和死亡率增长最快,对人群健康和生命威胁最大的恶性肿瘤之一。临床上,肺癌按病理基础分为小细胞肺癌和非小细胞肺癌。大多数患者在首次诊断时已属肺癌晚期,治疗难度较大,死亡率较高[1]。目前,临床上针对肺癌患者多采用药物化疗治疗,虽然药物化疗可延长患者的生存时间,提高疗效,但药物化疗毒副作用较多,因此,在临床治疗中要选择合适的化疗药物。本文选择本院2017 年1 月~2018 年1 月收治的100 例小细胞肺癌患者进行分组研究,观察紫杉醇靶向化疗治疗对小细胞肺癌患者生存时间、生存质量、临床疗效及不良反应的影响,具体报告如下。
1 资料与方法
1.1 一般资料 选择本院2017 年1 月~2018 年1 月收治的小细胞肺癌患者100 例,依据随机数字表法分为对照组和观察组,每组50 例。对照组男34 例,女16 例;年龄41~76 岁,平均年龄(67.21±9.45)岁。观察组男33 例,女17 例;年龄41~78 岁,平均年龄(67.44±9.34)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经伦理委员会批准。
1.2 方法 对照组患者给予常规化疗方案治疗,给予顺铂75 mg/m2和依托泊苷120 mg/m2静脉滴注,第1 天、第2 天和第3 天用药,治疗3 周作为1 个周期,共治疗4 个周期。观察组采取紫杉醇靶向化疗治疗,采用注射用紫杉醇(白蛋白结合型),剂量为200 mg/m2,第1、7、23、20 天用药,静脉滴注30 min。治疗3 周作为1 个周期,共治疗4 个周期。
1.3 观察指标及判定标准 比较两组生存时间、治疗前后患者生存质量评分、临床疗效、不良反应发生情况。采用SF-36 进行生存质量评定。治疗结束后行胸部CT 或磁共振成像(MRI)检查,评价近期疗效。根据世界卫生组织的一般标准进行判定,完全缓解:病灶完全缓解消失;部分缓解:肿瘤缩小≥50%,无新病灶;稳定:肿瘤缩小<50%或增大<25%;进展:肿瘤增大≥为25%或出现新病灶[2]。总有效率=(完全缓解+部分缓解+稳定)/总例数×100%。不良反应包括骨髓抑制、神经毒性、肝毒性、消化道反应。
1.4 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差 (±s)表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组生存时间比较 观察组生存的时间为(24.45±1.21)个月,长于对照组的(18.01±2.51)个月,差异有统计学意义(P<0.05)。
2.2 两组治疗前后生存质量评分比较 治疗前,两组SF-36 评分比较,差异无统计学意义(P>0.05);治疗后,两组SF-36 评分均高于治疗前,且观察组显著高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组治疗前后生存质量评分比较(±s,分)
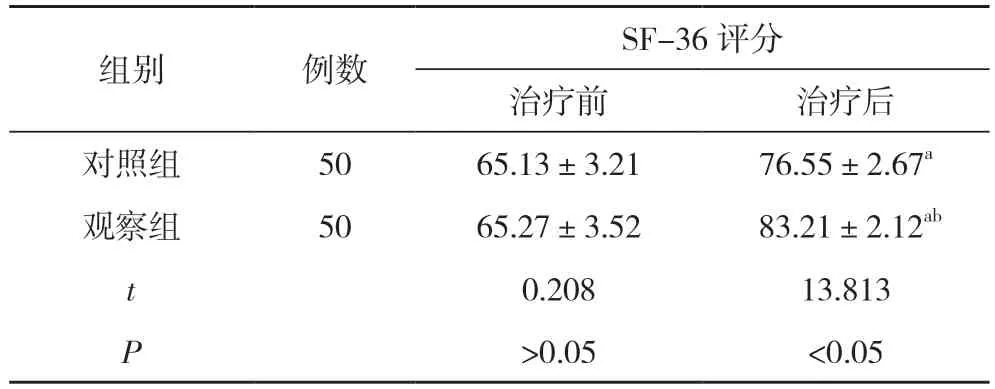
表1 两组治疗前后生存质量评分比较(±s,分)
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
2.3 两组临床疗效比较 观察组治疗完全缓解8 例,部分缓解20 例,稳定9 例,进展13 例,总有效率为74.00%;对照组治疗完全缓解5 例,部分缓解10 例,稳定10 例,进展25 例,总有效率为50.00%;观察组治疗总有效率高于对照组,差异有统计学意义(χ2=6.112,P<0.05)。
2.4 两组不良反应发生情况比较 观察组发生骨髓抑制2 例、神经毒性1 例、肝毒性3 例,消化道反应1 例,不良反应发生率为14.00%;对照组发生骨髓抑制5 例、神经毒性4 例、肝毒性6 例,消化道反应4 例,不良反应发生为38.00%;观察组不良反应发生率低于对照组,差异有统计学意义(χ2=7.484,P<0.05)。
3 讨论
小细胞肺癌是一种起源于支气管上皮细胞的神经内分泌肿瘤,多见于60~80 岁人群,约占肺癌总数的20%,其具有生长快、转移早、侵袭性强等特点[3]。小细胞肺癌的发生与吸烟密切相关,特别是重度吸烟者小细胞肺癌发生率更高。小细胞肺癌分为局限期和广泛期,其分期标准对制定治疗方案、预测生存率具有重要意义。国际抗癌联盟推荐的TNM 分期标准主要依靠手术来确认其准确性,而大多数小细胞肺癌患者在确诊时已经失去了手术机会,并以放疗和化疗为主要治疗手段,因此前者常用于临床实践。目前,全身化疗是临床治疗小细胞肺癌的主要方法。如何对小细胞肺癌做出准确的早期诊断,CT 的诊断参考值有多大,已成为小细胞肺癌临床诊断、治疗和研究的新热点。小细胞肺癌具有恶性程度高、发展快、对化疗敏感、易发生淋巴和血液转移、预后差等特点,但其病理改变和影像学表现也具有特殊性。因此,合理有效的综合治疗可以延长患者的生命,少数病例甚至可以治愈。
小细胞肺癌的治疗一般采用化疗方案,目前常用顺铂联合依托泊苷,其他细胞毒药物如紫杉醇、多西紫杉醇、伊立替康、长春瑞滨、替莫唑胺、吉西他滨等对小细胞肺癌有一定的姑息作用[4]。小细胞肺癌的免疫治疗为新的方法,另外还有抗体偶联药物、聚腺苷二磷酸核糖聚合酶(PARP)抑制剂和靶向治疗等。
紫杉醇是从红豆杉(Taxus chinensis var.mairei)植物皮肤中提取的广谱抗肿瘤药物,主要作用于微管和微管系统,可促进微管蛋白向微管转化,抑制微管解聚,阻断细胞生长,促进癌细胞萎缩,甚至凋亡,临床上用于治疗多种癌症[5]。然而,紫杉醇药物的开发非常困难,因为紫杉醇几乎不溶于水。然而,近年来随着纳米技术和现代制备技术的快速发展,药物也得到了发展,目前临床不仅解决了紫杉醇几乎不溶于水制备制剂的困难,还解决了紫杉醇药物的毒性随着药物剂量的增加而增加的特点。采用开环聚合法制备壳聚糖-聚乳酸共聚物,然后采用纳米沉淀法制备紫杉醇纳米粒。壳聚糖具有良好的包封性,为紫杉醇提供了载体(包封率和载药量均接近100%),其较高的降解能力使其进入人体后迅速降解,因为纳米粒具有缓释和控释靶向特性,主要存在于肝脏及脾、肺、淋巴和少量的脊髓中,使药物的不良反应发生率降到最低,也增强了药物的吸收能力,提高了药物的稳定性和生物利用度[6]。此外,这些纳米颗粒体积很小,可以有效防止其被人类网状内皮系统的巨噬细胞吞噬[7]。<500 nm 的纳米粒子可以聚集在胃肠道淋巴结构的上皮小泡中,通过淋巴聚集的M 细胞将药物释放到体循环中。紫杉醇靶向药物进入人体后,会自动识别肿瘤特异性的富含半胱氨酸型酸性蛋白(SPARC)白蛋白受体(SPARC 受体是各种侵袭性癌症中上调的细胞机制蛋白),从而在肿瘤细胞周围蓄积,达到更高的细胞内浓度(比非靶向紫杉醇药物高约33%)和更高的肿瘤组织分布[8]。由于这些特点,紫杉醇靶向药物的毒性较低。与非靶向紫杉醇制剂或放化疗相比,紫杉醇具有用药方便的独特性,其无需特殊的输液装置即可在30 min 内完成输液,减轻了患者的经济负担,输液前无需抗过敏预处理[9,10]。
本研究结果显示,观察组生存时间长于对照组,差异有统计学意义(P<0.05)。治疗前,两组SF-36 评分比较,差异无统计学意义(P>0.05);治疗后,两组SF-36评分均高于治疗前,且观察组显著高于对照组,差异有统计学意义(P<0.05)。观察组治疗总有效率高于对照组,差异有统计学意义(P<0.05)。观察组不良反应发生率低于对照组,差异有统计学意义(P<0.05)。
综上所述,采用紫杉醇靶向化疗对小细胞肺癌进行治疗,其可有效提高治疗效果,减少不良反应发生,延长生存时间和提高患者的生存质量。

