猪miR-378种子序列的多态性对其功能以及胴体性状的影响
张廷焕 张利娟 陈四清 郭宗义
(1. 重庆市畜牧科学院,重庆 402460;2. 农业农村部养猪科学重点实验室,重庆 402460)
microRNAs(miRNAs)是一类内源性的短片段非编码 RNAs,调控体内多数基因,广泛参与生物体的生长发育,比如细胞增殖、凋亡和分化,系统的免疫,疾病的发生、发展等[1]。miRNAs基因首先被RNA聚合酶II转录成的初级miRNAs(primiRNAs),在细胞核内由Drosha酶加工成60 bp且具有发夹结构的前体miRNAs(pre-miRNA),然后由细胞质的Dicer酶进一步切割成18-25 bp的成熟miRNAs[2-3]。miRNAs主要是通过其2-8位保守的碱基序列(即种子序列)与mRNA的3′UTR区特异性位点互补配对抑制转录,从而引起靶基因的剪切、脱腺苷化或降解[4]。近年来,越来越多的报道表明miRNA的序列突变后,miRNAs二级结构以及表达水平一般都会发生显著改变[5-7]。特别是,种子序列中的任一碱基的改变,如单核苷酸多态性(SNPs),都会显著影响该miRNA的功能[8-9]。
其中,miR-378是一个与脂肪生成[10-11]、肌肉生长[12-13]和成骨分化[14]等密切相关的表观遗传调控因子。大量研究证明,miR-378在脂肪、肌肉组织中高表达,且对脂肪、肌肉的生成过程起着重要的作用[11,15]。在脂肪细胞中,miR-378的生成会受到一些与脂肪分化相关因子的调控,比如TNF-a、IL-6、Leptin,来影响脂肪分化过程[16];同时在前体脂肪细胞中过表达miR-378能够增加C/EBP-α和C/EBP-β基因的转录和表达,进而促进脂质的生成;miR-378还能靶向调控MAPK1基因,促进前体脂肪细胞的分化[11];敲除miR-378的小鼠会出现体重降低,皮下白色脂肪体积减少等现象[10];对于棕色脂肪而言,miR-378靶定磷酸二酯酶Pde1b来控制增加脂肪产热,从而起到缓解肥胖的效果[17]。此外,在成肌细胞中miR-378能靶向抑制MyoR的表达[12],而MyoR是生肌分化因子(MyoD)的拮抗剂[18],相当于miR-378间接增加了MyoD的表达量,从而促进肌细胞分化;miR-378还可控制内源性靶基因BMP2和MAPK1的表达,以此调控肌生成过程[19];miR-378能与Igf1R结合来影响新生儿心脏的重塑以及心肌细胞的存活[20]。
猪 miR-378 是由 2 号染色体和 12 号染色体上两个不同 miR-378 基因位点转录而成[21]。本实验利用群体遗传分析了miR-378位点在不同猪种中的选择信号;PCR测序获得miR-378-3p种子序列第5位的突变在各个猪种中的基因频率;利用RNAfold软件预测了该突变对其二级结构的改变;在前体脂肪细胞中验证了该突变对其促脂功能的影响;同时对该位点不同基因型与猪背膘厚、眼肌面积等屠宰性状进行了关联分析。旨为明确 miR-378 种子序列多态性对其生物学功能的改变,以及对猪胴体性状的影响。
1 材料与方法
1.1 材料
荣昌猪以及其杂交群体来自荣昌猪国家级保种场、小鼠的前体脂肪细胞(3T3-L1)购自北京协和细胞资源中心。DNA提取试剂盒、RNA提取试剂盒、Q5超保真DNA聚合酶均购自NEB公司;蛋白酶K、GoTaq®qPCR Master Mix试剂盒来自Promega公司;PCR 产物回收试剂盒Omega公司;Lipofectamine 2000购自Invitrogen公司;琼脂糖、DNA marker购自TaKaRa公司;miRNA类似物由锐博公司合成。
1.2 方法
1.2.1 基因组测序数据 提取6头荣昌母猪血液中基因组DNA,所选个体近3代内无直接和间接血缘关系,利用Illumina HiSeq 2000平台进行测序。同时从EMBL-EBI数据库(http://www.ebi.ac.uk/)下载了不同地域猪种的重测序数据,包括亚洲野猪、4个欧洲家猪、11个中国家猪。
1.2.2 单核苷酸多态性(SNP)分析 利用BWA软件将荣昌猪和亚洲野猪重测序数据比对到猪参考基因组,运用SAMtools工具获得单核苷酸多态性位点(single nucleotide polymorphisms,SNP),计算每个个体在每个基因组位置的基因型可能性,并估计等位基因频率。筛选出高质量SNP用于后续分析,判断标准为:SNP测序覆盖度≥4且≤1 000,均方根比对质量≥20,相邻SNP的距离≥5 bp,每组样本的缺失率<50%。
1.2.3 群体遗传选择分析 应用滑行窗口法(100 kb窗口+10 kb步伐)计算100 kb内SNP位点等位基因数进行选择信号分析。对荣昌猪和亚洲野猪的平均杂合度(Hp)、遗传分化系数(Fst)以及选择统计量(Tajima’s D,即基因组中的选择指标)进行量化。为了检测具有显著受选择的基因组区域,运用Z值转换对Hp和Fst值进行标准化,同时在荣昌猪中具有Z(Hp)值低于-2且Z(FST)高于2的窗口可作为强选择信号的区域。
1.2.4 miR-378二级结构及其自由能预测 利用RNAfold在 线 软 件(http://rna.tbi.univie.ac.at//cgibin/RNAWebSuite/RNAfold.cgi)对miR-378野生型和突变型的二级结构及其自由能进行预测。
1.2.5 油红O染色定量 合成了3种不同microRNA类似物,分别为野生型组miR-378W,突变型组miR-378M和对照组Control,其中Control为无义序列,每组设置3个重复孔。将这3种microRNA类似物分别转染到3T3-L1细胞,当细胞在6或12孔板中分化培养到第8天,用PBS(含10%福尔马林)在室温下固定1 h,再用蒸馏水冲洗孔板3次。用含0.5%油红O染色1 h,之后用异丙醇或PBS清洗,即可在显微镜下观察。之后,用异丙醇溶解脂滴,在酶标仪上检测550 nm吸光度值,其中脂肪分化程度和油滴大小与吸光度成正相关。
1.2.6 定量RT-PCR 将上述1.2.5中的3种miRNA类似物分别转染到3T3-L1细胞,每组设置3个重复孔,当细胞在6或12孔板中分化培养到第8天,裂解细胞释放mRNA,随后利用反转录和RT-PCR检测与脂质生成和分解相关基因mRNA表达情况,10 μL反应体系:GoTaq@qPCR Master Mix(2×)5 μL,正、反向引物(10 μmol/L)各0.2 μL,CXR 0.1 μL,cDNA 1μL,ddH2O 3.5 μL。反应程序:95℃ 10 min,95℃ 15 s,60℃ 30 s,40个循环,采用2-△△Ct方法计算基因表达量。RT-PCR所用引物如表1。

表1 RT-PCR引物Table 1 RT-PCR primers
1.2.7 miR-378基因的扩增以及基因型判定 在Ensembl猪 基 因 组 数 据 库(http://www.ensembl.org/Sus_scrofa/Info/Index)中获取位于十二号染色体miR-378附近的基因序列。采用Primer3软件在线(http://bioinfo.ut.ee/primer3-0.4.0/)设计扩增引物(表2)。用 Q5超保真DNA聚合酶配置50 μL PCR反应体 系:5×reaction buffer 10 μL;MgCl2(15 mmol)1.5 μL;dNTPs(10 mmol/L)1.0 μL;forward primers(10 μmol/L)2.5 μL;rorward primers(10 μmol/L)2.5 μL;Template DNA(50 ng/μL)2.0 μL;Q5 highfidelity DNA polymerase 0.5 μL;加水至 50 μL。采用凝胶回收试剂盒纯化PCR产物。随后采用ABI公司 3730 基因序列分析仪以下游引物进行反向测序。将测序峰图文件比对到基因组参考序列中,根据峰图结果判断该位置基因型,如果为G碱基单峰则基因型为GG型;如果为A/G双峰同时出现则基因型为AG型;如果为A碱基单峰基因型为AA型。

表2 miR-378扩增引物Table 2 Amplification primer of miR-378
1.2.8 miR-378种子序列多态性与表型的相关性分析 挑选同一批次、相同饲养条件、相近的屠宰体重(100 kg左右)的荣昌猪杂交群体进行屠宰性能测定,收集基因分型群体的生长、胴体性状指标并与基因型和个体编号一一对应,建立如下的固定效应模型,采用 SAS 统计分析软件包的常规线形模型过程(PRO-GLM)进行重复数不等资料的方差分析和多重比较。
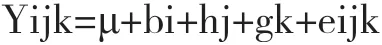
其中,Yijk:个体胴体肉质性状的观测值;μ:胴体及肉质性状的群体均值;bi:第i个品种(种群)效应(i的不同数值代表不同的猪种或杂交组合);hj:第j个场效应值(j的不同数值代表不同的采样猪场);gk:第k个基因型效应(k=1、2、3,分别对应 AA、AG、GG 基因型);eijk:随机残差效应。
1.2.9 统计分析 使用Excel 2013进行试验数据整理,用SPSS l9软件中的Student′s t-test进行差异显著分析,使用Publisher 2013作图。
2 结果
2.1 miR-378位点突变遗传效应分析
猪12染色体上miR-378位位点的坐标为38 396 700-38 396 767,存在于TBX2和BCAC3之间的基因间区。将荣昌猪和亚洲野猪重测序数据与猪参考基因组对比,找到了大量的SNP位点,以每100 kb窗口内的SNP为统计单元进行群体遗传选择分析。结果发现,与亚洲野猪相比,荣昌猪miRNA-378所在区域的Tajima′s D值更偏离零(约-6),表明这个区域存在大量的低频等位基因位点,同时它在荣昌猪中的Z(Hp)值小于-2(约-4.5)且Z(FST)值大于2(约2.5),说明在荣昌猪的驯化过程中,miRNA-378位于一个受到强烈选择的基因组区域中(图1)。

图1 miR-378位点在荣昌猪和亚洲野猪中的群体遗传选择分析Fig.1 Population genetic selection analysis of miR-378 locus in Rongchang pig and Asian wild boar
与参考基因组序列对比发现,在荣昌猪miRNA-378-3p的功能核心区——种子序列中,第5位碱基出现一个由A到G的单碱基突变(A>G)。这个突变导致miRNA-378前体的二级结构发生了显著变化,其茎结构上的凸环显著变小;自由能由原来的-23.00 kcal/mol变为-26.90 kcal/mol,下降17.2%(图2)。这很有可能直接影响成熟miRNA-378的生成以及靶基因的识别,从而直接改变其功能上的表现。
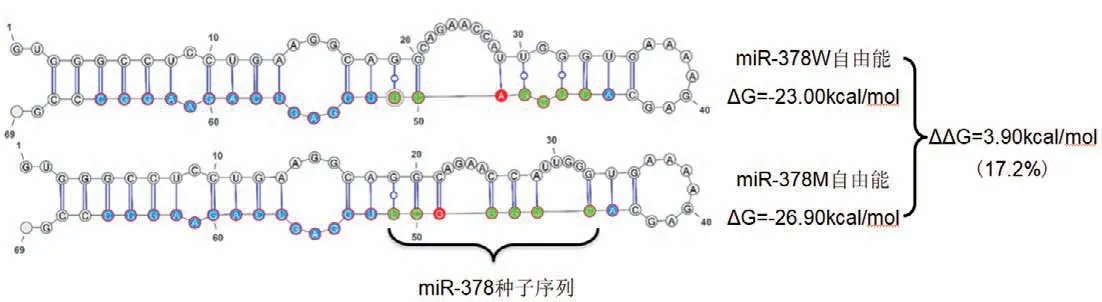
图2 miR-378野生型(miR-378W)和突变型(miR-378M)二级结构以及自由能分析Fig.2 Secondary structure and free energy analysis of miR-378 wild type(miR-378W)and mutated type(miR-378 M)
通过统计不同猪种重测序数据在该突变位点的基因频率发现,在亚洲野猪中A和G的基因频率接近0.5;在长白猪和杜洛克猪种中等位基因A的频率接近1;而在中国12个地方猪种和2个国外猪种(约克夏猪和皮特兰猪)中该位点等位基因的比例不尽相同,其中香猪G等位基因的频率最高,内江猪A等位基因的频率最高,这可能与人工选择的强度大小有关(图3)。
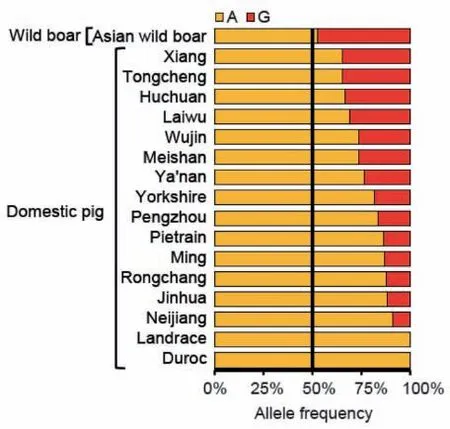
图3 miR-378种子序列第5位碱基(A/G)在不同猪种中的等位基因频率Fig.3 Allele frequency of the fifth base(A/G)of miR-378 seed sequence in different pig breeds
2.2 miR-378突变对脂肪细胞分化以及脂质相关基因表达的影响
miRNA-378已经被报道在脂肪沉积等过程中起重要作用。为了验证种子序列的突变是否改变了miRNA-378的功能,我们将野生型(miR-378W)和突变型(miR-378M)类似物转染至3T3-L1前脂肪细胞中,检测各组脂质沉积情况。在诱导分化第8天,两种miRNA表达水平具有极显著增加,与Control相比,miR-378W提高了~15倍且miR-378M 提高了~21倍(图4-A)。油红O染色发现,与Control组相比,miR-378W组的脂滴累积明显增加,而miR-378M组脂滴累积并不明显(图4-B)。通过酶标仪检测550 nm吸光度值,对脂滴含量进行定量分析也发现,miR-378W组的脂滴含量极显著高于Control组和miR-378M组,miR-378M组与Control组的脂滴含量差异不显著(图4-C)。这说明miR-378能促进脂质沉积,然而其种子序列突变后缺失了促脂生成的功能。

图4 miR-378W和miR-378M对脂肪细胞脂质生成的影响Fig.4 Effects of miR-378W and miR-378 M on the lipid production of adipocytes
随后在脂肪细胞分化过程中,通过对脂肪生成相关基因进行表达量分析发现,与Control组相比,脂肪生成相关基因PPAR-γ、PGC-1α和PGC-1β在miR-378W组表达量显著升高,而在miR-378M组除了PPAR-γ,其他基因的表达量没有变化(图5-A);而在miR-378W组,脂肪分解相关基因HSL、ATGL和CGI-58的表达水平有显著下降,而miR-378M组却没有变化(图5-B)。这表明miR-378种子序列的突变的确改变了对某些脂质相关基因的调控作用。

图5 miR-378W和miR-378M对脂质相关基因表达的影响Fig.5 Effects of miR-378W and miR-378 M on the expression of lipid related genes
2.3 miRNA-378种子序列多态性与表型的相关性分析
miR-378成熟体序列以及其种子序列在10个物种间(猪、人、大鼠、小鼠、牛和羊等)具有高度保守(图6),同时由2.2可知,种子序列的突变改变了miR-378促进脂质生成的功能以及对相应基因的调控作用,因此miR-378极有可能是具有重要功能的经济性状调控位点。

图6 miR-378在10个物种间的碱基序列比对Fig.6 Base sequence alignment of miR-378 among 10 species
为此,我们在107头荣昌猪杂交群体中利用PCR扩增测序发现了该突变位点存在3种基因型(AA、GG和AG)(图7),其中AA型32头、GG型24头、AG型51头。随后将这些猪的屠宰测定数据与该位点基因型进行性状关联分析,结果表明在最小二乘均值方面,最后肋骨处背膘厚性状表现出GG>AG>AA的趋势,并达到显著水平(P<0.05),3个基因型个体最小二乘均值分别为(2.77±0.20)cm、(2.66±0.13)cm 和(2.63±0.16)cm。GG基因型个体的最后肋骨处眼肌面积显著低于AA基因型个体。A等位基因在降低最后肋骨处背膘厚,增大眼肌面积,提高胴体瘦肉率方面的加性效应分别为0.07 cm、1.22 cm2和 0.32%,显性效应分别为-0.04 cm、0.445 cm2和0.07%(表3)。

表3 miR-378种子序列3种基因型在群体中的个体数及与屠宰性状之间的关联分析Table 3 Number of individuals for three genotypes of miR-378 seed sequence in the population and their association with slaughter traits
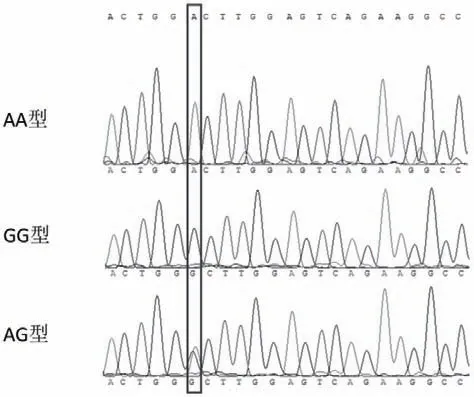
图7 荣昌猪杂交群体中miR-378种子序列多态性测序峰图Fig.7 Polymorphism of miR-378 seed sequence in Rongchang pig cross population
3 讨论
人工选择是影响家畜群体基因平衡的重要因素[22],而荣昌猪12号染色体miR-378位点具有极强的人工选择信号;同时荣昌猪miR-378-3p种子序列第5位发生了突变(A>G);但是这个突变位点在不同猪种中受到的人工选择却大不相同,在自然状态下,亚洲野猪A和G的基因型频率是相同的,然而在受到强烈人工选择的长白猪和杜洛克猪种中G基因型消失了,在其他家猪中也出现了G基因频率不同程度的下降,这说明人工选择更趋向于保留A基因型,且人工选择强度越大A基因频率越高。除此之外,我们还在外种猪(皮特兰猪和约克夏猪)中也发现了G基因型,这与Chai等[15]认为G基因型只存在于中国地方猪种的结论相矛盾。
miRNA的突变通常会改变其pri-miRNAs或premiRNAs的二级结构,从而影响剪切效率,最后导致成熟miRNA表达量的变化。在人MLL-AF4急性淋巴细胞性白血病中,Kotani等[6]发现pre-miR-128b序列中出现一个A>G变异,该突变降低primiR-128b的加工效率,导致成熟体miR-128b的表达量显著下调;Sun等[7]发现茎环结构上的C>T突变改变了pre-miR-15b的二级结构和自由能,影响了pre-miR-15b的生物加工过程;Duan等[9]发现miR-125a种子序列第八位G>T的突变影响了与剪切酶的结合,最终导致成熟体表达量发生改变。而本研究也发现miR-378-3p种子序列第5位A>G的突变使得其茎环结构变小以及自由能下降,这会导致pri-miR-378二级结构更加稳定,有利于提高Drosha酶对pri-miR-378的剪切效率,促进pri-miR-378到pre-miR-378的加工过程。
种子序列是动物miRNA识别并结合靶基因的关键功能元件,种子序列的突变会直接导致miRNA功能的改变。大量研究证明,miR-378在脂肪组织中具有较高的表达水平,能够在脂肪细胞中调控C/EBP-α和C/EBP-β基因的转录和表达,进而促进脂肪细胞分化、脂质的增加[11]。的确,我们通过microRNA 类似物的转染实验发现了miR-378具有促脂肪生成的作用,但种子序列A>G的突变导致了miR-378缺失了相应的功能,这与先前的报道一致[15]。同时脂肪细胞在脂质沉积过程中,不仅受到脂肪分化相关基因的影响,而且也会受脂肪分解代谢相关基因的影响。PGC-1α和PGC-1β对脂肪细胞分化、线粒体合成以及能量代谢具有重要的调节作用[23-24];PPAR-γ能调控脂肪分化相关的信号转导,降低脂肪分解速度[25]。而ATGL和HSL是重要的脂肪分解酶,二者可共同作用通过催化甘油三酯水解形成游离脂肪酸,调节脂肪分解代谢过程[26-27];而CGI-58 是 ATGL 的激活剂[28]。本研究发现miR-378W可以通过上调与脂肪分化相关基因(PGC-1α、PGC-1β、PPAR-γ)的表达和下调与脂肪分解相关基因(ATGL、HSL、CGI-5)的表达两种途径来影响脂质生成。但很遗憾,我们并没有在这些与脂肪生成、分解直接相关基因的3′ UTR区发现miR-378的结合位点,这可能是通过一些其他通路(如C/EBP-α等)间接调控这些基因。然而除了PPAR-γ以外,miR-378M并未影响其他基因的表达,说明种子序列突变改变了miR-378在脂肪细胞中的基因调控方式,最终影响细胞分化和脂质沉积的功能。
背膘厚和眼肌面积遗传力高,二者是猪遗传育种和性能鉴定中的重要参数[29]。近年来,猪的主要选育方向是减小背膘厚度,增加眼肌面积,提高胴体瘦肉率。我们通过比较猪miRNA-378 种子序列多态性与屠宰性能测定数据发现,与突变GG型相比,野生纯合子AA型和杂合子AG型的背膘厚有显著的减小,这与miR-378敲除的小鼠皮下脂肪体积减少的现象相一致;而AA型的眼肌面积比GG型有显著的增加;再加之前面阐述的人工选择强度越大A基因频率越高的特点,这些发现都与选育目标十分吻合。除此之外,我们还发现在细胞水平验证得出的脂肪沉积能力野生型(AA)大于突变型(GG)的结论与猪背膘厚GG>AG>AA的趋势相悖,而miRNA-378对于脂肪组织(背膘)和肌肉组织(眼肌)的大小有着相反的作用结果,这可能与miR-378调控细胞的增殖和凋亡的功能相关。组织大小是由细胞在发育过程中的数量决定的,主要表现在增殖和凋亡两方面[30],miRNA-378在不同细胞中扮演者不同的作用,如miRNA-378可靶向BRAF抑制大肠癌细胞增殖和诱导凋亡[31];能降低SDAD1表达来抑制结肠癌细胞的增殖[32];下调KLF9促进骨肉瘤细胞增殖[33];抑制骨髓增生异常综合征细胞生长和促进凋亡[34]等。然而在脂肪细胞中miRNA-378能促进细胞凋亡[35],所以AA型虽然能促进脂肪增加,但减少了细胞数量降低背膘厚度;在肌细胞中miRNA-378能抑制细胞凋亡[36],故AA型能增加细胞数量,提升眼肌面积。
4 结论
本研究发现了猪miR-378位点具有极强的人工选择信号,其种子序列的多态性不仅改变了miR-378的功能,而且与猪的背膘厚度和眼肌面积指标显著相关,该位点可作为猪遗传分子标记用于猪的育种实践中。

