不同耐伊维菌素捻转血矛线虫国内分离株耐阿苯达唑特性
罗晓平,王鹏龙,李军燕,杨晓野*,耿万恒,冯新港,刘 威,李 超,刘 阳,王 瑞
(1.内蒙古农业大学 兽医学院 农业部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 010018;2.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;3.中国农业科学院 上海兽医研究所,上海 200241)
捻转血矛线虫(Haemonchuscontortus)属毛圆科(Trichostrongylidae)血矛属(Haemonchus),是寄生于牛羊等反刍动物体内的重要胃肠道线虫之一,主要导致宿主贫血、水肿、衰弱及消化紊乱,对家畜造成严重危害,国内已对其进行了系列研究[1-6]。国家“973”计划“牛羊重要寄生虫致病机制的分子基础研发”及国家重点研发计划“严重危害畜禽的寄生虫病诊断、检测与防控新技术”项目已将捻转血矛线虫列为重点研究内容,且前期许多研究结果显示,国内大部分地区绝大多数羊捻转血矛线虫都存在对常用驱虫药物的耐药性,包括伊维菌素(ivermectin,IVM)和阿苯达唑(albendazole)[7-12]。
目前,除IVM外,阿苯达唑是使用最多的一种广谱驱虫药,其属于苯并咪唑氨基甲酸酯类药物,由于其不仅可以驱除胃肠道线虫的成虫和第4期幼虫,还可以驱除绦虫及肺线虫的成虫和幼虫,在高剂量下,对大于14周龄的肝片吸血虫也具有杀虫效果,且该药还是一种潜在的治疗贾第虫药物[13-14],因此,虽然使用起来较IVM繁琐,但也深受农牧民等养殖业主的青睐。该药主要通过选择性地与β-微管蛋白结合,打破微管与微管蛋白之间的平衡而发挥作用。在捻转血矛线虫中,其耐药性产生主要是由于Ⅰ型β微管蛋白基因上的3个SNP造成,包括:167(T/A)、198(A/C)和200(T/A)[15-17]。对于阿苯达唑耐药性的检测,世界兽医促进会推介使用粪便虫卵减少试验和虫卵孵化幼虫试验方法进行分析[18],同时,也有基于Ⅰ型β微管蛋白基因分子检测的报道[19-20]。为此,本试验通过虫卵孵化幼虫试验和Ⅰ型β微管蛋白基因多态性分析方法,从表型和分子遗传学层面,对IVM耐药及敏感的捻转血矛线虫国内分离株进行耐阿苯达唑检测,以了解其双重耐药性问题,并为国内捻转血矛线虫耐药性研究提供依据。
1 材料与方法
1.1 试验虫株对IVM耐药的捻转血矛线虫国内分离株(WSHc-001、WSHc-003、WSHc-138、CYHHc-136)及对IVM敏感的捻转血矛线虫国内分离株(YCHc-022)成虫样本,于75%酒精固定,保存在内蒙古农业大学兽医学院寄生虫学实验室;感染不同捻转血矛线虫虫株的羊,用单独笼具内隔离饲养于内蒙古自治区农牧业科学院实验动物基地家畜寄生虫病学研究室动物房。
1.2 主要试剂阿苯达唑原粉(欧洲标准品),购自坛墨质检-标准物质中心;NCTC109培养基(gibco),购自赛默飞世尔(苏州)仪器有限公司;DMSO(分析纯),购自SIGMA-ALDRICH;DNA提取试剂盒、DL2000 DNA Marker及2×PCR Mix,均购自天根生化科技(北京)有限公司。
1.3 阿苯达唑药液配制参照参考文献[18,21]药液配制方法,准确称取阿苯达唑原粉8 mg溶于800 μL的DMSO中,得到阿苯达唑储存液A,质量浓度为10 g/L;然后,取100 μL阿苯达唑储存液A,使用DMSO稀释10倍得到阿苯达唑储备液B,质量浓度为1 g/L;再按照表1配制不同质量浓度的阿苯达唑工作液C,备用。

表1 阿苯达唑工作液配制方法及培养液终质量浓度
1.4 虫卵收集对羊进行直肠采粪后,将新鲜粪便样本置于50 mL离心管中,用0.5%甲醛溶液将离心管装满,并用力摇晃,以达到无氧的目的,随后带回实验室。将样本置于研钵内,弃掉液体,加适量饱和生理盐水后将粪便样本研碎,再加入10倍体积的饱和生理盐水,混匀后经40,100目筛网依次过滤,在滤液中加入1/5体积的饱和蔗糖滤液,混匀后倒于大平皿内,补充饱和生理盐水至液面略高于平皿口,上面覆盖一张硬塑料膜。静置15 min后,将硬塑料膜轻轻抬起,用去离子水将膜面上的虫卵冲入烧杯,3 000 r/min 离心漂洗3次后,对虫卵进行镜检,确认无大粒杂质后对虫卵进行计数,并将虫卵稀释成400枚/mL左右的浓度。
1.5 培养体系配置及虫卵计数使用24孔培养板进行培养,每组设置8个药物浓度及1个阴性对照组和1个阳性对照组。每孔总体积为2 mL,其中虫卵悬浮液250 μL、不同质量浓度阿苯达唑工作液10 μL、NCTC109培养基350 μL、去离子水1 390 μL。每个虫株设2个重复,每个重复设3个平行。对孔内虫卵进行计数,置于27℃生化培养箱中培养,48 h后再次对每孔内未孵化的虫卵进行计数。
1.6 虫卵孵化幼虫试验结果判定对每组计数结果使用GraphPad Prism 6.0软件中的log(agonist)vs.response--Variable slope(four parameters)方法统计EC50值和R2。依据参考文献[18,21]推荐的标准,当EC50≥0.1 mg/L时,则认为备检虫株存在耐药性;而EC50<0.1 mg/L时,则认为备检虫株对药物敏感。
1.7 不同虫株成虫基因组DNA提取将保存于75%酒精中的不同捻转血矛线虫成虫(雌、雄虫各25条)取出,用去离子水漂洗3~5次,置于PBS溶液中浸泡过夜,之后再次用去离子水漂洗2次,用于DNA提取。所有虫体基因组DNA提取过程均参照试剂盒说明进行。DNA提取完成后,使用核酸蛋白检测仪测定DNA浓度,质量较好的DNA样本用于后续研究。
1.8 Ⅰ型β微管蛋白基因的PCR扩增及测序以鉴定合格的样本DNA为模版,用引物[22]HcPy2PCR-F(5′-GACGCATTCACTTGGAGGA-G-3′)/HcPy2PCR-R(5′Biotin-CATAGGTTGGA TTGTGAGTT-3′)扩增Ⅰ型β微管蛋白基因(385 bp),经琼脂糖凝胶电泳后将产物直接测序(双向)。PCR反应体系25 μL:10 mmol/L 上、下游引物各1 μL,2×PCR Mix 12.5 μL,DNA模版2 μL,无菌无酶水8.5 μL;扩增条件:94℃ 5 min;94℃ 40 s,53℃ 40 s,68℃ 40 s,40个循环;68℃ 7 min。4℃保存备用。
1.9 序列分析与结果判定将所得序列使用Lasergene 7.0软件进行分析,人工校正,与基因库中标准的Ⅰ型β微管蛋白基因序列比对,分析序列中第167、198、200位点单核苷酸多态性,并统计不同捻转血矛线虫虫株Ⅰ型β微管蛋白基因的基因型及其频率。依据参考文献[23]报道的方法对结果进行判定:若1个种群中,有超过10%的个体携带耐药基因型(在1个位点存在纯合耐药基因型或在2个位点位点同时存在杂合子基因型),则认为这个种群存在耐药性。
2 结果
2.1 不同虫株虫卵孵化幼虫试验结果采用参考文献[18]推荐的虫卵孵化幼虫试验,对不同分离株耐阿苯达唑特性进行分析。结果如表2及图1~5所示,所分离的对IVM耐药捻转血矛线虫虫株同时对阿苯达唑耐药,且所有耐药虫株EC50较检测标准0.1 mg/L要高出数倍,尤其是WSHc-001,其EC50值达到了1.4 mg/L。而所分离的对IVM敏感捻转血矛线虫虫株同时对阿苯达唑不耐药,其EC50值仅为0.07 mg/L。

表2 阿苯达唑对不同分离株EC50统计结果

图1 YCHc-022株虫卵孵化幼虫试验检测结果
2.2 不同捻转血矛线虫分离株Ⅰ型β微管蛋白基因PCR扩增结果使用针对捻转血矛线虫Ⅰ型β微管蛋白基因的特异性引物,对鉴定合格样本进行目的条带扩增,结果如图6所示:所有检测样本在琼脂糖凝胶上均出现了385 bp的目的条带,表明基因扩增成功,产物可进行测序,用于特异性位点的单核苷酸多态性分析。

图2 WSHc-001株虫卵孵化幼虫试验检测结果 图3 WSHc-003株虫卵孵化幼虫试验检测结果

图4 WSHc-138株虫卵孵化幼虫试验检测结果 图5 CYHHc-136株虫卵孵化幼虫试验检测结果

M.DL2000 DNA Marker;1~23.待检样品;C.阴性对照(灭菌蒸馏水)
2.3 捻转血矛线虫分离株Ⅰ型β微管蛋白基因特异性位点SNP分析结果对捻转血矛线虫虫体Ⅰ型β微管蛋白基因中与阿苯达唑耐药相关的第167、198、200位单核苷酸的多态性进行分析,结果显示,所有虫株中,167位点仅存在纯合敏感型(TTC);198位点存在纯合敏感型(GAA)、杂合耐药型(GCA/GAA)及纯合耐药型(GCA),状况最为复杂;而在200位点,绝大部分仅存在纯合敏感型(TTC)和杂合耐药型(TTC/TAC);纯合耐药型(TAC)在CYHHc-136虫株中大量存在,而在WSHc-138虫株的雌虫中少量存在,且在YCHc-022虫株中也出现1个。
2.3.1WSHc-001虫株 所有样本在167位点均为纯合敏感型(TTC);在198位点,存在纯合敏感型(GAA)、杂合耐药型(GCA/GAA)及纯合耐药型(GCA)3种类型,且雌雄虫间各自占比有所不同,其中纯合耐药型占比达到52.4%,在雌雄虫中所占比例分别为60.9%和42.1%;而在200位点,未见纯合耐药型(TAC)(表3),表明该虫株具有耐药性。

表3 WSHc-001虫株Ⅰ型β微管蛋白基因167、198、200位点的单核苷酸多态性
2.3.2WSHc-003虫株 所有样本在167位点均为纯合敏感型(TTC)。在198位点,存在纯合敏感型(GAA)、杂合耐药型(GCA/GAA)及纯合耐药型(GCA)3种类型;其中,纯合耐药型占比总体达到30%,在雌雄虫中所占比例分别为27.3%和33.3%。200位点,未见纯合耐药型(TAC)(表4),表明该虫株具有耐药性。

表4 WSHc-003虫株Ⅰ型β微管蛋白基因167、198、200位点的单核苷酸多态性
2.3.3WSHc-138虫株 所有样本在167位点均为纯合敏感型(TTC);在198位点,纯合耐药型(GCA)占比总体达到40.9%,在雌雄虫中所占比例分别为47.6%和34.8%;200位点,纯合耐药型(TAC)占比为4.8%,而雄虫中未见纯合耐药型(表5),表明其具有耐药性。
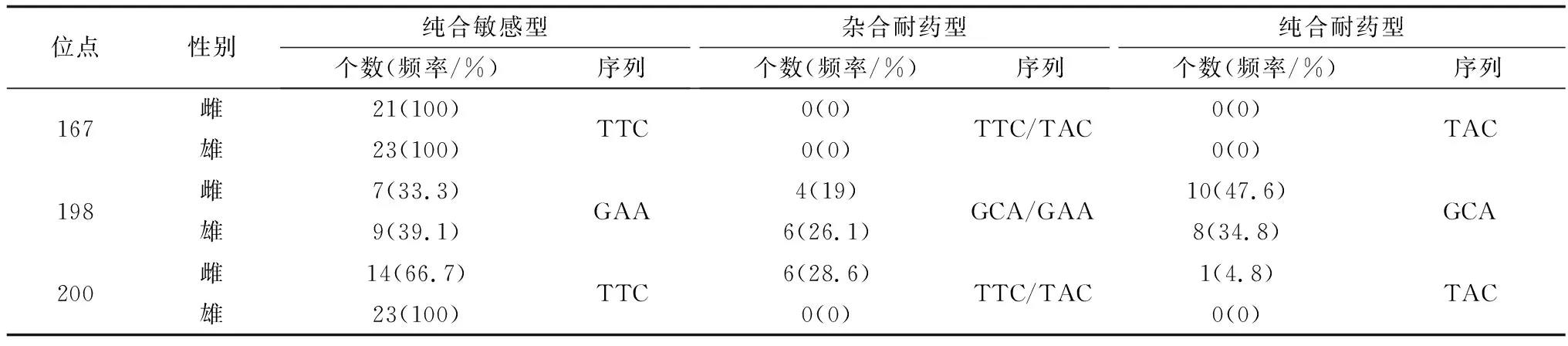
表5 WSHc-138虫株Ⅰ型β微管蛋白基因167、198、200位点的单核苷酸多态性
2.3.4CYHHc-136虫株 所有样本在167位点均为纯合敏感型(TTC);在198位点,纯合耐药型(GCA)总体占比为14.0%;200位点,纯合耐药型(TAC)总体占比达到14.0%(表6),表明该虫株具有耐药性。

表6 CYHHc-136虫株Ⅰ型β微管蛋白基因167、198、200位点的单核苷酸多态性
根据198位点纯合耐药型占比,雌虫耐药而雄虫不耐药;而根据200位点纯合耐药型分析,雌虫不耐药而雄虫耐药。两者相结合后,雌雄虫则均耐药。
2.3.5YCHc-022虫株 在198位点雄虫中有4.2%虫体出现纯合耐药型(GCA),而雌虫中并未出现,总体而言,其纯合耐药型占比仅为2.17%,且200位点和167位点也均未见纯合耐药型,表明其对阿苯达唑敏感(表7)。但是,种群中出现了大量的单位点杂合耐药型及个别的单位点纯合耐药型,故该虫株存在对阿苯达唑产生耐药性的风险。

表7 YCHc-022虫株Ⅰ型β微管蛋白基因167、198及200位点的单核苷酸多态性
2.4 捻转血矛线虫分离株Ⅰ型β微管蛋白基因型及其频率分析结果对所有捻转血矛线虫分离株测序峰图进行分析发现,Ⅰ型β微管蛋白基因序列中存在7种基因型,包括198位点纯合敏感型(GAA)及200位点纯合敏感型(TTC)、198位点纯合敏感型(GAA)及22位点杂合耐药型(TAC/TTC)、198位点纯合敏感型(GAA)及200位点纯合耐药型(TAC)、198位点杂合耐药型(GAA/GCA)及200位点纯合敏感型、198位点杂合耐药型(GAA/GCA)及200位点杂合耐药型(TAC/TTC)、198位点纯合耐药型(GCA)及200位点杂合耐药型(TAC/TTC)、198位点纯合耐药型(GCA)及200位点纯合敏感型(TTC)(图7~13)。对于不同分离株,除167位点所有检测虫体均为纯合敏感型(TTC)外,各分离株198位点和200位点所含基因型也有所不同。其2个位点同时存在杂合耐药基因型(Het-198且Het-200)所含个体数及其频率如表8所示,对伊维菌素耐药捻转血矛线虫分离株(WSHc-001、WSHc-003、WSHc-138、CYHHc-136)而言,其种群内基因频率为15.9%~51.2%,表明各分离株对阿苯达唑也存在耐药性。对雌雄虫分别分析显示,在4个分离株中,WSHc-001和WSHc-138雌虫双位点杂合耐药型占比低于10%的临界值;其余分离株不论雌雄,其双位点杂合耐药型频率均在10%以上。对YCHc-022虫株而言,虽然群体双位点杂合耐药型频率仅有8.7%,低于10%的临界值,显示虫株对阿苯达唑敏感,但其雌虫中双位点杂合耐药型占比却达到了13.6%,显示出雌虫对阿苯达唑的耐药性,而雄虫中占比仅为4.2%。

图7 198位点纯合敏感型(GAA)及200位点纯合敏感型(TTC)
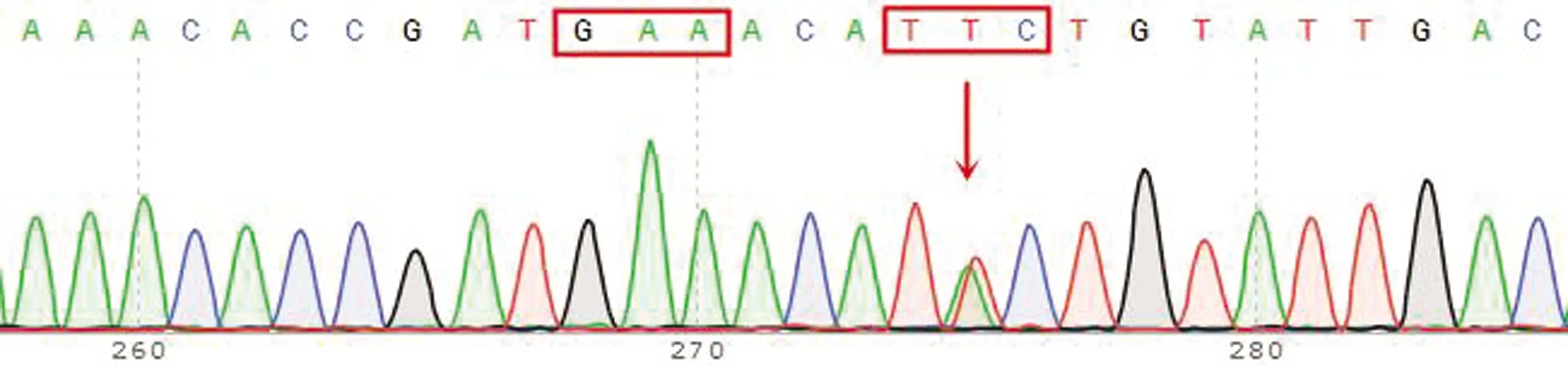
图8 198位点纯合敏感型(GAA)及200位点杂合耐药型(TAC/TTC)

图9 198位点纯合敏感型(GAA)及200位点纯合耐药型(TAC)

图10 198位点杂合耐药型(GAA/GCA)及200位点纯合敏感型

图11 198位点杂合耐药型(GAA/GCA)及200位点杂合耐药型(TAC/TTC)

图12 198位点纯合耐药型(GCA)及200位点杂合耐药型(TAC/TTC)

图13 198位点纯合耐药型(GCA)及200位点纯合敏感型(TTC)

表8 不同虫株Ⅰ型β微管蛋白基因2个位点同时出现杂合耐药型频率统计结果
3 讨论
对于羊捻转血矛线虫病而言,常用的驱虫药物主要包括苯并咪唑类(阿苯达唑等)和大环内脂类(IVM等)。据报道,国外不同地区捻转血矛线虫均对阿苯达唑产生了不同程度的耐药性[24-25]。国内,林琳等[26]对福建山羊感染的捻转血矛线虫耐药性检测结果显示,虫体对阿苯达唑具有一定的耐药性;蔡葵蒸等[27]对宁夏地区16个羊场的调查结果显示,25%养殖场中胃肠道线虫对阿苯达唑存在耐药性;额叶勒德格等[9]对内蒙古乌审旗绵羊胃肠道线虫耐药性调查结果显示,以捻转血矛线虫和细颈线虫为主的胃肠道线虫对阿苯达唑产生了严重的耐药性;本研究团队前期对内蒙古呼伦贝尔新巴尔虎右旗某牧场放牧羊的驱虫试验也表明,以捻转血矛线虫为主的胃肠道线虫对阿苯达唑存在耐药性[7]。
本研究中,首先通过虫卵孵化幼虫试验,对捻转血矛线虫耐IVM分离虫株的耐阿苯达唑特性进行分析,不论按COLES等[18]推荐的检测限量(EC50≥0.1 mg/L为耐药,EC50<0.1 mg/L为敏感),还是按参考文献[8]给出的检测限量(EC50≥0.08 mg/L 为耐药,0.08 mg/L>EC50≥0.05 mg/L为疑似耐药,EC50<0.05 mg/L为敏感),均表明所分离到的4株耐IVM虫株同样耐阿苯达唑(EC50介于0.25~1.4 mg/L),而对IVM敏感的虫株对阿苯达唑敏感或疑似耐药(EC50值为0.07 mg/L)。究其原因,在捻转血矛线虫耐IVM分离株来源的羊群所处地区,农牧民都有每年定期对羊只进行全群驱虫的习惯,如春秋2次驱虫。更有甚者,1年中每个月都进行1次驱虫,但所用药物则相对单一,以IVM注射液和阿苯达唑片剂为主。而对IVM敏感捻转血矛线虫虫株分离地,则人们对驱虫不太重视,只有当羊只消瘦且发育迟缓后,才进行个体性驱虫,所使用的驱虫药也是IVM注射液和阿苯达唑片剂,但并非全群用药。所以1个虫株出现多重耐药是可以理解的,敏感虫株EC50值大于绝对敏感虫株也是正常的。为此,基于包括捻转血矛线虫在内的羊胃肠道线虫对常用驱虫药耐药性日益凸显的问题,应加强新型驱虫策略的宣传,如推广检测性驱虫模式,减少盲目用药导致的寄生虫耐药性的产生。同时,鉴于虫体对IVM与阿苯达唑耐药性的严重性,在临床实践中,应逐步减少上述两类药物的使用频率,而更多选用其他驱虫药。
对不同捻转血矛线虫分离株与阿苯达唑耐药相关Ⅰ型β微管蛋白基因上特异性位点SNP进行分析,发现所有虫株167位点均为纯合敏感型(TTC),这与张宗泽[11]对国内不同地区羊捻转血矛线虫的分析以及杨新等[20]对新疆某养殖场捻转血矛线虫的检测结果一致。据BARRERE等[23]报道,若一个种群中,有超过10%的个体携带耐药基因型(在167位点存在纯合耐药基因型或在200位点存在纯合耐药基因型,或在167位点和200位点同时存在杂合子基因型),则认为这个种群存在耐药性。而张宗泽[11]在分析了国内捻转血矛线虫这3个SNP后,认为国内不同来源捻转血矛线虫167位点只有纯合敏感型,故对于国内捻转血矛线虫而言,对阿苯达唑的耐药评价标准应为:一个种群中,有超过10%的个体携带耐药基因型(在198位点存在纯合耐药基因型或在200位点存在纯合耐药基因型,也或在198位点和200位点同时存在杂合子基因型)。据此分析,本研究中所有对IVM耐药的分离株种群内均超过10%的个体携带198位点纯合耐药基因型(为14%~52.4%);同时,有超过10%的个体198位点和200位点同时存在杂合子基因型(15.9%~51.2%)。在对IVM敏感的分离株中,低于10%的个体携带198位点纯合耐药基因型(2.17%),同时低于10%的个体198位点和200位点同时存在杂合子基因型(8.7%),表明所有分离株通过虫卵孵化幼虫试验所得结果与分子生物学检测结果相一致。同时,分析上述3个耐药性SNP突变在不同虫株中所占百分比与虫卵孵化幼虫试所得EC50值的相关性,可以发现,在捻转血矛线虫对阿苯达唑的耐药性检测限量中,蔡葵蒸[8]给出的标准中含有疑似耐药指标更为合理。当然,对上述耐药性检测标准还有待于进一步验证。
本试验结果表明,所分离的对IVM耐药的捻转血矛线虫分离株同时也具有对阿苯达唑的耐药性,即存在双重耐药性。而对IVM敏感的捻转血矛线虫分离株则对阿苯达唑不耐药,但也存在对阿苯达唑产生耐药性的风险。
——水芹主要害虫识别与为害症状

